重组人血白蛋白蛋白质含量R S20国家标准品的研制
2022-02-12王敏力王弢周倩马力陈家啡曹大伟梁蔚阳何永兵余进李炎徐苗侯继锋
王敏力,王弢,周倩,马力,陈家啡,曹大伟,梁蔚阳,何永兵,余进,李炎,徐苗,侯继锋
1.中国食品药品检定研究院WHO生物制品标准化和评价合作中心 卫生部生物技术产品检定方法及标准化重点实验室 国家药品监督管理局生物制品质量研究与评价重点实验室,北京100050;2.兰州生物制品研究所有限责任公司,甘肃兰州730046;3.华兰生物工程股份有限公司,河南新乡453003;4.博雅生物集团股份有限公司,江西抚州344000;5.山东泰邦生物制品有限公司,山东 泰安271000;6.广东省药品检验所,广东 广州510180;7.四川远大蜀阳药业有限责任公司,四川 成都610214;8.上海莱士血液制品股份有限公司,上海200245;9.四川省食品药品检验检测院,四川 成都611731
近年,重组人血白蛋白(recombinant human albumin)的研发进展迅速,未来上市后将有助于解决现阶段的原料血浆来源紧张和血液制品病毒安全性问题。重组人血白蛋白的表达体系为酵母(毕赤酵母或酿酒酵母)、水稻胚乳细胞等。传统的基因重组药物的蛋白质含量仅需达到μg/L或mg/L级别即可满足临床需求,而重组人血白蛋白终产品的蛋白质含量应达到50~250 g/L,临床使用时输注总量应达到10 g或10 g以上才能起到治疗作用,因此,该产品的研制、生产及质量控制面临更多技术瓶颈,在关键质量控制中应包括且不限于生产过程中工艺及产品相关杂质控制、结构一致性确认与控制等[1]。特别应严格控制糖基化或糖化的重组人血白蛋白、宿主细胞残留蛋白等潜在危害性杂质。
因此,为提高在重组人血白蛋白质量控制中特别是定量实验结果的准确性,引入重组人血白蛋白的蛋白质含量国家标准品成为迫切需要。本研究采用重组人血白蛋白为原料制备蛋白质含量RS20(reference standard 20)国家标准品,应用凯氏定氮法在多个实验室进行标定,以期应用于重组人血白蛋白等产品的质量控制。
1 材料与方法
1.1原料 重组人血白蛋白原料由中国食品药品检定研究院提供,规格为:200 mg/mL,50 mL/瓶,UPLC-SEC法未检出多聚体及裂解物,Native电泳法纯度>99.9%。
1.2蛋白质含量R S20国家标准品的制备 在符合药品GMP要求的车间内,将原料用灭菌注射用水稀释至蛋白质终浓度约为20 mg/mL后,经0.22μm除菌过滤,按1 mL/支分装,冻干,于-20℃保存。
1.3标定方法 参与协作标定的单位包括中国食品药品检定研究院、国内部分血液制品批签发授权药检所、血液制品生产企业等共8家机构(代码分别为LAB01~LAB08)。将1.2项制备的样品于2~8℃条件下运输至8家机构实验室,按《中国药典》三部(2020版)[2]中的凯氏定氮法进行检测,各实验室分别进行6~10次独立测定。以蛋白质含量(0.40 mg/mL浓度级差递增)为横坐标,数据数量频数为纵坐标,绘制标准品蛋白质含量数据数量的频数分布图。
1.4标准品的检定
1.4.1分装误差 于标准品生产过程中分装(冻干前)前、中、后段,按照分装企业SOP规定随机共抽取6支样品,并测定装量,计算分装误差。
1.4.2水分含量 将标准品于2~8℃保存87 d,取3支样品,按《中国药典》三部(2020版)[3]中费休氏法-容量滴定法进行水分测定。
1.4.3均匀性 将标准品于2~8℃保存87 d,取5支样品,按《中国药典》三部(2020版)[4]附录0102项下装量差异方法进行检测。
1.4.4稳定性 将制备的标准品于-20℃保存14个月,分别于2、3、4、5、6、7、14个月取样;分别于-20、4、23、32℃保存6个月,取样。按《中国药典》三部(2020版)[2]中凯氏定氮法检测蛋白质含量。
2 结果
2.1标准品的协作标定 参加协作标定的8家实验室对制备的标准品共进行了58次独立测定,实验室间均值为19.05 mg/mL,95%置信区间为18.80~19.31 mg/mL,均值标准差为0.308 7 mg/mL,标准误为0.109 1 mg/mL,相对标准偏差(RSD)为1.62%。各实验室室内结果间及室间检测结果均值均符合正态分布。见图1和表1。8家实验室检测标准品的蛋白含量数据数量频数在18.80~19.20 mg/mL区间,呈明显集中趋势,表明实验室误差与方法偏倚较小。见图2。

图1 8家实验室对重组人血白蛋白蛋白质含量RS20国家标准品的标定结果Fig.1 Calibration results of national standard RS20 for recombinant human albumin protein content by eight laboratories

图2 重组人血白蛋白蛋白质含量RS20国家标准品标定结果的数据数量频数分布图Fig.2 Data frequency distribution of calibration results of national standard RS20 for recombinant human albumin protein content
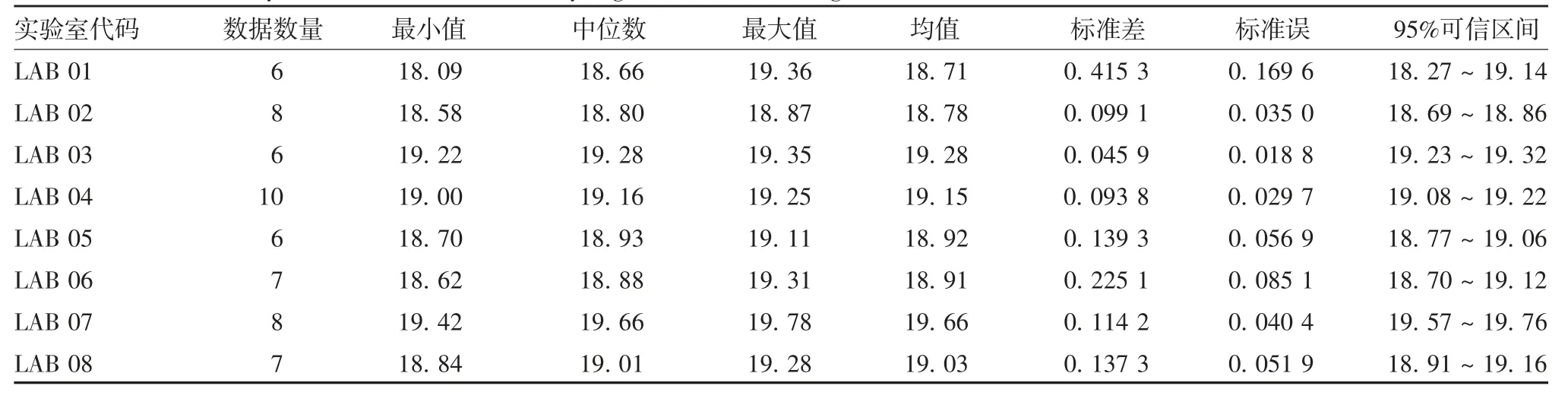
表1 8家实验室标定结果的统计分析(mg/mL)Tab.1 Statistical analysis of calibration results by eight laboratories(mg/mL)
2.2标准品检定结果
2.2.1分装误差 于标准品分装过程前、中、后段随机抽取6支样品,分装误差分别为-0.07%、-0.04%、0.04%、0.01%、0.08%、-0.02%,均在±0.1%以内,符合相关要求。
2.2.2水分含量 3支标准品样品的水分含量分别为1.44%、2.43%、2.25%,均值约2.0%,均<3.0%,符合相关规定。
2.2.3均匀性 5支标准品样品的装量差异分别为-0.5%、0.5%、0%、-0.5%、0%,均在±1%以内,符合相关规定。
2.2.4稳定性 标准品于-20℃保存2、3、4、5、6、7、14个月时蛋白质含量分别为18.09、18.58、18.71、19.36、18.88、18.61、18.48 mg/mL;于-20、4、23、32℃保存6个月时蛋白质含量分别为18.48、18.82、18.60、18.35 mg/mL。两者变化均较小,均在LAB01实验室内控范围(均值±2标准差),即17.87~19.55 mg/mL范围内。表明制备的标准品具有良好的稳定性。
3 讨论
重组人血白蛋白现阶段主要的表达体系包括毕赤酵母、酿酒酵母、水稻胚乳细胞等,大肠埃希菌也可成功表达并获得较高浓度产物[5-6],快速发展的有效纯化工艺大幅提高了酵母发酵及水稻胚乳细胞来源的白蛋白含量[7-11]。重组人血白蛋白除了可替代血浆来源的蛋白外,还可以结合药物融合技术用于延长已上市产品药物的血清半衰期等,应用前景广泛[12-14]。
近期,针对新型重组人白蛋白在健康人体内的安全性、耐受性、免疫原性、药动学和药效学进行了随机剂量放大研究,结果表明,重组人白蛋白耐受性良好,所有副反应均为轻度或中度,且发生率与人血白蛋白相近,给药后免疫反应相关抗体或细胞因子无变化[15]。但重组人血白蛋白超高的蛋白浓度背景、分子的运载特性、复杂繁多的二硫键、完整分子量层面结构差异[16]等多个因素使其质量控制和质量研究较为复杂。重组人血白蛋白应与人血白蛋白具有相同的空间结构和理化特性[17-18],对其中的糖类蛋白物质、工艺相关杂质残留、宿主细胞蛋白残留等均应进行严格控制[19-20]。对蛋白质含量定量的相关检测项目,应优先选用浓度与待测物相近的同质标准品以实现准确定量。
本研究采用重组人血白蛋白为原料,按约20 mg/mL的理论蛋白浓度进行稀释,制备了重组人血白蛋白蛋白质含量RS20国家标准品。8家机构的实验室均采用凯氏定氮法检测蛋白质含量,对制备的标准品进行标定,测定本批标准品蛋白质含量为18.71~19.66 mg/mL,均值为19.05 mg/mL,95%置信区间为18.80~19.31 mg/mL,综合考虑制备过程中配制、除菌过程等因素的影响,认为该结果与理论蛋白浓度基本一致。实验室间检测结果均值RSD为1.62%,表明实验室间标定结果差异较小。为提高该批标准品的稳定性和有效期,本批标准品制备为冻干剂型,于-20℃保存14个月及分别于-20、4、23、32℃保存6个月,标准品中的蛋白质含量均未发生趋势性变化,满足技术预期要求[21-22]。建议本标准品应存放于2~8或-20℃冷冻存放及运输。
综上所述,本研究制备的标准品符合各项预期技术指标和相关规定,规定代码为:280030-201901,可用于重组人血白蛋白等产品的质量控制。
志谢衷心感谢兰州生物制品研究所有限责任公司、华兰生物工程股份有限公司、博雅生物集团股份有限公司、山东泰邦生物制品有限公司、广东省药品检验所、四川远大蜀阳药业有限责任公司、上海莱士血液制品股份有限公司、四川省食品药品检验检测院所有参与本次标准品生产研制和协作标定的工作人员
