内镜透明帽辅助黏膜切除术与内镜黏膜下剥离术治疗Ⅰ型胃神经内分泌肿瘤的对照研究
2022-02-11刘金燕项英袁颖王振宇王亚楠吕瑛王雷徐桂芳
刘金燕,项英,袁颖,王振宇,王亚楠,吕瑛,王雷,徐桂芳
【提要】目的 比较内镜下透明帽辅助黏膜切除术(EMR-C)和内镜黏膜下剥离术(ESD)治疗Ⅰ型胃神经内分泌肿瘤的疗效,并探究Ⅰ型胃神经内分泌肿瘤复发的危险因素。方法 收集2006年11月至2022年5月南京市鼓楼医院确诊为Ⅰ型胃神经内分泌肿瘤的病例,根据手术方式分为EMR-C组和ESD组,比较两组的疗效;分析Ⅰ型胃神经内分泌肿瘤复发的危险因素。结果 患者的平均年龄(52.2±10.8)岁,肿瘤直径中位值0.5 cm(IQR 0.3~0.9 cm)。14例行EMR-C治疗,63例行ESD治疗,两组患者基线资料无统计学差异。EMR-C组手术切除时间明显较ESD组短,住院总费用也较ESD组低(P均<0.01)。单因素分析显示Ⅰ型胃神经内分泌肿瘤复发与肿瘤个数相关 (P<0.05)。多因素COX回归显示肿瘤个数[多发 vs 单发,HR(95% CI):5.468(1.892-15.808),P=0.002]是影响Ⅰ型胃神经内分泌肿瘤复发的独立因素。结论 直径较小、局限于黏膜层和黏膜下层、无淋巴结转移和远处转移的Ⅰ型胃神经内分泌肿瘤,EMR-C治疗较ESD治疗更具优势;肿瘤个数是Ⅰ型胃神经内分泌肿瘤复发的独立影响因素。
神经内分泌肿瘤(neuroendocrine neoplasms, NENs)是起源于神经内分泌细胞的罕见肿瘤,其中以消化道神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasm, GEP-NEN)最常见,约占所有神经内分泌肿瘤的2/3[1-2]。胃神经内分泌肿瘤(gastric neuroendocrine neoplasms, GNENs)约占消化道神经内分泌肿瘤的8.7%[3]。Ⅰ型胃神经内分泌肿瘤约占胃神经内分泌肿瘤的70%~80%[4]。内镜治疗是Ⅰ型胃神经内分泌肿瘤的主要治疗方式,内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)和改良的内镜下黏膜切除术(endoscopic mucosal resection, EMR)的肿瘤完全切除率为85%~100%,比内镜下黏膜切除术完全切除率高达10%[2, 5-7]。透明帽辅助的内镜下黏膜切除术(EMR-C)属于改良的内镜下黏膜切除术,通过将病变吸入透明帽内,从而进行病变黏膜切除,方法简便、高效[3]。目前缺乏ESD和EMR-C在治疗Ⅰ型胃神经内分泌肿瘤的疗效和费用对比,本文旨在对比两种不同手术方式的安全性、短期和长期疗效,并探究Ⅰ型胃神经内分泌肿瘤复发的影响因素。
1 资料和方法
1.1 研究对象
收集2006年11月至2022年5月南京市鼓楼医院收治和确诊为Ⅰ型胃神经内分泌肿瘤的病例。纳入标准:①经我院术后病理为Ⅰ型胃神经内分泌肿瘤的患者;②有完整临床检查和病例资料。最终纳入77例Ⅰ型胃神经内分泌肿瘤患者,所有患者及家属均知情同意。
1.2 手术方法
(1)EMR-C:病变周围黏膜下注射肾上腺素+美蓝+生理盐水注射液,将病灶基底部抬起,在内镜前端安装透明帽,将圈套器嵌入透明帽的内槽中,用负压将病灶吸入透明帽内,收紧圈套钢丝,通以高频电流,切下病变后经电凝或钛夹止血。见图1。

图1 胃神经内分泌肿瘤EMR-C治疗操作过程 A:胃体后壁可见一隆起性病变,大小约1.0 cm×1.2 cm; B:将病变吸引至透明帽中,松开圈套器推至病变基底部收紧,通以高频电流切除病变; C:用钛夹夹闭创面
(2)ESD:Q26OJ内镜前端安装透明帽,先用DUAL刀在距肿瘤边界3~5 mm标记病变范围,用注射针沿标记点外侧注入生理盐水+美蓝+肾上腺素混合液,使黏膜抬举良好,使用DUAL刀沿标记点外侧作一环周切口,然后逐步剥离黏膜下层,直至完整剥离病变,热止血钳处理创面小血管,必要时钛夹夹闭止血。见图2。
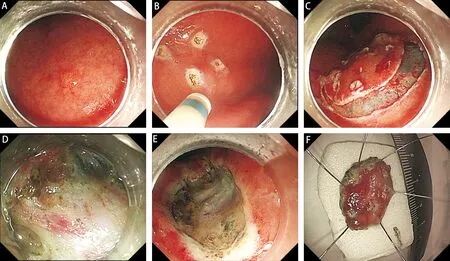
图2 胃神经内分泌肿瘤ESD治疗操作过程 A:胃体小弯侧发现一黏膜下隆起,大小约0.3 cm×0.4 cm; B:用DUAL刀在距肿瘤边界3~5 mm标记病变范围; C:用DUAL刀沿标记点外侧作一环周切口; D:用DUAL刀逐步剥离黏膜下层; E:剥离后创面; F:切除后标本
1.3 随访
通过门诊或电话随访患者的生存、复发等情况。随访起点为GNENs患者手术治疗结束的时间,末次随访时间为 2022年5月。无复发生存期(recurrence free survival,RFS),其定义为经过治疗后,获得完全缓解到出现复发或者随访截止的时间。
1.4 数据处理

2 结果
2.1 临床病理特征
77例Ⅰ型胃神经内分泌肿瘤患者的平均年龄(52.2±10.8)岁,其中男性27例,女性50例。按照WHO 2019分级与分类标准,G1有67例,占87.0%,而G2仅有10例,占13.0%。肿瘤中位直径0.5 cm(IQR 0.3~0.9 cm)。63例肿瘤多位于胃体(81.8%)。66.2%肿瘤常表现为多发。仅有14例患者存在肿瘤黏膜表面凹陷,占18.2%。肿瘤浸润深度通常局限于黏膜层和黏膜下层,累及黏膜层有48例(62.3%),累及黏膜下层有29例(37.7%)。77例患者中有14例(18.2%)行EMR-C治疗,63例(81.8%)行ESD治疗。
2.2 不同内镜切除方式患者基线资料对比
77例Ⅰ型胃神经内分泌肿瘤患者按内镜切除方式不同分为EMR-C组(14例),ESD组(63例),两组基线资料比较无统计学差异,见表1。

表1 不同内镜切除方式患者基线资料对比 [n(%)]
2.3 不同手术方式治疗疗效比较
EMR-C组中位切除时间为6.0 min(IQR 3.0~8.8 min),而ESD组中位切除时间为40.0 min(IQR 25.0~71.0 min),组间差异有统计学意义(P<0.01)。EMR-C组完整切除率为85.7%,ESD组完整切除率为84.1%。EMR-C组有1例出现术后出血;ESD组有1例患者出现术后穿孔,7例患者出现术后发热。EMR-C组住院中位时间为5.5 d(IQR 4.3~7.8 d),ESD组住院中位时间为5.0 d(IQR 5.0~7.0 d)。EMR-C组住院总费用中位值为10 177.3元(IQR 8 002.1~11 359.4元),ESD组住院总费用中位值为18 048.1元(IQR 15 574.0~21 035.8元),其差异有明显统计学意义(P<0.001)。EMR-C组患者有1例因呼吸衰竭发生死亡;ESD组患者有2例发生死亡,1例死于原发病肝脏转移,1例死于急性脑梗。见表2。EMR-C与ESD在肿瘤复发方面未见明显差异(图3A,P>0.05)。
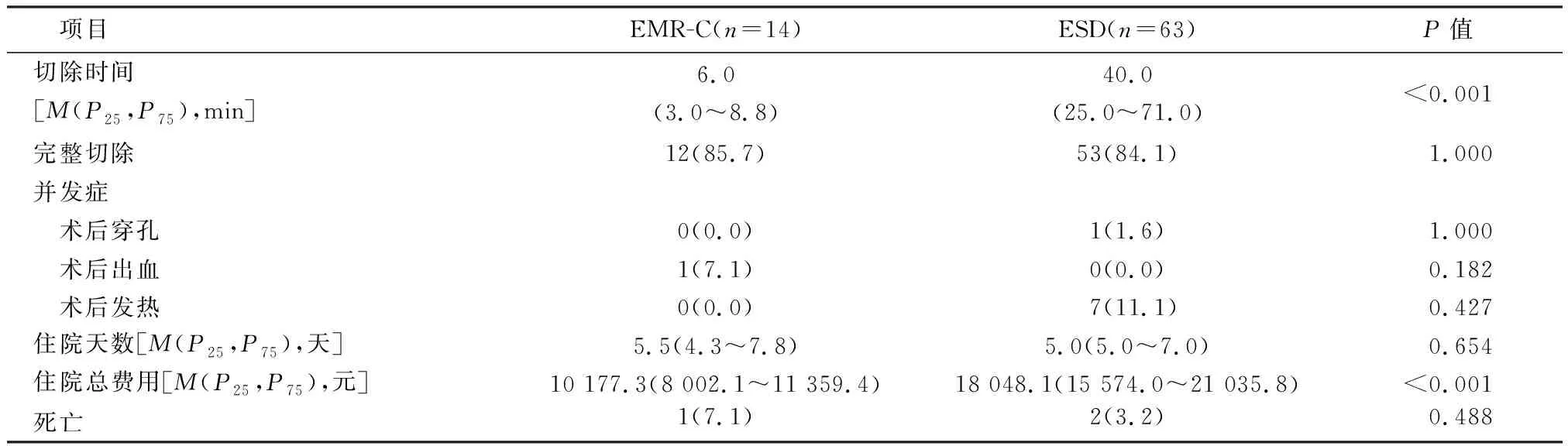
表2 不同内镜切除方式Ⅰ型胃神经内分泌肿瘤患者的短期及长期疗效对比 [n(%)]
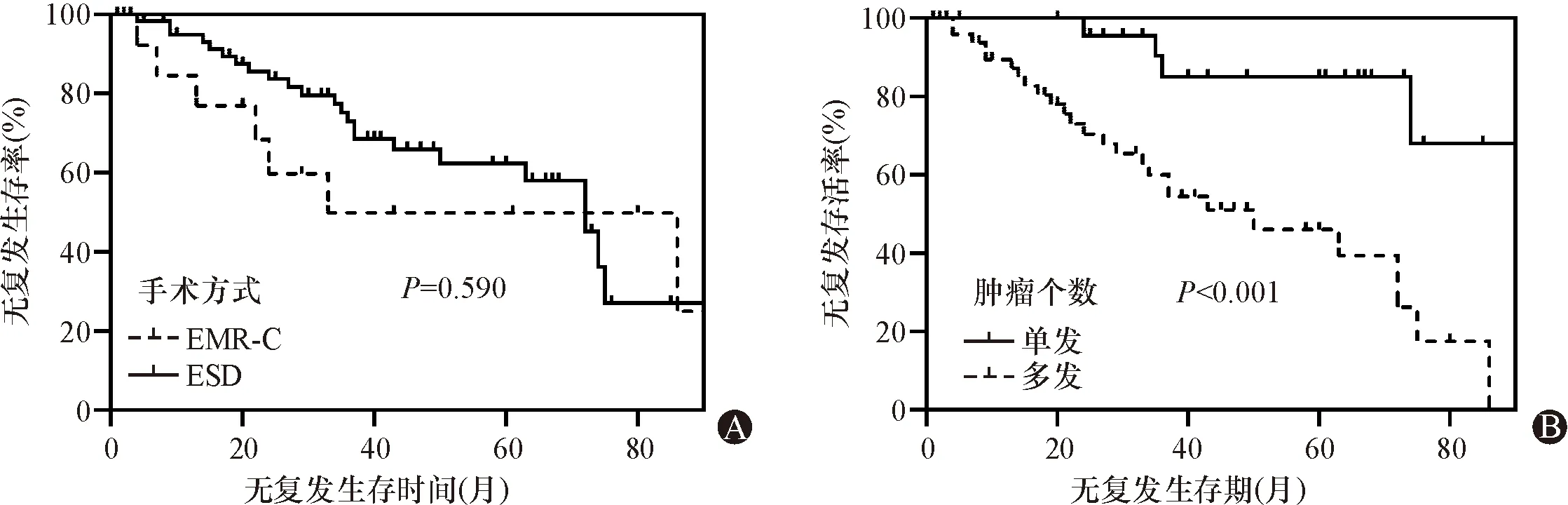
图3 胃神经分泌肿瘤生存曲线图 A:手术方式与患者RFS相关的生存曲线图;B:肿瘤个数与患者RFS相关的生存曲线图
2.4 影响Ⅰ型胃神经内分泌肿瘤复发危险因素分析
单因素COX分析显示Ⅰ型胃神经内分泌肿瘤复发与肿瘤个数相关 (P<0.05,表3),而年龄、性别、病理分级、肿瘤直径、肿瘤部位、多部位累及、浸润深度、切缘、肿瘤黏膜有无凹陷、手术方式对肿瘤复发无影响(P>0.05,表3)。将P<0.1的指标纳入多因素COX回归显示肿瘤个数[多发vs单发,HR(95%CI):5.468(1.892~15.808),P=0.002]是影响Ⅰ型胃神经内分泌肿瘤复发的独立因素。多发较单发更易复发,差异有明显的统计学意义(图3B,P<0.01)。
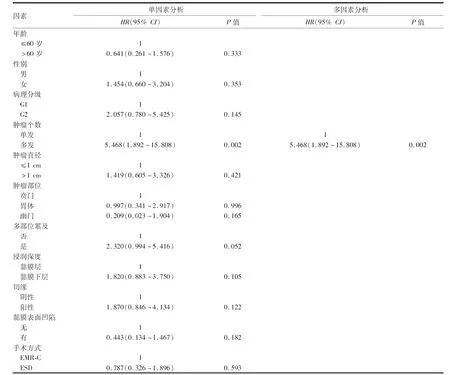
表3 影响77例Ⅰ型胃神经内分泌肿瘤患者RFS的Cox单因素和多因素分析
3 讨论
神经内分泌肿瘤(NENs)是一类起源于神经内分泌细胞的罕见的、生长缓慢肿瘤。国内外报道可能是由于内窥镜的普及、质子泵抑制剂的广泛使用、生活方式的改变、临床医生对该病认知的提高等因素,近年来该病的发生率明显升高[8-9]。胃肠道是神经内分泌肿瘤最常发生的部位,约占全部神经内分泌肿瘤的55%~70%[10]。胃是消化道神经内分泌肿瘤好发部位之一,胃神经内分泌肿瘤约占所有消化道神经内分泌肿瘤的5.6%~23%,但不到所有胃肿瘤的1%[11-12]。本研究发现我们治疗的77例I型胃神经内分泌肿瘤年龄较轻,平均年龄为52.2岁,女性多见,87.0%胃G1,81.8%位于胃体,66.2%肿瘤为多发。
根据欧洲神经内分泌肿瘤学会(ENETs)2016版指南、WHO第5版指南将分化良好的胃神经内分泌肿瘤分为Ⅰ型、Ⅱ型和Ⅲ型。Ⅰ型胃神经内分泌肿瘤最为常见,占所有胃神经内分泌肿瘤的70%~80%,主要是由萎缩性胃炎导致胃酸缺乏,进而引起高胃泌素血症[11, 13-19]。胃神经内分泌肿瘤根据其分型、病理分级、肿瘤大小、浸润深度、肿瘤个数、是否脉管浸润而选择不同的治疗方案,尽管多个共识及研究均建议对于<1 cm、且浸润深度局限于黏膜层及黏膜下层的Ⅰ型胃神经内分泌肿瘤推荐随访观察[20-21];而2020年胃肠胰神经内分泌肿瘤诊治专家共识建议对于病灶最大径≤1 cm、无淋巴结和远处转移、局限于黏膜层和黏膜下层的Ⅰ型胃神经内分泌肿瘤推荐内镜治疗;可见随着近年来内镜治疗技术的进步,内镜治疗变的更加积极,息肉切除术、EMR、改良后的EMR、ESD应用得越发普及[4, 11, 22-23]。
内镜治疗I型胃神经内分泌肿瘤具有一定优势。ESD/EMR较外科手术具有创伤小、术后恢复快、保留了消化道正常解剖和生理功能等优势。EMR多应用于肿瘤直径较小的消化道病变,而随着肿瘤直径的增大,ESD较EMR更能提高肿瘤完整切除率、降低切缘阳性率[23-26]。有文献报道,相比于传统的EMR,改良的EMR更能降低局部残留风险[27-28]。内镜下透明帽辅助黏膜切除术(EMR-C)就属于EMR的改良技术,贺德志等研究发现在治疗较小胃神经内分泌肿瘤方面,EMR-C较ESD手术时间更短,平均住院费用更少,并发症总发生率相近[3]。在本研究中,EMR-C在治疗Ⅰ型胃神经内分泌肿瘤方面,在手术切除时间、住院总费用方面较ESD仍然存在着明显的优势,ESD平均时间40 min,而EMR-C仅有6 min,平均节省34 min。而在住院费用方面,EMR-C更具有优势,其费用仅为ESD费用的56.4%。而两种手术方式在短期治疗效果方面表现一致,完整切除率相当。术后并发症出血、穿孔和发热等发生率均较低,两组没有显著差异。在长期疗效方面,两组治疗患者在中位随访49月,两组1年和3年复发率没有差异。两组3年无复发生存率也没有显著差异。因此,两种方法在治疗I型胃神经内分泌肿瘤方面短期和长期疗效都不错,但是,EMR-C在缩短治疗时间和降低治疗费用方面更具有优势。
胃I型神经内分泌肿瘤治疗后容易复发,本研究也重点探讨了Ⅰ型胃神经内分泌肿瘤复发的影响因素。既往研究报道内镜治疗后GNENs复发率差异很大,波动于26%~52%[29-30]。本研究中EMR-C术后复发率57.1%,ESD术后复发率为36.5%,两者之间未见统计学差异,且单因素和多因素COX回归分析显示手术方式并非Ⅰ型胃神经内分泌肿瘤复发的独立影响因素。而单因素及多因素分析显示多发是Ⅰ型胃神经内分泌肿瘤复发的独立影响因素,在贺德至等人的研究中也提及复发病例均为多发病灶[3]。Kosmas等人研究了Ⅰ型胃神经内分泌肿瘤的复发和转移潜能,表明S-胃泌素水平、内外科手术方式可预测Ⅰ型胃神经内分泌肿瘤患者的复发,该研究未纳入肿瘤个数这一指标;本研究中Ⅰ型患者均行内镜治疗,缺乏内外科对比数据,且由于时间跨度较大,缺失S-胃泌素资料,这些仍需我们进一步完善。但对于多发、复发的患者,我们仍然建议临床医生应多加关注,可推荐使用生长抑素类似物抑制肿瘤细胞增殖,防止复发。
本研究有一些局限性,首先在本研究中,肿瘤平均直径较小,对于较大的Ⅰ型胃神经内分泌肿瘤例数较少,仍需加大样本大验证EMR-C对于直径较大的Ⅰ型胃神经内分泌肿瘤的适用性。其次,本研究纳入患者例数仍偏少,尤其EMR-C数量偏少,但是,本研究两组基线资料没有差异,可以减少偏移,未来需要扩大样本数量进一步验证。最后,本研究为回顾性研究,未来也需要涉及前瞻性研究更好验证。
综上,对于直径较小、局限于黏膜层和黏膜下层、无淋巴结和远处转移的Ⅰ型胃神经内分泌肿瘤,ESD和EMR-C均安全有效,但相比较于ESD,EMR-C手术时间更短,住院花费更少。对于直径较大的Ⅰ型胃神经内分泌肿瘤,需要收据更多的数据来分析验证EMR-C/ESD的安全有效性。多发是Ⅰ型胃神经内分泌肿瘤复发的独立影响因素,多发的Ⅰ型胃神经内分泌肿瘤更易复发,除了使用ESD/EMR-C治疗,可推荐使用生长抑素类似物预防肿瘤复发。未来,针对Ⅰ型胃神经内分泌肿瘤我们需要涉及多中心前瞻性研究进一步验证两种方法治疗的短期和长期效果。
