离子色谱-积分脉冲安培法检测黄酒中的阿拉伯糖、半乳糖、甘露糖、葡萄糖、核糖、乳糖
2022-02-11姚哲渊车金水叶明立陈梅兰
徐 诺,姚哲渊,车金水,叶明立,陈梅兰,
(1.浙江树人大学生物与环境工程学院,浙江杭州 310015;2.赛默飞世尔科技(中国)有限公司,上海 201203)
黄酒以其独特的滋味、丰富的营养和保健养生功能而著称于世[1],其中,糖类是形成其独特滋味及保健功能的重要成分之一[2]。黄酒中的糖类主要是由葡萄糖、一定量的阿拉伯糖、半乳糖、甘露糖等单糖及麦芽糖、潘糖等低聚糖组成。其中,葡萄糖可以促进肌层与肠粘膜粘连[3],起到固定作用,改善便秘[4]。阿拉伯糖不仅可以促进肠道蠕动[5],还可以控制血糖和脂肪的累积,缓解糖尿病、肥胖等一系列疾病[6]。甘露糖具有抑制肿瘤细胞生长[7]、预防饮食引起的肥胖[8]等多种功效,还能用作抗肿瘤药[9],是甘露糖醇[10]、维生素[11]的合成前体。核糖能促进局部缺血、缺氧组织的功能恢复[9],还能有效缓解肌肉无力、疲劳、疼痛等症状[12]。乳糖具有类似膳食纤维的作用,有利于双歧杆菌和乳杆菌的生长,还能增强免疫力[13]。
由此可见,黄酒特别是其所含的糖类物质可以对人体健康起到重要作用,因此,对黄酒中糖分的检测具有现实意义。目前,黄酒研究主要集中于低聚糖含量检测[14-15],而对阿拉伯糖、半乳糖、甘露糖等这些单糖含量的检测研究鲜有报道,因此本研究对不同类型黄酒中糖分含量进行检测具有十分重要的意义。
目前,检测食品中含糖量的方法有高效液相色谱-蒸发光散射法[16]、液相色谱-示差折光检测法[17]、液相色谱-质谱法[18]等。其中,高效液相色谱-蒸发光散射法中检测器对标准曲线的线性不确定度的贡献较大,关系曲线比较复杂;分离效果不佳,灵敏度低;液相色谱-示差折光检测法易受温度、流速变化的影响,造成不稳定;液相色谱-质谱法样品前处理步骤复杂,耗时较长。由于糖类化合物具有弱酸性、亲水性[19],没有吸光基团,以阴离子形态存在于较强的碱性溶液中,因而使用气相色谱和高效液相色谱法分析糖类物质均有不足之处。离子色谱-积分脉冲安培法具有不用衍生、操作方便、灵敏度高和实验不使用有毒化学试剂的优点,同时糖类物质的还原性也为安培检测提供了可能。因此,本实验基于胡贝贞等[15]的方法,对色谱条件进行优化,建立离子色谱-积分脉冲安培法同时检测黄酒中的阿拉伯糖、半乳糖、甘露糖、葡萄糖、核糖、乳糖,在20 min内实现6种糖的分离,并利用建立的方法对市售26个黄酒样品中的单糖进行测定,基于所得的检测结果,初步探讨黄酒中单糖含量以及来源,为黄酒中糖类物质的研究提供一定的参考价值。
1 材料与方法
1.1 材料与仪器
黄酒样品 购于当地超市;D-阿拉伯糖(纯度98%)、D-甘露糖(纯度99%)、D-核糖(纯度99%)、β-乳糖(纯度70%) 购于上海麦克林生化科技有限公司;D-半乳糖(纯度98%) 购于上海恒信化学试剂有限公司;D-葡萄糖(纯度99.5%) 购于广州市金华大化学试剂有限公司;氢氧化钠(纯度96%) 购于杭州化学试剂有限公司;无水乙酸钠(纯度99%)购于温州润华化工实业公司;Xiboshi SPE C18:300 mg 北京赛诺思科技仪器有限公司;实验室用水为超纯水(电阻率18.20 MΩ·cm)。
ICS-5000 型离子色谱仪(配备 ED5000电化学检测器、Au 工作电极、PH-Ag/AgCl 复合参比电极、Chromeleon6.8 色谱工作站) 美国Thermo Fisher Scientific公司;CarboPacTMPA 10分析柱(4 mm×250 mm) 戴安(中国)有限公司;超纯水机(TKAGenpure) 美国Thermo Fisher Scientific公司。
1.2 实验方法
1.2.1 标准溶液的配制 分别称取各种糖100 mg,用超纯水溶解并定容至100 mL容量瓶中,配成质量浓度为1000 μg/mL的标准储备液,于4 ℃冷藏保存。使用前,取等量同浓度级别的标准溶液混合后作为混合标准工作溶液。
1.2.2 样品前处理 取C18固相萃取柱,依次用10 mL甲醇、15 mL超纯水活化,静置20 min,备用。进样前,样品用去离子水按需要稀释150倍,然后取2 mL溶液经过已活化好的C18柱和0.2 μm尼龙滤膜,弃去初滤液2 mL,再加2 mL溶液至已活化好的C18柱和0.2 μm尼龙滤膜,收集流出液,进色谱分析。
1.2.3 色谱条件 由于黄酒样品中存在多种保留性不同的糖类,因此采用梯度淋洗的方式进行淋洗。阿拉伯糖、半乳糖、葡萄糖、甘露糖等保留性较弱且出峰时间相似,因此实验刚开始采用较低的浓度进行洗脱。由于黄酒中含有多种糖类,对于在柱上保留较强的糖的洗脱,除了用氢氧化钠淋洗之外,还加入了乙酸钠淋洗。最终确定的梯度淋洗程序如表1所示。
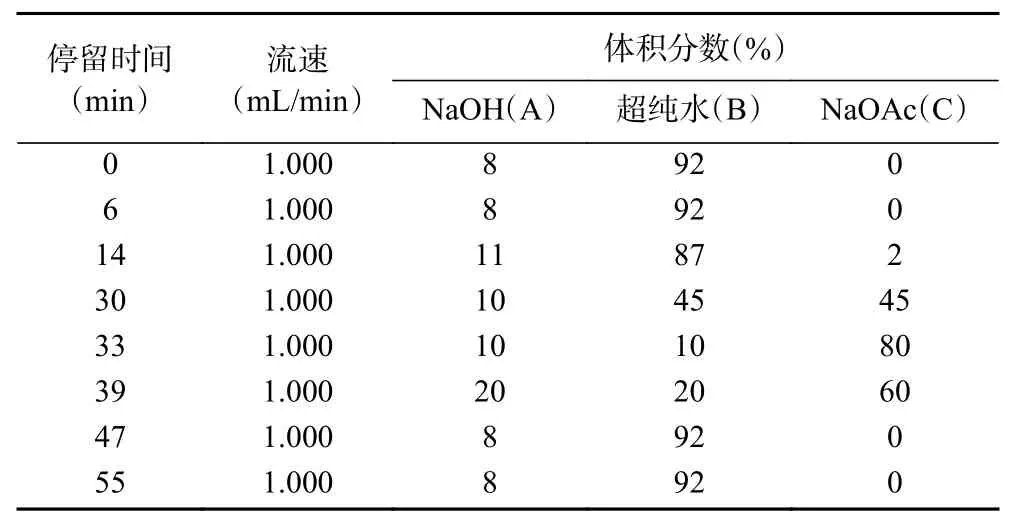
表1 梯度洗脱程序Table 1 Gragient eluting procedure
色谱柱:CarboPacTMPA 10分析柱(4 mm×250 mm);柱温:30 ℃;进样量:25 mL。以250 mmol/L NaOH(A)、超纯水(B)和200 mmol/L NaOAc(C)为淋洗液进行洗脱,梯度洗脱条件见表1。
1.2.4 定性定量方法 利用保留时间等保留至定性分析,即在1.2.3色谱条件下,用标准溶液与黄酒酒样中色谱峰对照定性分析;或将标准溶液加入黄酒酒样中导致某色谱峰增高定性。利用外标法定量分析,即在1.2.3色谱条件下,按标准溶液色谱图,可求出每个单糖浓度与相应峰面积或峰高校准曲线,根据校准曲线求出黄酒酒样色谱图相应单糖峰面积或峰高的浓度。
1.3 数据处理
色谱结果积分处理采用Thermo Chromenleon 6.8色谱工作站,并利用Excel软件进行数据统计及数据分析。
2 结果与分析
2.1 方法学考察
以糖类浓度为横坐标, 色谱峰面积为纵坐标, 绘制标准曲线, 6种糖类标准溶液色谱图如图1所示。

图1 6种糖类标准溶液的色谱图(浓度为1 ppm)Fig.1 Chromatograms of 6 saccharides standard solution(The concentration of 1 ppm)
2.1.1 标准曲线、检出限、定量限及重现性 分别采用超纯水配制6种糖类混合标准溶液,其中核糖浓度为0.005、0.05、0.5、1、5 μg/mL;半乳糖和甘露糖混合标准溶液的系列浓度为0.01、0.1、1、5、10 μg/mL;阿拉伯糖和乳糖混合标准溶液的系列浓度为0.1、0.5、1、5、10 μg/mL;葡萄糖浓度为1、10、50、100、150 μg/mL。按照1.2.3的色谱条件进样,并进行线性关系、精密度、检出限和定量限的考察。
配制阿拉伯糖浓度为0.1 μg/mL,半乳糖浓度为0.01 μg/mL,葡萄糖浓度为1 μg/mL,甘露糖浓度为0.01 μg/mL,核糖浓度为0.005 μg/mL,乳糖浓度为0.1 μg/mL的混合标准溶液重复进样7次测定峰面积,计算RSD,并以3倍基线噪声(S/N=3)计算得到检出限,以10倍基线噪声(S/N=10)计算得到定量限,标准品的线性关系、精密度,结果如表2。
从表中的测定结果可以看出,该方法的线性关系 良 好(R2≥0.9990),检 出 限(2.99×10-3~1.38×10-2μg/mL),定量限(9.96×10-3~4.60×10-2μg/mL),相对标准偏差(RSD)≤3.70%,表明了该方法灵敏度高,精密度高。
2.1.2 方法回收率 取已知浓度的黄酒酒样为标准,加入定量的混合标准品溶液,按方法要求操作并测定,计算6种单糖的回收率,结果如表3所示。从测定的结果可以得到该方法的平均加标回收率在91.6%~109.1%之间,表明方法具有良好的准确度。将每份加标样品分别进样7次,通过峰面积计算精密度为1.02%~3.70%,表明该方法的重现性好,结果见表2。
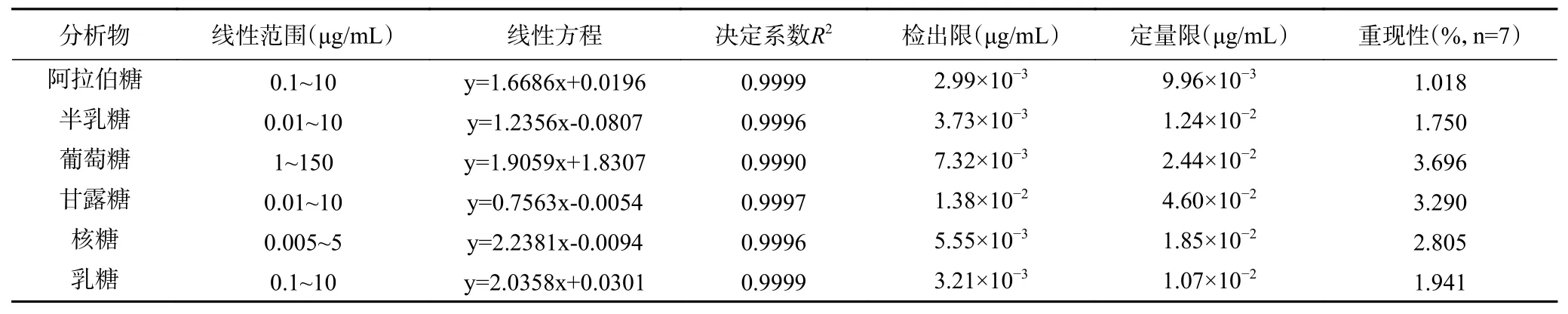
表2 回归方程、决定系数、线性范围、检出限、定量限和重现性Table 2 Regression equations, determination coefficient, linear ranges, limits of detection, quantification limits and reproducibility

表3 黄酒样品的加标回收率Table 3 Spike recovery of yellow rice wine samples
2.2 市售黄酒酒样检测与分析
用所建立的方法分析黄酒中6种糖类的含量,检测结果见表4,典型样品图见图2。由表4可知,6种糖类含量均有差异。其中葡萄糖为黄酒中的主要糖类,在26个黄酒中均检出,含量在14.31~60.42 g/L之间。核糖在20个黄酒中被检出,但3年陈酿古越龙山、8年吴越稽山和5年陈黄酒中未检出。而乳糖仅在东风精雕酒、10年咸亨雕王以及吴越稽山中检出。除葡萄糖外其余糖类在桃酿、玫瑰米酒、桃子米酒中未检出。阿拉伯糖、半乳糖、甘露糖、核糖和乳糖在黄酒中含量较低。

图2 3年手工冬酿黄酒样品的色谱图Fig.2 Chromatogram of 3 years‘ hand-brewed rice wine samples in winter

表4 黄酒样品中6种糖类的浓度(g/L)Table 4 The concentration of 6 saccharides in yellow rice wine samples(g/L)
2.3 不同类型酒样中单糖的比较分析
如表4所示,在黄酒中,葡萄糖的含量远远高于其他单糖,这是因为所用生产黄酒用的原料以淀粉为主,淀粉水解成葡萄糖被发酵利用,未被利用的葡萄糖就留在酒中。在此发酵过程中,糖类在其它微生物的作用下发生了相互转化生成其他糖类,如阿拉伯糖、半乳糖、甘露糖和核糖[20]。
桃酿、玫瑰米酒和桃子米酒这3种半甜型黄酒总含糖量相对高于加饭酒,但除葡萄糖外,其它几种糖全部未检出,见图3。可能的原因是半甜型黄酒以成品黄酒代替水,加入到发酵醪中,使糖化发酵的开始之际,发酵醪中的酒精浓度就达到较高的水平,在一定程度上抑制了酵母菌的生长速度,由于酵母菌数量较少,对发酵醪中产生的糖分不能转化成酒精,故成品酒中的糖分较高[21],但也抑制了其他微生物的反应,使得半甜黄酒中全未检测出其它糖。而加饭酒在淀粉糖化和酒精发酵的双边条件下酿造[22],可能是成熟的传统生产工艺保证了酿酒酵母对糖化产物的发酵,使加饭酒中的发酵过程更为充分,糖类之间发生相互转化,因此,在加饭酒中几乎全部检测出6种待测糖类。但进一步分析发现,6种糖类与黄酒的酒龄及品牌关系不明显。
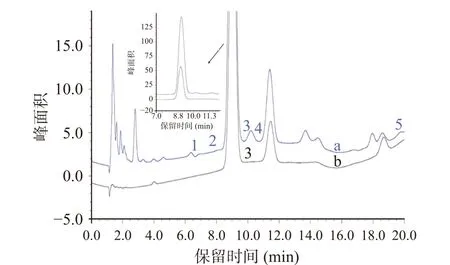
图3 加饭酒与半甜型黄酒的色谱比较图Fig.3 Chromatographic comparison of rice wine and semisweet rice wine
根据GB/T 13662-2018黄酒规定,黄酒是以稻米、黍米、玉米、小麦、水等为主要原材料,经加曲和/或部分酶制剂、酵母等糖化发酵剂后经过复杂的生物化学过程酿制而成的发酵酒[23]。据文献[24]报道,采用不同的工艺、不同的原料组合,糖化发酵剂用料选择的不同,最终产出的黄酒所含的糖类成分及含量也不同。因此,黄酒糖类物质的成分及含量组成可能与其所用原料及酿造工艺等有关,具体尚需进一步动态跟踪研究。
3 结论
本研究中建立的离子色谱-积分脉冲安培法同时检测黄酒中的阿拉伯糖、半乳糖、甘露糖、葡萄糖、核糖、乳糖的方法简便、快捷、灵敏度高、准确性好、精密度高;其次,黄酒中主要存在的单糖是葡萄糖,阿拉伯糖、半乳糖、甘露糖、核糖和乳糖的含量较低;半甜型黄酒中葡萄糖的含量高于加饭酒,其含量的差异可能与酿造工艺有关。
对比白酒中的葡萄糖含量2.01~3.33 mg/L[25],啤酒样品中葡萄糖浓度在0.0942~0.4197 mg/L[26],葡萄酒样品中葡萄糖浓度在13.45~85371.13 mg/L[27]及本研究黄酒中葡萄糖含量14310.1~60420.6 mg/L数据可知,黄酒中糖类物质含量远高于白酒和啤酒,与低含糖量的葡萄酒接近。摄入过量的糖分不仅会导致肥胖问题,还易增加罹患糖尿病、高血压等慢性疾病的风险[28],因此,应适量饮用黄酒。
