春季亚低温胁迫对油茶‘华硕’叶片光合生理特性的影响
2022-02-11高璐鑫陈雨晴孙永江张凌云
高璐鑫 王 琪 陈雨晴 孙永江 张凌云
(北京林业大学林学院,森林培育与保护教育部重点实验室,北京 100083)
油茶(Camellia oleifera)是我国特有的木本食用油料树种,茶油中不饱和脂肪酸的含量超过90%,具有极高的营养价值及保健价值[1]。我国油茶主要分布在亚热带地区,属于冷敏感植物,然而受全球气候异常的影响,油茶主要种植区的北缘常会受到低温的侵袭。春季温度迅速回升,促使油茶进入生长季(春梢萌动期),如果此时遇到突发性倒春寒(白天7~10 ℃,夜间3~5 ℃)天气,将会导致油茶发生不同程度的亚低温伤害,尤其是春梢抽长对于积温的要求较高,达不到会直接影响当年的花芽分化以及嫁接扦插材料的质量,进而对当地油茶产业发展造成影响[2-3]。
植物光合作用作为地球上最基本的能量转化过程,对环境条件非常敏感,往往可以用来反映植物对不利环境因子的适应能力[4]。油茶具有“花果同期”现象,维持逆境胁迫下光合作用活性,对油茶生长发育具有重要意义。叶片光合机构是低温胁迫的首要伤害位点,低温胁迫会破坏类囊体膜的完整性,抑制光合电子传递活性。植物光合电子传递链由光系统I(PS Ⅰ)和光系统II(PS Ⅱ)等组成,与PS Ⅱ相比,PS Ⅰ对低温胁迫更加敏感,低温胁迫下电子由于无法正常传递至氧化型辅酶II(NADP+),会更多的泄露给氧气生成活性氧(ROS)[5],大量的ROS 一方面抑制D1蛋白的修复导致PS Ⅱ光抑制[6];另一方面会破坏PS Ⅰ[7],而一旦PS Ⅰ发生光抑制后,由于恢复较慢,往往导致PS Ⅰ光抑制成为低温胁迫下植物生长的主要限制因素,对植物的影响会更大[8]。低温引起光合速率降低的原因,除了加剧光系统活性的伤害之外,还会通过抑制碳固定过程所需的酶活性,加剧光抑制程度[7]。近期,吴玲利等[9]发现低温胁迫(6 ℃)影响了油茶‘华硕’和‘华鑫’开花结实及叶片光合活性。虽然目前对低温胁迫下植物叶片光能的吸收、传递和利用效率等已有相关研究,但亚低温胁迫下油茶光叶片抑制机制仍未知。
叶片叶绿素荧光分析技术具有便捷、迅速和非破坏性等优点,可了解叶片光合作用过程中能量的捕获、传递、分配等方面的情况,具有反应“内在性”的特点[10]。本研究以2 年生优质大果油茶品种‘华硕’盆栽苗为试材,通过测定亚低温10 ℃/5 ℃(昼/夜)胁迫过程中油茶叶片快速叶绿素荧光诱导曲线和830 nm 光吸收曲线,结合叶片光合同化物含量的测定,分析油茶叶片叶绿素含量、光系统光化学活性、同化物积累量的变化,探究亚低温胁迫下油茶叶片的光合适应机制,以期为油茶抗寒栽培管理技术提供理论依据。
1 材料与方法
1.1 材料
试验试材为2 年生油茶‘华硕’嫁接苗,2019年4 月种植于北京林业大学八家苗圃温室(北纬40°00′48.59″,东经116°20′43.08″),温室日均光量子通量密度(PFD)值约500 μmol/(m·s),昼/夜温度均值约为28 ℃/20 ℃,塑料盆规格为内径 30 cm,高40 cm,每盆土和基质的体积比例为1∶1,用硫磺粉调节pH 值为5.0~5.5。
1.2 试验设置
于2019 年7 月选取生长一致的油茶,在光照培养箱中培养2 d、进行均一化处理后,开始进行亚低温胁迫11 d(PFD 400 μmol/(m·s),昼/夜温度10 ℃/5 ℃)。以在较适宜光温条件(人工气候室内调节PFD 400 μmol/(m·s),昼/夜温度28 ℃/20 ℃)下生长的植株作为对照(CK)。胁迫后间隔1~2 d 进行叶绿素荧光参数的测定,于18:00—20:00 取每株油茶春梢中上部从上往下数第4 片完整健康、颜色基本一致的功能叶,保持叶片自然生长角度。在第2、6、11 天取相同部位的叶,清洗干净并吸干水分,存入超低温冰箱,进行各项生理指标测定。在亚低温第11 天时,取功能叶,进行叶肉细胞超微结构观察,重复3 次。
1.3 指标测定方法
1.3.1 叶绿素荧光参数测定
采用Dual-PAM100 荧光仪(Walz,德国)进行饱和脉冲分析,叶片测定前对叶片进行30 min的暗适应,测定PS Ⅰ反应中心色素(P700)中最大光氧化量子产量(Pm)[11]。用Handy PEA 连续激发式荧光仪(Hansatech,英国)测定叶片1s 内的(JIP 时间)叶绿素荧光诱导动力学曲线(O-J-I-P 曲线)[12],从O-J-I-P曲线上可直接获得如下参数,FO∶O 点为最小荧光;Fk∶k 点的荧光;Fj∶j 点的荧光;Fi∶i 点(30 ms)的荧光;Fm∶最大荧光,P 点的荧光。按公式(1)~(9)计算PS Ⅱ最大光化学效(Fv/Fm)、k 点相对可变荧光(Vk)、J 点相对可变荧光(Vj)、O-JI-P 荧光诱导曲线的初始斜率(Mo)、单位面积有活性反应中心数目(RC/CSm)、捕获的激子将电子传递到QA以后的其他电子受体的概率(ψEo)、单位面积吸收的光能(ABS/CSm)、t时刻的相对可变荧光大小(Vt)、相对可变荧光差异(ΔVt)。

1.3.2 叶片生理指标的测定及超微结构的观察
丙二醛(MDA)含量采用硫代巴比妥酸显色法;叶绿素含量采用乙醇丙酮提取法,可溶性糖及淀粉含量采用苯酚法,相对电导率采用电导率仪法[13]。
分别选取对照和亚低温胁迫第11 天的叶片小叶脉切取大小2 mm×2 mm 小块,3.5% 戊二醛固定,0.1 mol/L 磷酸缓冲液(pH=7.4)漂洗3 次,1%锇酸室温固定5 h,梯度酒精脱水,Epon 812环氧树脂浸透包埋,Leica UC7(Leica,德国)超薄切片机切片,经醋酸双氧铀-柠檬酸铅双染色,HT7700 透射电子显微镜(HITACHI,日本)下观察,采集图像分析,每个样品取15 个视野观察统计。
1.4 数据处理
利用Microsoft Excel 2010 整理数据,SPSS 17.0 进行数据分析,SigmaPlot 10 进行图表绘制。所有数值均为8 次重复的平均值。
2 结果与分析
2.1 亚低温胁迫对油茶叶片叶绿素含量的影响
由表1 可知,与CK 相比,随着亚低温胁迫时间的延长,油茶叶片叶绿素含量呈降低趋势。其中叶绿素a 含量在处理2 d 后降低了10%,到6 d 和11 d 后含量降低显著(P<0.05),分别下降了23%和28%;类胡萝卜素在亚低温处理不同时期均发生显著降低(P<0.05),与CK 相比,分别降低了14%、33%和57%;叶绿素b 和总叶绿素含量变化趋势与叶绿素a 基本一致。

表1 亚低温胁迫对油茶叶片的叶绿素a、叶绿素b、叶黄素及叶绿素总量的影响Table 1 Effects of sub-chilling stress on the contents of chlorophyll a(Chla), chlorophyll b(Chlb), carotenoid(Car) and total chlorophyll [Chl (a+b)] in C. oleifera leaves
2.2 亚低温胁迫对油茶叶片O-J-I-P 曲线的影响
由图1 可知,亚低温胁迫处理不同时间后油茶叶片O-J-I-P 曲线发生明显变化。从O-J-I-P 原始曲线的变化可以观察到,亚低温胁迫下油茶叶片O-J-I-P 曲线的形状不同于CK,随着亚低温胁迫时间的延长,叶片的荧光曲线变化幅度增加,Fm值降低幅度增加(图1a),说明亚低温胁迫抑制了叶片单位面积吸收的光能;对原始O-J-I-P 荧光曲线进行标准化后得到相对可变荧光差异变化曲线(图1b),发现亚低温胁迫导致油茶叶片O-J-I-P 曲线K点(300 μs)与j 点(2 ms)的相对荧光强度(Vk和Vj)升高,表明油茶叶片PS Ⅱ电子传递链活性受到了影响。

图1 亚低温胁迫对油茶叶片荧光强度的影响Fig. 1 Effects of sub-chilling stress on the chlorophyll fluorescence transients in C. oleifera leaves
2.3 亚低温胁迫对油茶叶片光系统活性的影响
由图2 可知,与CK 相比,亚低温胁迫1 d 后叶片Fv/Fm及Pm均发生明显降低,分别降低7%和13%;处理5 d 后,二者均维持在稳定的水平,表明亚低温胁迫短期可引起油茶叶片发生较严重的光抑制,油茶叶片可能存在调控机制以应对长时间的亚低温胁迫。
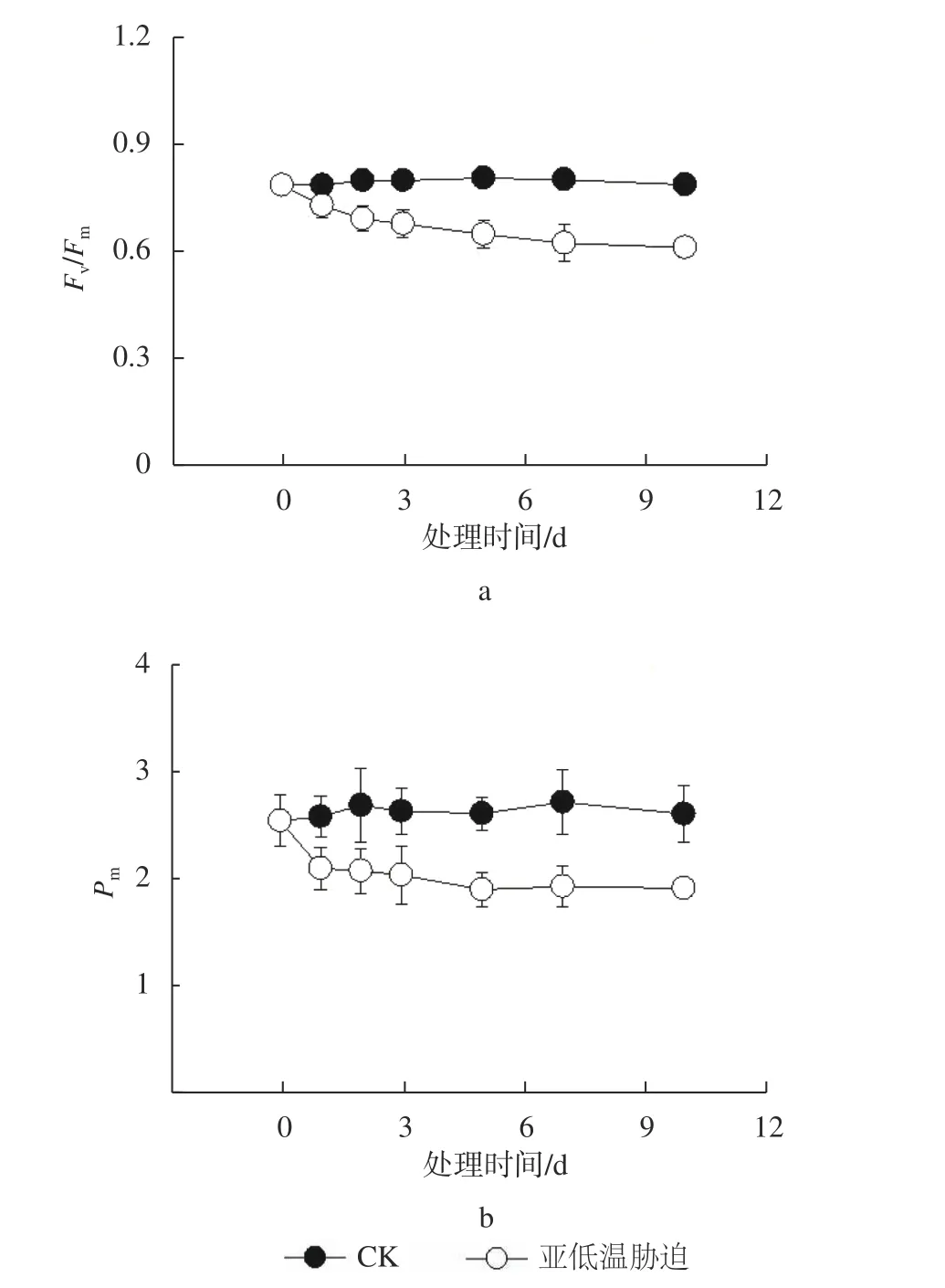
图2 亚低温胁迫对油茶叶片PS Ⅱ最大光化学效率Fv/Fm 及P700 最大氧化值Pm 活性的影响Fig. 2 Effect of sub-chilling stress on the maximum photochemical efficiency Fv/Fm(A) and P700 maximum oxidation value Pm(B) in C. oleifera leaves
随着亚低温胁迫时间的延长,至第5 天,Vk发生显著升高,维持在一定范围(图3a)。RC/CSm可以反映PS Ⅱ单位面积有活性的反应中心的比例,ψEo表示PS Ⅱ捕获的激子将电子传递到电子传递链中 QA-下游的其他电子受体的概率,PIabs表示植物叶片光合综合性能指数。由图3b、c、d可知,亚低温胁迫导致了RC/CSm、ψEo及PIabs的降低,而5 天后,各参数基本维持不变,表明一定时间的亚低温胁迫导致油茶叶片PS Ⅱ电子传递链受到抑制,从而进一步导致光合性能的降低。
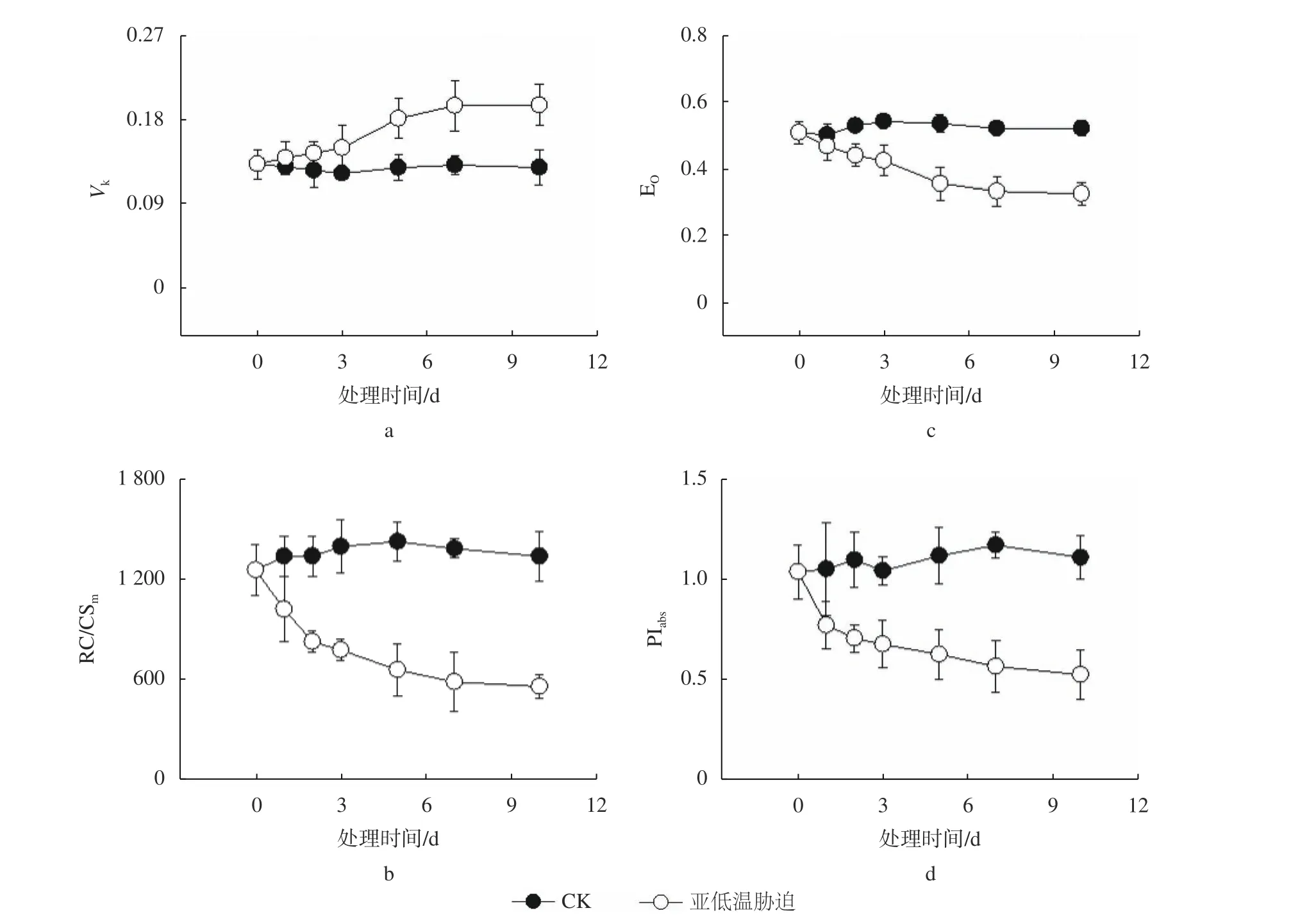
图3 亚低温胁迫对油茶叶片PS Ⅱ的Vk、RC/CSm、ΨEo 及PIabs 的影响Fig. 3 Effect of sub-chilling stress on PS Ⅱ donor-side Vk(A), active reaction center numbers RC/CSm(B), acceptor-side ΨEo(C), and photosynthetic performance parameters PIabs(D) in C. oleifera leaves
2.4 亚低温胁迫对油茶叶片细胞膜透性及碳同化产物积累的影响
由图4 可知,随着亚低温胁迫时间的延长,相对电导率及MDA 含量均呈现增加的趋势。处理前2 d,二者含量均与CK 无显著差异;处理6 d,相对电导率及MDA 含量分别增加了62%和40%,处理11 d 后二者含量进一步增加。研究结果表明,长时间的亚低温胁迫能够导致油茶叶片细胞膜发生较严重的损伤。
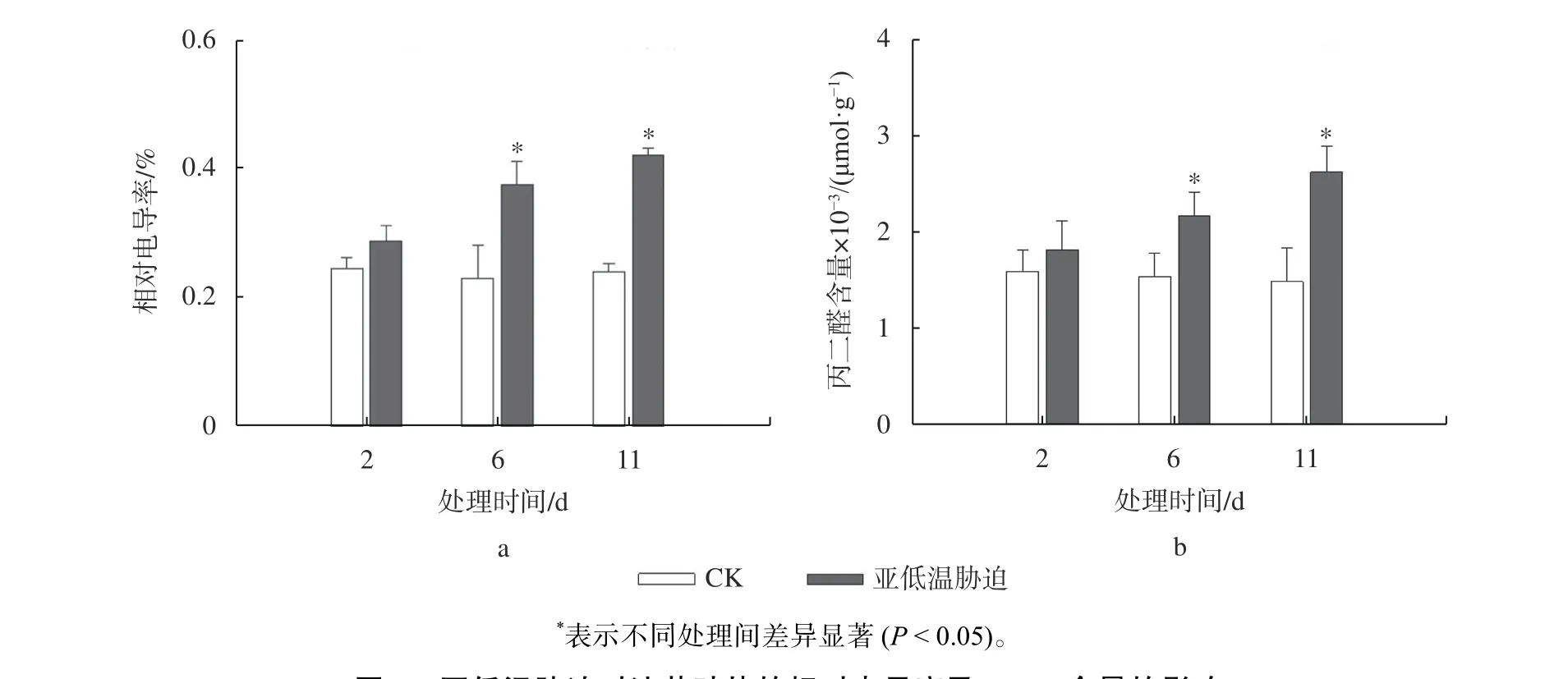
图4 亚低温胁迫对油茶叶片的相对电导率及MDA 含量的影响Fig. 4 Effect of sub-chilling stress on the relative electrical conductivity(A) and malondialdehyde content(B) in C. oleifera leaves
由图5a 可知,随着亚低温胁迫时间的延长,油茶叶片中可溶性糖含量呈现出增加的趋势。与CK 相比,处理2 d 和6 d 后的可溶性糖含量分别增加了14% 和34%,处理11 d 时可溶性糖含量稳步增长,与6 d 时的结果相比差异不显著。由图5b 可知,随着亚低温胁迫时间的延长,淀粉含量呈现持续下降的趋势,与CK 相比,处理2、6、11 d 后淀粉含量分别降低了5%、25%、46%。
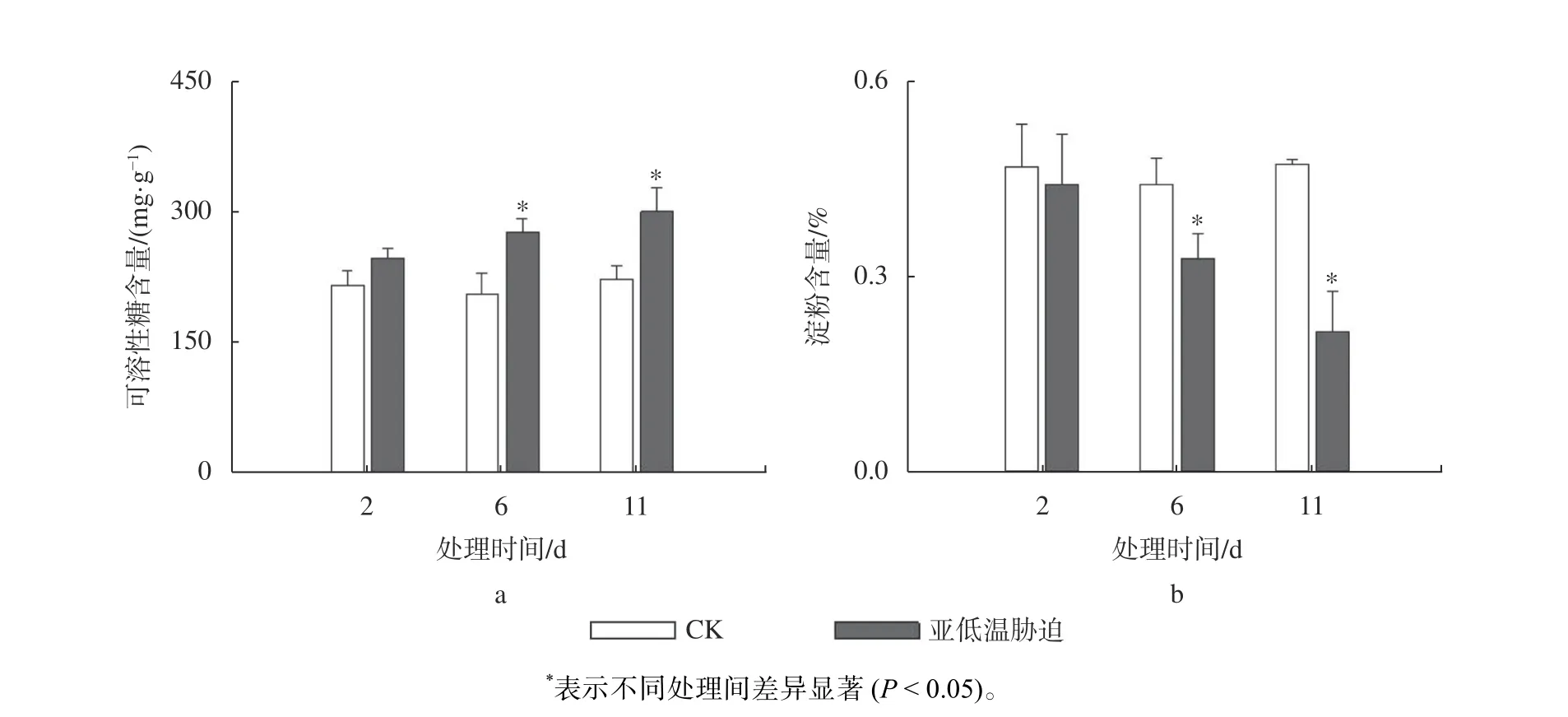
图5 亚低温胁迫对油茶叶片可溶性糖及淀粉含量的影响Fig. 5 Effect of sub-chilling stress on soluble sugar and starch content in C. oleifera leaves
2.5 亚低温胁迫对油茶叶肉细胞超微结构的影响
透射电镜下正常生长的油茶叶片叶肉细胞结构完整,细胞质均匀,中央液泡占据细胞内大部分空间,叶绿体呈梭形,粒片层垛叠整齐有序且体内有较丰富的淀粉粒分布,细胞核结构完整(图6a)。亚低温胁迫(10 ℃/5 ℃)11 d 后,油茶叶肉细胞结构能够维持完整,但淀粉粒的体积和数量明显减少,呈圆球形或椭球型,细胞核核膜较清晰,但核质均匀程度降低,液泡电子密度加深(图6b)。研究结果表明,亚低温胁迫下油茶叶肉细胞淀粉颗粒发生降解,可能通过转化为可溶性糖转运到液泡内或其他组织中,从而抵御亚低温对叶肉细胞造成的伤害。
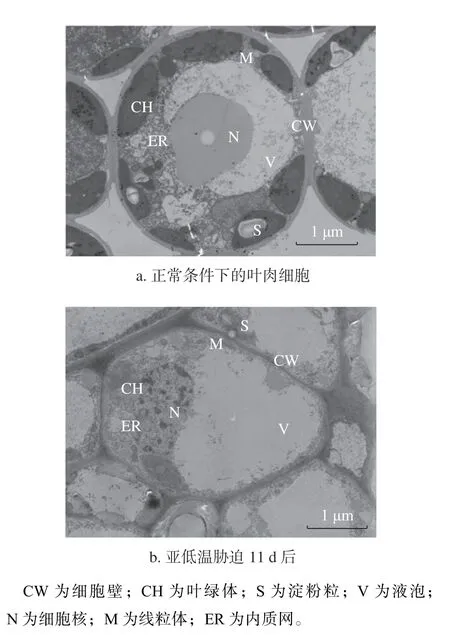
图6 亚低温胁迫下油茶叶肉细胞超微结构观察Fig. 6 Ultrastructure of mesophyll cells under sub-chilling stress
3 结论与讨论
光合色素具有吸收、传递和转化光能的功能,叶片中叶绿素含量与光合速率呈正相关,类胡萝卜素可以起到光能捕获和光破坏防御的作用[14],而叶绿素缺乏会降低植物光保护能力[15]。本研究中,随着亚低温胁迫处理时间的延长,油茶叶绿素a、叶绿素b 和总叶绿素含量均显著低于CK,导致光合性能的降低;类胡萝卜素含量显著降低,表明亚低温胁迫下油茶光破坏防御能力的降低,进一步导致光合机构的损伤。
根据果实成熟期,一般将普通油茶分为‘寒露籽’、‘霜降籽’、‘立冬籽’3 个品种群。‘华硕’通常在11 月初开花,立冬后达到盛花期[16],花期越晚的品种各生长器官对光合同化物的竞争性越强。因此,冬春的低温不仅影响‘华硕’授粉受精,还对其地理分布造成显著影响[17],推测这与低温胁迫下光合作用的维持能力密切相关[18]。研究已表明,植物光下低温胁迫会导致光合机构吸收的光能超过光合作用所能利用的数量,引起光抑制的发生[19]。在黄瓜(Cucumis sativus)上的研究发现,低温胁迫会通过ROS 的累计导致黄瓜PS Ⅱ和PS Ⅰ活性均发生显著抑制[20],但也有研究发现低温胁迫会导致多种热带树叶片PS Ⅱ光抑制的发生,而PS Ⅰ活性未受到显著影响[21]。本研究中,亚低温处理1d 的油茶叶片Fv/Fm及Pm均显著降低,其中Pm下降时间早于Fv/Fm,表明叶片PS Ⅱ与PS Ⅰ活性均受到了抑制,与PS Ⅱ相比,PS Ⅰ对亚低温更敏感,这可能与胁迫条件下PS Ⅰ处ROS 积累导致的氧化伤害有关[22]。研究发现,低温伴弱光(<100 μmol/(m·s))胁迫往往会加重植物PS Ⅰ光抑制,但适光条件(600 μmol/(m·s))下,棉花叶片PS Ⅰ未表现出光抑制[23],本研究仅探讨了适光环境下,亚低温对油茶光合机构的影响,弱光是否会加剧油茶叶片PS Ⅰ光抑制,而强光是否通过加剧PS Ⅱ光抑制从而减缓亚低温对PS Ⅰ的抑制程度,有必要进一步研究。
为全面了解亚低温胁迫对整条光合电子传递链的影响,利用连续激发式荧光仪分析PS Ⅱ供体侧、反应中心活性和受体侧的变化。Vk能够反映PS Ⅱ电子供体侧放氧复合体(OEC)活性大小,Vk升高表示供体侧受到伤害[24]。RC/CSm与ψEo可以作为反映胁迫对PS Ⅱ反应中心和电子受体侧的抑制程度的指标[25],PIabs可以反映光合电子传递链对光能的捕获,能更准确的表征植物光合电子传递链的状态[10]。本研究中,亚低温胁迫后,油茶叶片Vk值升高,RC/CSm和ψEo下降,表明PS Ⅱ供体侧、反应中心和受体侧都受到伤害,且相对反应中心和供体侧的活性下降而言,供体侧的活性下降程度较轻;在亚低温胁迫前期,PIabs显著降低,表明亚低温胁迫导致的油茶叶片光合机构的光合性能降低与PS Ⅱ反应中心活性和受体侧关系密切。因此在生产实际研究中,可以采用保护PS Ⅱ的反应中心活性和受体侧的策略,进行低温适应性筛选育种,防御亚低温胁迫对油茶PS Ⅱ活性的抑制。
植物的膜系统是抵御外界不良胁迫条件和维持内环境稳态的关键结构,膜透性的变化、及膜内细胞液渗透压等生理方面的变化大多都早于植株外部形态的变化,常被应用于抗逆性评价[23]。低温胁迫往往会致使植物细胞膜脂过氧化,改变细胞膜透性,引起相对电导率的增加,对膜和细胞造成伤害[26]。MDA 是细胞膜膜脂过氧化作用的产物之一,其含量能反映膜受损程度和植物组织抗氧化的能力[27-28]。逆境胁迫下可溶性糖(葡萄糖、果糖、蔗糖等)的积累有利于维持细胞内外正常的渗透压,提高植物抗逆性[29-30]。本研究中,亚低温胁迫下油茶叶片的相对电导率和丙二醛含量均显著增加,表明亚低温胁迫造成了油茶膜系统的损伤。可溶性糖的含量随着亚低温胁迫时间的延长呈增加的趋势,而淀粉含量降低,表明油茶通过促进淀粉转化为可溶性糖,从而缓解亚低温对油茶光合机构的进一步伤害。
综上所述,本研究发现亚低温胁迫下,油茶叶片叶绿素含量、Fv/Fm及Pm均显著降低,叶片光系统I 和II 的活性均受到抑制,导致光合机构的光合电子传递链活性降低。叶片光合机构电子传递链中PS Ⅱ电子供体侧、有活性反应中心数量及电子受体侧均发生不同程度的抑制。可溶性糖含量呈增加趋势,淀粉含量逐渐降低,一定时间内,油茶叶片可以通过累积可溶性糖,维持亚低温胁迫下光系统的活性。在生产实际中,可以采用保护PS Ⅱ的反应中心活性和受体侧的策略,进行低温适应性筛选育种,栽植耐寒性品种。油茶抵御亚低温胁迫的过程复杂,是生理、基因等多层次的调控,研究油茶抗寒光合生理指标变化是选育抗寒新品种的基础,目前油茶抗寒的代谢调控途径尚不清楚,特别是同化物转运机制还有待进一步研究。
