栗疫病菌侵染板栗枝条的显微观察
2022-02-10郝雅琼刘红星王泽华聂兴华李伊然陈旭王维香秦岭邢宇
郝雅琼 刘红星 王泽华 聂兴华 李伊然 陈旭 王维香 秦岭 邢宇


摘要
栗疫病是一种严重危害栗属植物的病害。为了明确栗疫病菌侵染板栗枝条的过程及侵染的关键时间点,本研究利用病理组织切片技术、显微镜和扫描电镜技术对栗疫病菌侵染板栗枝条的过程进行了观察。结果表明:接种栗疫病菌后0~5 h,菌丝先降解枝条表皮,进行横向营养生长的同时沿着伤口纵向侵染,为进入皮层做准备;接种后6 h病菌开始在表皮定殖,并侵入皮层;接种后9 h在皮层可观察到侵染性菌丝沿着细胞间隙向相邻细胞延伸;接种后12 h栗疫病菌侵入韧皮部,在皮层的侵染面积扩大。随着侵染程度加深,皮层、韧皮部等处细胞被菌丝降解,最终在形成层附近聚集。接菌后9 h为栗疫病菌侵染板栗枝条的关键时间点。
关键词
板栗枝条;栗疫病菌;侵染过程;显微观察
中图分类号:
S436.64
文献标识码:A
DOI:10.16688/j.zwbh.2020526
Microscopic observation on infection process of chestnut branches by Cryphonectria parasitica
HAO Yaqiong,LIU Hongxing,WANG Zehua,NIE Xinghua,LI Yiran,CHEN Xu,WANG Weixiang,QIN Ling,XING Yu*
(College of Plant Science and Technology, Beijing University of Agriculture, Beijing102206, China)
Abstract
Chestnut blight is a disease that harms Castanea species seriously. In order to clarify the infection process of Cryphonectria parasitica in chestnut branches and the key time point of infection, the infection process of C.parasitica in chestnut branches were examined by pathological tissue section technology, microscope and scanning electron microscopy observations, respectively. The results showed that zero to five hours after inoculation, the hyphae first degraded the epidermal cells of the branches, and horizontally grew while infecting longitudinally along the wound to prepare for entering the cortex. Six hours after inoculation, C.parasitica colonized the epidermis and invaded into the cortex. Nine hours after inoculation, obvious infective hyphae can be observed in the cortex and extended along the intercellular space to adjacent cells. Twelve hours after inoculation, the pathogen infected the phloem, and the infection area of the cortex expanded. As the degree of infection deepened, cells in the cortex and phloem were degraded by hyphae, and eventually gathered near the cambium. Therefore, 9 h was determined to be the key time point of infection.
Key words
chestnut branch;Cryphonectria parasitica;infection process;microscopic observation
栗屬植物在中国的分布地域十分宽广,在山东、河北、安徽、湖南、江西和福建等省份均有分布[1]。板栗Castanea mollissima Blume作为我国经济价值较高的乡土经济林木,其起源可以追溯到8 700万年以前[2]。板栗具有较高的食用与药用价值,栗木也具有很高的实用性,板栗生产中会遭受很多病虫害侵袭,其中栗疫病最为严重。
栗疫病是由栗疫病菌Cryphonectria parasitica (Murr.) Barr.寄生引起的一种严重危害栗树的病害,为世界性的森林病害之一[3- 5]。栗疫病菌起源于东亚,通过感病的栗树传播到其他大陆[6]。历史记录和种群遗传分析表明,栗疫病最初从日本本州岛传入北美[7], 此后,从日本其他地区引进的板栗也相继出现该病害,对北美的美洲栗影响十分严重。20世纪,栗疫病菌传播到欧洲[8]。 目前栗疫病主要分布在亚洲、欧洲、北美洲。板栗虽然被认为对栗疫病具有抗性[9],但在我国不少地区也出现了栗疫病,使其产业发展受到了不同程度的危害[10 -11]。嫁接不久、生长环境贫瘠、易感病的品种容易感染栗疫病。在某些地区板栗疫病也会成片发生,导致树死园毁[9,11]。
栗疫病菌属于真菌界,子囊菌亚门,核菌纲,球壳目,间座壳科,隐丛壳属[12]。 栗疫病的主要致病原是分生孢子,在条件适宜其生长时能反复侵染。栗疫病菌在秋季进入有性世代, 产生子囊,次年春季,子囊释放子囊孢子。栗疫病属于寄主主导性病害,病菌孢子从树体受伤部位侵入,虫伤、冻害、日灼、嫁接等造成的树体创口,是病菌孢子侵染的主要途径[13 -15]。
关于栗疫病菌的培养性状、形态特征、分类地位、生物学特征、侵染过程、生物防治等方面国内外已经开展了大量的研究工作[16- 21]。近些年,栗疫病菌EP155的基因组测序工作已经完成[22],栗疫病菌低毒性病毒Cryphonectria hypovirus 1(CHV1)已有3个不同菌株(CHV1EP713, CHV1Euro7和CHV1EP721)的基因组完成了测序并获得了侵染性克隆[23]。中外学者的研究主要集中在栗疫菌与低毒病毒互作等方面[24- 28]。有关该病菌侵染过程的显微观察尚缺乏深入研究。为此,本研究通过病理组织切片法、显微镜和扫描电镜观察法对栗疫病菌侵染板栗枝条的过程进行观察,旨在明确其侵染过程及侵染的关键时间点以及栗疫病菌侵染枝条过程中病菌与植物枝条互作的生物学过程,将为研究板栗疫病菌的致病机理提供参考。
1材料与方法
1.1试验材料
野生型栗疫病菌Cryphonectria parasitica菌株EP155保存于北京农学院植物科学技术学院,为野生型强毒力菌株,在PDA培养基上菌落为橘黄色。供试板栗来源于北京怀柔板栗试验与推广站的抗病品系野生板栗‘HBY1’,随机采取粗度一致且无病虫害的当年生营养枝条用于栗疫病菌的接种。
1.2试验方法
1.2.1栗疫病菌菌丝及分生孢子的形态观察
将供试菌株接种到PDA培养基上,在28℃条件下恒温光照培养3 d后,挑取少量菌丝制作玻片,在光学显微镜下观察菌丝形态特征。
1.2.2半薄切片
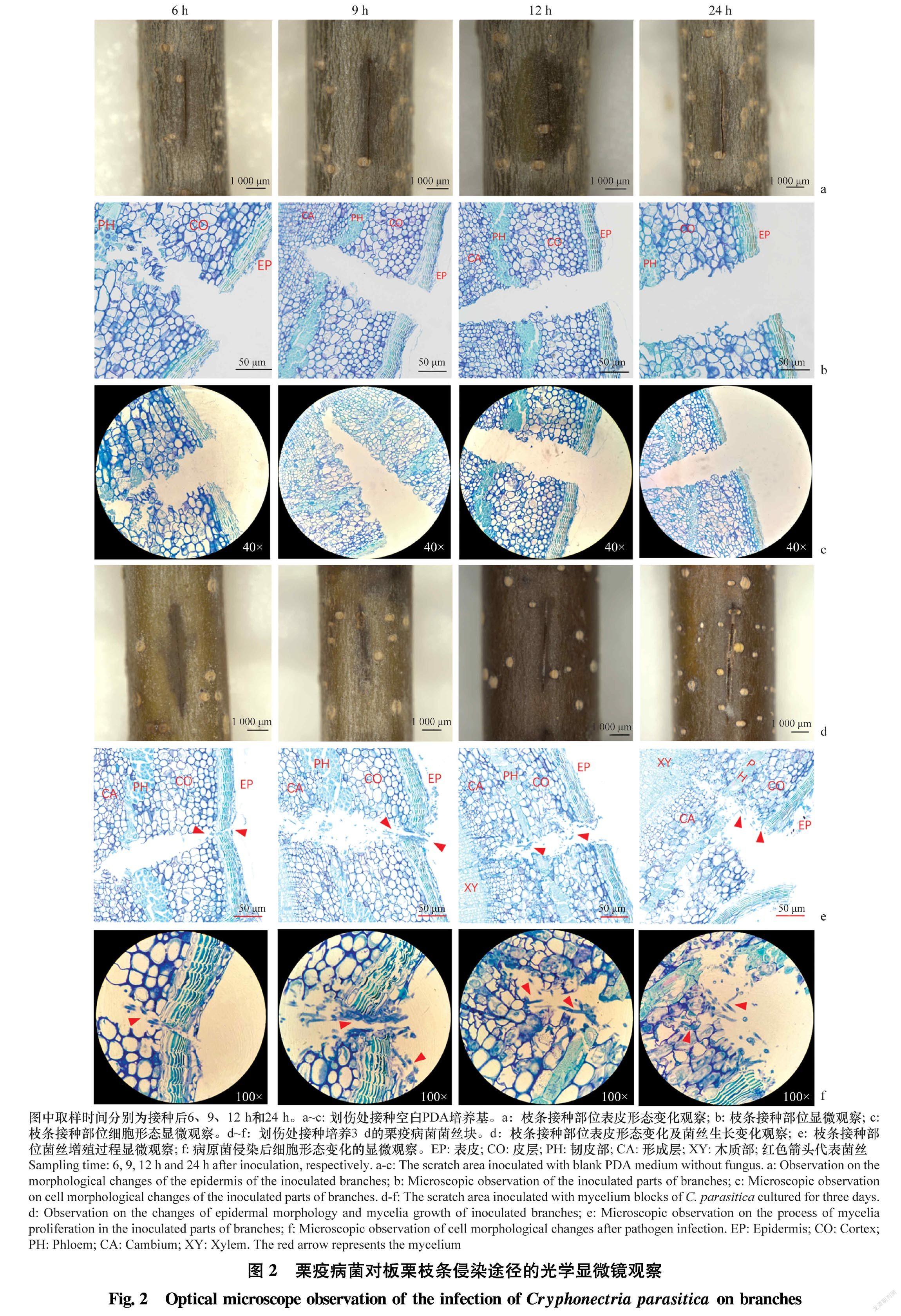
选取新鲜板栗树枝条,用手术刀在枝条上划出长5 mm的伤口,深度以到达形成层未到木质部为准(约2 mm),将培养3 d的栗疫病菌菌丝块接种于枝条的切口上。以接种空白PDA培养基为对照,重复3次。接种后将枝条放在铺有吸水纸的培养皿里,吸水纸浸透无菌水使菌丝块周围保持较高湿度,于25~28℃,相对湿度60%~70%的培养箱中培养。取样时间分别为接种后5、6、7、8、9、10、11、12、24 h和48 h。
(1)取材固定取栗疫病菌侵染后的枝条,切取接种部位,将其切成厚0.5~1 mm的圆柱形小块。 将材料放入固定液(70%叔丁醇 ∶40%甲醛 ∶丙酸 ∶丙三醇=17 ∶1 ∶1 ∶1)中,抽真空至离心管材料附近没有气泡且材料下沉到离心管底部,在4℃冰箱中保存2 d。
(2)清洗脱水用PBS(pH=7.4)缓冲液清洗3次,每次30 min;再用无菌水清洗2次,每次浸泡15 min。 在室温下,用10%、30%、50%、70%、90%、100%乙醇梯度脱水,每次30 min。
(3) 渗透包埋分别用不同浓度梯度的渗透溶液 [Solution A (Technovit 7100) ∶100%乙醇 =1 ∶3、 1 ∶1、3 ∶1]進行塑料渗透,每个梯度室温浸泡12 h,最后浸于纯Solution A中4℃冰箱过夜。将经塑料渗透后的样品转移至模具底部,枝条纵切面紧贴模具面。立刻加入预冷的500 μL聚合液(Solution A ∶HardenerⅡ=15 ∶1)封存材料。用封口膜盖住模具,室温过夜聚合后切片。
(4)切片染色切取2 μm的薄片置于载玻片上,用0.05%甲苯胺蓝溶液染色1 min,无菌水清洗4~5次,每次1 min,将染色后的切片常温晾干后加2~3滴中性树脂,置于通风橱散发残留的树脂。在显微镜(BX51, Olympus, 日本)下观察拍照。
1.2.3扫描电镜观察
取栗疫病菌侵染后的枝条,切取接种部位,将其切成厚0.5~1 mm的圆柱形小块,参照张友玉等[29]的方法制备扫描电镜样品。将材料4℃固定2 d,用pH=7.4的PBS缓冲液冲洗5~6次,每次30 min,然后用10%、30%、50%、70%、90%、95%、100%乙醇依次脱水30 min,其中100%乙醇脱水2次,随后用叔丁醇置换3次,每次30 min。将置换后的样品浸泡在叔丁醇中, 20℃ 15 min。取出样品置于冷冻干燥仪中至叔丁醇完全挥发。将样品用导电胶粘于样品台,喷金后置于扫描电子显微镜(5136SB, TESCAN, 捷克)下观察拍照。
2结果与分析
2.1栗疫病菌分生孢子和菌丝的形态特征
栗疫病菌菌丝无色,培养4 d后菌丝淡黄色、 橘黄色或无色,较密集,气生菌丝少,菌丝直径1.1~4.5 μm,分支与主支多呈直角。分生孢子器不规则,大小不一,淡黄至茶褐色;分生孢子单胞,无色,长椭圆形或圆柱形(图1)。
2.2栗疫病菌对板栗枝条的侵染过程
2.2.1栗疫病菌对板栗枝条侵染途径的光学显微镜观察
接种后6 h栗疫病菌沿着伤口开始进行横向营养生长,同时在伤口处定殖,准备侵入皮层。在接种部位可以观察到菌丝,且表皮颜色加深至褐色。接种后9 h皮层细胞内菌丝大量增殖,侵染范围进一步扩大并开始接近韧皮部,可以观察到接种处出现凹陷(图2)。接种后12 h菌丝开始降解皮层细胞,且侵入韧皮部开始向形成层发展,此时可观察到接种处表面有部分菌丝。接种24 h后,被栗疫病菌降解的皮层细胞与表皮分离,皮层细胞内布满大量菌丝,菌丝在形成层周围分布,此时枝条接种处可见大量白色菌丝。
2.2.2栗疫病菌对板栗枝条侵染途径的扫描电镜观察
为进一步确认菌丝的侵染途径,进行了扫描电镜观察。由图3可以观察到接种后6 h栗疫病菌主要是在表皮及伤口处的细胞定殖,为侵入皮层做准备,表皮已被菌丝降解。接菌9 h后可以看到栗疫病菌侵入皮层,皮层细胞中出现大量菌丝。菌丝主要在细胞交界处或细胞间隙延伸,伴随着栗疫病菌的侵染在细胞内产生了较多淀粉粒,此时部分细胞形态还较完整。接菌12 h后,大部分细胞皮层已被降解,此时观察不到较完整的细胞。因此确定9 h为栗疫病菌侵染枝条的关键时间点,此时菌丝通过细胞的交界处侵染寄主细胞,而寄主则产生淀粉粒等相关物质来抵抗。
3结论与讨论
本研究通过显微观察的方法对栗疫病菌侵染板栗枝条的过程进行了观察,发现栗疫病菌的侵染是一个动态变化的过程,接种栗疫病菌后0~5 h,菌丝先降解枝条表皮进行横向营养生长,同时沿着伤口纵向扩展,为侵入皮层做准备;接种后6 h菌丝在表皮定殖并侵入皮层;接种后9 h,在皮层可以明显观察到侵染性菌丝沿着细胞间隙向相邻细胞延伸,同時寄主细胞内产生淀粉粒;接种后12 h可以观察到栗疫病菌侵入韧皮部,在皮层的侵染面积扩大且细胞中充满大量菌丝,随着侵染程度加深,皮层、韧皮部等处细胞被菌丝降解,最终在形成层附近聚集。
在观察栗疫病菌侵染板栗枝条的过程中,我们发现病原菌首先在伤口周围的表皮扩展,寻找可以侵入细胞的机会,然而在栗疫病菌接种6 h后,我们只在伤口处的细胞中观察到病菌菌丝的侵入。这与栗疫病菌主要从树皮裂缝处或伤口侵染树干,健康无伤口的栗树基本不发病的研究结果一致[30]。其次,在侵染过程中菌丝最后停留在形成层,只在形成层形成紧密的扇形菌丝层,基本不进入木质部。Hebard[31]利用组织学方法对溃疡病菌的侵染过程进行了研究,发现孢子萌发后,寄生菌形成菌丝扇的过程是溃疡病形成和病斑面积扩大的关键。菌丝在板栗树皮和形成层细胞间扩展,随后菌丝扇内菌丝增殖使菌丝扇顶端附近的部分寄主细胞壁破碎。 周而勋等[5]也发现栗疫病菌主要在皮层和形成层中蔓延, 当病害发生严重时, 木质部表层亦可受害。由此我们推测横向生长是为了更大面积地降解表皮,从而有利于病菌在植物组织中定殖。此外,我们观察到,接种后9 h,栗疫病菌通过细胞间隙或细胞交界处在细胞间延伸,推测菌丝在细胞间的延伸主要是通过胞间连丝,并且病原菌会选择细胞交界处等薄弱处扩展, 同时在菌丝附近产生了较多淀粉粒,阻碍了病菌菌丝在细胞内的扩展,与菌丝相伴产生的淀粉粒是病原菌与寄主互作的结果。杨民和等[32]对稻瘟菌侵染的水稻叶片进行激光扫描共聚焦显微镜观察表明,细胞内的病菌菌丝周围发生了寄主原生质沉积,抑制细胞内病菌菌丝的生长。本研究对栗疫病菌侵染板栗枝条的过程进行显微观察,明确了其侵染过程及侵染的关键时间点,揭示了板栗枝条的发病过程、坏死及崩解反应,在细胞学水平上阐明了病菌与植物枝条互作机制,同时也为研究栗疫病菌致病机理和病害防治奠定了基础。
参考文献
[1]张宇和, 柳鎏, 梁维坚. 中国果树志 板栗 榛子卷[M]. 北京:中国林业出版社, 2005.
[2]SHI Zhuogong, STOSSER R. Reproductive biology of Chinese chestnut (Castanea mollissima Blume) [J]. European Journal of Horticultural Science, 2005, 70(2): 96 -103.
[3]密克. 板栗疫病菌菌株EP155和EP713在线粒体上的差异蛋白质组学研究[D]. 南宁: 广西大学, 2012.
[4]张林巧. 低毒力病毒CHV1CN280对寄主毒性的影响及其p29基因在栗疫菌及稻瘟菌中的功能分析[D]. 南京: 南京农业大学, 2011.
[5]周而勋, 王克荣, 陆家云. 栗疫病研究进展[J]. 果树科学, 1999(1): 66 -71.
[6]程继鸿, 秦岭, 高遐红. 板栗抗栗疫病的研究进展[J]. 北京农学院学报, 1997, 12(2): 77 -82.
[7]DUTECH C, BARRS B, BRIDIER J, et al. The chestnut blight fungus world tour: successive introduction events from diverse origins in an invasive plant fungal pathogen [J]. Molecular Ecology, 2012, 21(16): 3931 3946.
[8]GRIFFIN G J. Chestnut blight and its control [M]. Chichester, West Sussex, UK: Horticultural Reviews, 2011.
[9]杨旺, 韩光明, 罗晓芳. 我国板栗疫病研究初报[J]. 北京林业大学学报, 1979(1): 74- 77.
[10] 赵云琴, 张英, 沈百炎. 板栗胴枯病的发生及防治研究[J]. 植物保护, 1980(1): 13 -16.
[11] 周而勋, 王克荣, 陆家云. 中国东部11省(市)栗疫病的发生条件[J]. 南京农业大学学报, 1993(3): 44 -49.
[12] KIRK P M, CANNON P F, DAVID J C, et al. Bisby’s dictionary of the fungi [M]. Wallingford, Oxon, UK: CABI Bioscience, 2001.
[13] 蓝颖. 板栗疫病菌分泌蛋白组差异及蛋白功能研究[D]. 南宁: 广西大学, 2017.
[14] 张丹. 板栗疫病病原菌致病性差异分析[D]. 杨凌: 西北农林科技大学, 2014.
[15] 潘琪. 栗疫菌营养体亲和型多样性比较及野生栗栗疫菌交配型的分子检测[D]. 北京: 北京林业大学, 2012.
[16] 秦岭, 程继鸿, 高遐虹, 等. 燕山板栗疫病菌的培养性状与菌株的营养体亲合性研究[J]. 北京农学院学报, 2001, 16(1): 15 -21.
[17] 郭世保, 徐瑞富, 刘鸣韬. 栗疫病研究进展[J]. 中国农学通报, 2005, 21(5): 339- 340.
[18] 朱家祥, 张宜仁, 黄应成. 栗疫病发病条件调查与综合防治对策[J]. 陕西林业科技, 2009(1): 74 -75.
[19] 张贤鸣, 孙瑶, 白洁, 等. 栗树腐烂病的发生与防治[J]. 河北果树, 2015(5): 54.
[20] RIGLING D, PROSPERO S. Cryphonectria parasitica, the causal agent of chestnut blight: invasion history, population biology and disease control [J]. Molecular Plant Pathology, 2018, 19(1): 7 -20.
[21] ANAGNOSTAKIS S L. Chestnut blight: the classical problem of an introduced pathogen [J]. Mycologia, 1987, 79(1): 23 -37.
[22] CROUCH J A, DAWE A, AERTS A, et al. Genome sequence of the chestnut blight fungus Cryphonectria parasitica EP155: A fundamental resource for an archetypical invasive plant pathogen [J]. Phytopathology, 2020, 110(6): 1 -16.
[23] DAWE A L, NUSS D L. Hypoviruses and chestnut blight: exploiting viruses to understand and modulate fungal pathogenesis [J]. Annual Review of Genetics, 2001, 35(1): 1- 29.
[24] 李林生, 周思思, 姚顏萍, 等. 板栗疫病菌cpomt基因的功能[J]. 基因组学与应用生物学, 2017, 36(1): 305- 310.
[25] KO Y H, CHOI S Y, SO K K, et al. Functional analysis of an essential Ranbinding protein gene, CpRbp1, from the chestnut blight fungus Cryphonectria parasitica using heterokaryon rescue [J/OL]. Scientific Reports, 2020, 10: 8111. DOI: 10. 1038/s41598-020-65036-7.
[26] 商巾杰, 陈保善. 低毒病毒及板栗疫病菌低毒力机制[J]. 基因组学与应用生物学, 2009, 28(5): 835 -844.
[27] CELIKER N M, KAPLAN C, ONOGUR E, et al. Natural dissemination of hypovirulent Cryphonectria parasitica strain used for biological control of chestnut blight [J]. Turkish Journal of Agriculture & Forestry, 2017, 41(4): 278 -284.
[28] CHUN J, KO Y H, KIM D H. Transcriptome analysis of Cryphonectria parasitica infected with Cryphonectria hypovirus 1 (CHV1) reveals distinct genes related to fungal metabolites, virulence, antiviral RNAsilencing, and their regulation [J/OL]. Frontiers in Microbiology, 2020, 11: 1711. DOI: 10. 3389/fmicb. 2020. 01711.
[29] 张友玉, 陈良碧. 烟草叶片组织结构的扫描电镜观察方法[J]. 电子显微学报, 2000, 19(2): 154-157.
[30] 王新花, 潘若良, 王会永, 等. 板栗疫病的侵染循环规律[J]. 山东林业科技, 1998(1): 22-24.
[31] HEBARD F V. Developmental histopathology of cankers incited by hypovirulent and virulent isolates of Endothia parasitica on susceptible and resistant chestnut trees [J]. Phytopathology, 1984, 74(2): 433-445.
[32] 杨民和, 郑重, LEACH J E. 水稻受稻瘟菌侵染后发病初期的细胞学反应[J]. 实验生物学报, 2004, 37(5): 344-350.
收稿日期:2020 -10- 09修订日期:2020- 11- 27
基金项目:
国家重点研发计划(2018YFD1000605);北京市属高等学校创新团队建设与教师职业发展计划(IDHT20180509)
* 通信作者
Email:xingyubua@163.com
