MTT 法和LDH法评价纳米银抗菌凝胶的体外细胞毒性
2022-02-10袁博张娜景明天津市医疗器械质量监督检验中心天津300384
袁博 张娜 景明 天津市医疗器械质量监督检验中心 (天津 300384)
内容提要: 目的:对纳米银抗菌凝胶进行体外细胞毒性评价。方法:试验选用L929小鼠成纤维细胞,通过MTT试验和LDH试验,对被测物进行研究。结果:MTT试验的LC50为0.047g/mL,LDH试验的LC50为0.048g/mL。结论:纳米银离子会破坏细胞线粒体和细胞膜完整性。
纳米银材料具有高比表面积、广谱抗菌性能等优良特性,在医用抗菌敷料、生殖健康、手术器械等医疗器械方面具有广阔的应用前景。国家药品监督管理局已将纳米生物材料类医疗器械(如纳米金属银材料制成的医疗器械)明确规定为第三类医疗器械管理,并重点关注其在细胞毒性、基因毒性等生物相容性方面的研究。纳米材料本身会引起细胞线粒体功能障碍,使细胞膜通透性改变与破损,起到杀菌抗菌的作用同时会表现出明显的细胞毒性。细胞毒性试验通过体外细胞培养技术,检测被测物接触细胞后细胞发生生长抑制、功能改变、溶解、死亡或其他毒性反应,是医疗器械或医用材料生物学评价体系中最重要的检测指标之一,在国内外生物学评价标准中均将细胞毒性试验列为首选项目[1,2]。本试验选用L929小鼠成纤维细胞,通过MTT试验和LDH试验,对被测物进行研究。
1.材料与方法
1.1 一般材料
实验起止时间为:2021年6月~2022年10月。
试验材料:纳米银妇女外用抗菌凝胶(来源:市售,规格:3支/盒,标识有效成分含量:纳米银含量>400µg/g)。
细胞株:L929小鼠成纤维细胞(来源:中国科学院典型培养物保藏委员会细胞库)。
主要试剂与材料:胎牛血清(来源:Gibco公司)、MEM培养基干粉(来源:Gibco公司)、四唑盐(MTT,来源:Solarbio公司)、二甲基亚砜(DMSO,来源:Merck公司)、高密度聚乙烯薄膜(来源:上海克林莱塑料有限公司保鲜袋)、对乙酰氨基酚(来源:国药集团试剂有限公司)、Triton-X-100(来源:Amresco公司)、LDH试剂盒(来源:Roche)。
仪器设备:CO2培养箱(型号:Nu-5500E)、电子天平(型号:JJ600)、倒置显微镜(型号:TS100)、酶标仪(型号:TECAN SUNRISE TS)。
1.2 方法
选用L929小鼠成纤维细胞作为试验体系,以纳米银抗菌凝胶为测试对象,将纳米银妇女外用抗菌凝胶直接稀释于含10%血清细胞培养基中,按0.1g/mL稀释原液、70%、60%、50%、40%、30%稀释液设立浓度,同时设空白、阴性、阳性对照组,接触细胞24h后分别进行细胞毒性的MTT测定和LDH测定,计算LC50。
1.2.1 试验液制备
试验样品稀释液制备:取样品2.90g,加入29.0mL含10%血清培养基,震荡混合均匀后,用含10%血清培养基配制成70%、60%、50%、40%、30%稀释液。
空白对照组的设立:含10%血清培养基于(37±1)˚C下放置(24±2)h,于(37±1)˚C下放置(24±2)h。
阴性对照组的设立:取1张表面积为24cm2的无菌高密度聚乙烯薄膜,按6cm2/mL的比例加4mL的含10%血清培养基,于(37±1)˚C下放置(24±2)h。
阳性对照组的设立:用含10%血清培养基配制浓度为30mmol/L的对乙酰氨基酚,用于MTT试验的阳性对照。用含10%血清培养基配制浓度为1%的Triton-X-100,用于LDH试验的阳性对照。
1.2.2 试验方法
细胞准备:取生长良好的细胞,经胰酶消化后调整细胞密度约为1×105/mL,制成细胞悬液。在每块96孔板上板设空白对照、阴性对照、各组稀释液、对乙酰氨基酚阳性对照和Triton-X-100阳性对照。每组共6孔,其中前5孔各接种100µL细胞悬液,后1孔设立各相应无细胞空白对照,加入100µL不含细胞的培养基。在96孔板外围一圈加入100µL培养基。置37˚C、5%CO2培养箱内培养24h,以使细胞达到近汇合状态,保证细胞恢复、贴壁并增殖到对数生长期。
MTT测定:除阳性对照组外,弃去各组原培养基,依次加入100µL相应制备液,继续培养24h。24h后,从培养箱中取出96孔板,弃去阳性对照组孔内的液体,加入100µL 1% Triton-X-100。室温下放置10min,700g离心3min后,从初始96孔板中取出各组液体,50µL/孔,转移至另一块96孔板,准备进行LDH试验。弃去初始96孔板内的所有液体,每孔加200µL的新鲜培养基,每孔再加入50 µL的MTT溶液,37˚C下孵育4h。取出96孔板,700g离心3min,弃去培养基和MTT溶液,每孔加200 µL DMSO,再添加25 µL甘氨酸缓冲液,置振荡器上混匀10min。用酶标仪检测,检测波长570nm,参考波长650nm。

LDH测定:各组与细胞接触24h后,从初始96孔板中取出各组液体,每孔中吸出50µL,转移至另一块96孔板(按原来模板的样品分布分别转移),暂放4˚C保存,尽快取出已有转移出50µL液体的96孔板,按照LDH测定试剂盒说明书的要求进行试验。每孔加入50µL反应混合液后混匀。室温下避光孵育30min,用酶标仪检测,检测波长490nm,参考波长650nm。

2.结果
每组测试各重复5个孔,计算时扣除其相应的无细胞空白组的吸光值后,依次计算MTT试验和LDH试验的结果,见表1。结果显示阴性和阳性对照均在预期范围内,进一步将各稀释浓度和MTT增殖率、LDH释放率分别进行四参数曲线拟合,得到浓度-反应曲线,见图1~2,分别计算出MTT试验的LC50为0.047g/mL,LDH试验的LC50为0.048g/mL。
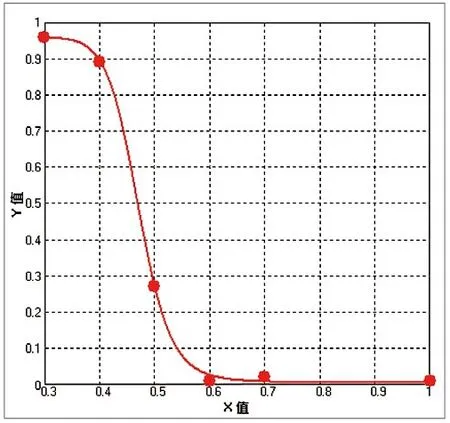
图1.MTT试验剂量-反应曲线

图2.LDH试验剂量-反应曲线

表1.LDH试验和MTT试验各组结果及数据分析
3.讨论
纳米银抗菌凝胶多由纳米银和医用高分子凝胶构成。纳米银抗菌凝胶外用于皮肤后,通过凝胶作为药物缓释载体,能够缓释放出纳米银颗粒,抑制并杀灭与之接触的病菌,同时,凝胶为伤口提供湿润、封闭环境,促进伤口愈合。现有研究表明,纳米银具有广谱抗菌作用,纳米银可以在细菌内膜中积聚,增加膜通透性,并与细菌细胞壁中的含硫蛋白质相互作用,从而导致细菌壁破裂。同时也可以进入到细菌内部,与细菌DNA和蛋白质中的硫或磷基团、以及酶中硫醇基团相互作用从而诱导活性氧和自由基产生,激活凋亡途径[3]。但纳米银本身能够改变与破坏细胞膜的通透性,穿透细胞膜的特点也可以使其裂解正常细胞,从而引起正常细胞线粒体功能障碍,因此,纳米银起到杀菌抗菌的作用同时会表现出明显的细胞毒性,同时有研究表明,纳米银的细胞毒性与浓度呈剂量依赖关系,并且与直径呈负相关[4]。因此,医疗器械在研制开发应中结合其可能导致的细胞毒性合理使用纳米银材料。
本试验选用L929小鼠成纤维细胞,通过MTT试验和LDH试验,对被测物进行研究。两个方法均是检测细胞存活和生长的方法。活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒并沉积在活细胞中,通过有机溶剂复溶细胞中的甲瓒,用酶标仪在570nm处测定其光吸收值,可间接反映活细胞数量,在一定细胞数范围内,MTT结晶形成的量与存活细胞数成正比。活细胞的胞浆内含有乳酸脱氢酶LDH,正常情况下,LDH不能透过细胞膜,当细胞受到NK细胞的杀伤后,LDH释放到细胞外,当LDH氧化乳酸形成丙酮酸盐后,丙酮酸盐和四唑盐反应转化成甲臜,该甲臜染料可溶于水,并可通过酶标仪在490nm处检测吸光度值用于检测细胞膜的完整性,LDH的释放量与存活细胞数成反比。
随着纳米科技的发展,人们对纳米银材料的研究越来越深入,银在纳米状态下可以缓慢地、长时间释放银离子,具有极强的杀菌、抗菌作用。目前纳米银作为抗菌材料在医疗器械领域已经得到广泛应用,因而非常有必要对常见的纳米银医疗器械进行生物安全性研究。纳米银医疗器械表现的细胞毒性和其本身的特性有着密切的关系,可以通过利用体外细胞培养方式来评价生物材料和医疗器械或其浸提液中潜在的细胞毒性,纳米银粒子比较容易透过细胞膜上的孔隙进入细胞内或进入包括线粒体、内质网、溶酶体、高尔基体和细朐核等细胞器内,并且和生物大分子发生结合或催化化学反应,使生物大分子和生物膜的正常立体结构发生改变,从而产生相应的细胞毒性。因此在开发研制纳米银医疗器械过程中,利用其具有抗菌抑菌的高效性的同时,还要看它是否对正常组织细胞是否有较低的毒性,具有较好的生物相容性,确保纳米银医疗器械在临床安全有效的使用。
为完善科学合理的评价方法和样品制备方法,本试验参考ISO 10993-5:2009、ISO 10993-12:2012和美国ASTM/E2526-08的细胞毒性试验方法(MTT试验、LDH试验)的要求[5,6],对纳米银抗菌凝胶进行样品制备并评价其细胞毒性。
3.1 方法的选择
结合纳米银材料本身会引起细胞线粒体功能的影响及对细胞膜的损伤的特点,为排除产品自身可能对MTT试验产生的一定干扰因素,本次细胞毒性研究增加了LDH试验方法,用以评价纳米颗粒对细胞膜的损伤,以获得准确全面的结果。
根据纳米银材料不同的细胞毒性机制来选择相应的阴性,阳性对照材料。高密度聚乙烯具有较好的生物相容性,是常用于生物学评价中的阴性对照品。基于APAP的细胞毒性机制为通过提高ROS因子的含量,进而破坏细胞线粒体的功能,最后导致细胞的死亡,这点与纳米材料的细胞毒性机制相似,故选择该材料作为MTT试验阳性对照材料。Triton-X-100的细胞毒性机制为破坏细胞膜的完整性,最终导致乳酸脱氢酶的大量释放,这点与纳米材料的另一细胞毒作用机制相符,故选择该材料为LDH试验的阳性对照材料。
3.2 试验条件的选择
不同的浸提介质和浸提条件可能会影响纳米颗粒的表面特性,如:颗粒的大小、颗粒的聚集特性、表面电荷的变化、蛋白质及其他物质的吸附、离子的释放等,进而影响纳米材料的细胞毒性反应。根据目前的认知水平,可以使用含血清的细胞培养基做溶解介质。
3.3 结果分析
有文献报道显示,纳米银颗粒随着浓度的增加,细胞增殖率降低,细胞毒性逐渐增加,呈现明显的剂量-效应相关性[7]。本次试验选择0.1g/mL作为初始浓度,稀释后进行MTT试验和LDH试验,设细胞增殖率在10%以下的对应浓度为最大毒性浓度,设细胞增殖率在90%以上的对应浓度为最小稀释浓度,结果显示,纳米银含量在30%~60%稀释范围内,呈现明显的剂量效应反应。同时通过对各稀释浓度和MTT增殖率、LDH释放率进行四参数曲线拟合,制得到浓度-反应曲线,找到该测试物的LC50在0.047~0.048g/mL的范围内,同时具有明显的剂量-效应关系。
细胞毒性被认为是细胞功能的损伤,包括但不局限于质膜完整性破坏、细胞器功能的干扰和细胞骨架破坏,本次研究仅通过从纳米银破坏细胞线粒体和破坏细胞膜完整性的不同角度来评价纳米银抗菌凝胶的细胞毒性,缺乏从分子水平进行机制方面的研究。同时医疗器械和医用材料对使用者健康的影响因素也是非常复杂的,仅对纳米银医疗器械进行细胞毒性的检测与评价也是远远不够的,仍需要大量而全面的生物学评价方法对其进行系统研究。
