电针对VD大鼠学习记忆能力及海马CA1区SIRT1/PGC1-α表达的影响*
2022-02-10李文强
叶 伟 李文强 汪 玥 胡 馨 王 林 丁 见
皖南医学院 1 临床医学院 2 基础医学院,安徽省芜湖市 241002
血管性痴呆(Vascular dementia,VD)是由于脑中血管发生病变,引起脑血液供应不足,进而表现出认知功能障碍[1]。随着社会的发展和人口老龄化进程的加速,脑血管病发病率逐年增加,因此VD 的发病率也在不断上升,据研究发现VD的发生与炎症反应、缺氧和低灌注引起的氧化应激以及发生的神经元凋亡有着密切的关系[2]。慢性脑缺血状态下大鼠的线粒体功能发生紊乱,引起氧化应激,损伤海马CA1区神经元,最终发生神经退行性改变,认知功能下降[3]。
VD的主要疾病特点为学习、记忆等认知功能的减退,大脑海马CA1区是学习、记忆、情绪等相关的重要脑区。沉默信息调节因子1(Silent information regulator 1,STRT1)在海马体CA1中有丰富的神经元表达,参与重要的生理学过程,如细胞的氧化应激和细胞凋亡,其机制是去乙酰化调控下游分子[4]。过氧化物酶体增殖物激活受体γ辅激活因子1α(Peroxisome proliferator-activated receptor γ coactivator 1α,PGC1-α)在许多认知功能发生障碍的中枢神经系统疾病的发生发展中起到重要的作用,激活的PGC1-α能够消除自由基,诱导细胞抗氧化酶的表达,提髙组织的抗氧化能力[5]。研究证实针灸对于改善血管性痴呆患者的症状,延缓VD进程方面有确切的效果。赵建新等[6]使用电针干预百会穴后,明显改善了血管性痴呆在认知功能方面的障碍。本实验通过电针干预,探究电针治疗改善VD大鼠学习记忆能力的机制。
1 材料与方法
1.1 材料 (1)动物:成年健康雄性SD大鼠24只,体重(250±20)g,购自浙江省实验动物中心,动物生产许可证号:SCXK(鲁)20190003。(2)主要试剂:SIRT1(bs-2257R)抗体(北京博奥森生物技术有限公司);PGC1-α(bs-7535R)抗体(北京博奥森生物技术有限公司);兔IgG-免疫组化试剂盒(SA2002 1/4KIT,博士德生物工程有限公司);Nissl staining溶液(北京索莱宝科技有限公司)。(3)主要仪器:轮转式石蜡切片机(德国Leica公司),华佗牌电子针疗仪(苏州医疗用品有限公司),BX51显微镜(日本OLYMPUS公司)。
1.2 方法
1.2.1 动物分组。置于室温(23±2)℃,相对湿度(60±5)%的环境中适应性喂养1周后,将大鼠随机分为对照组、模型组和电针组,每组8只。
1.2.2 模型制备。VD模型通过2VO的方法进行复制:大鼠造模前禁食不禁水12h后称重,麻醉使用1%戊巴比妥钠(0.3ml/100g)腹腔注射,将大鼠以仰卧位固定在手术台上,消毒、备皮沿颈正中切口切开,逐层剥离至充分暴露双侧颈总动脉后将其用手术缝线结扎,将分离的组织复位后缝合伤口。术后3d内,每天注射0.5ml青霉素预防后续感染,放回笼中,保温饲养,控制大鼠的直肠温度在37℃左右。对照组进行同样手术操作,但双侧颈总动脉不做结扎处理。
1.2.3 治疗方法。对电针组的大鼠用1%戊巴比妥钠腹腔注射(0.3ml/100g)麻醉后将大鼠侧卧位放置,用频率2Hz、强度3V、波宽1ms的疏密波电针治疗“百会”穴和“足三里”穴,百会穴位于顶骨与顶间骨之间正中凹陷处 (即两耳郭前缘根部连线中点);足三里在后肢前外侧, 犊鼻下约6mm, 胫骨前缘旁开约2mm。连续4周,1次/d,30min/次,对照组和模型组用同样方法麻醉但不电针。
1.2.4 Morris水迷宫实验。定位航行实验:在第2~4天,将每组大鼠沿壁从固定象限排列放置在水中。如果大鼠在90s内找到平台,则将大鼠找到平台所耗费的时间记录下来,并使其停留在平台上20s;如果大鼠在90s内未找到平台,则将大鼠引到平台,并同样在平台上停留20s的时间,并记录90s作为此大鼠逃避潜伏期的时间。每天除了平台所位于水中的象限外,其他三个象限所测定出来的结果依次记录下来,将平均值作为每天的逃避潜伏期的时间。
空间探索试验:在第5天,将平台移开,将进水点选为平台象限的对立象限,将大鼠沿壁放进水中,并记录了其在平台所在象限内所活动的时间。
1.2.5 样品收集。腹腔注射1%戊巴比妥(0.3ml/100g),暴露心脏,并通过左心室升主动脉灌注4℃4%多聚甲醛缓冲液固定。根据George Baxinos的《大鼠大脑定位立体图》取出所需要的脑组织,置于4%多聚甲醛溶液中固定24h,最后将其包埋在石蜡中。
1.2.6 尼氏染色。取上述处理好的组织切片放入焦油紫染色液中,避光,然后在56℃恒温箱中1h后用去离子水洗涤,接着将其放入尼氏液中分化至在显微镜下背景接近无色,然后脱水,透明,封片。
1.2.7 免疫组化检测。取各组大鼠脑组织石蜡切块进行切片,厚5μm。经脱蜡至水,3%过氧化氢去离子水消除内源性过氧化物酶活性、抗原热修复,山羊血清封闭,用多克隆抗体在 4℃以 1∶150 稀释,一抗孵育18h。用山羊抗兔IgG抗体后滴加SABC检测的表达。用DAB显色液显色后,封片。通过显微镜观察、结合大鼠脑立体定位图谱确定所在位置、最后使用图像分析系统对检测大鼠海马CA1区的SIRT1和PGC1-α的免疫阳性细胞进行拍照,用来计数和测灰度值,统计出阳性细胞数量和平均灰度值。
1.3 统计学方法 统计分析使用SPSS18.0统计软件,其中组间比较使用单因素方差分析,结果以均数±标准差表示,P<0.05表示差异有统计学意义。
2 结果
2.1 行为学实验结果 由实验数据可得,模型组大鼠在第5天时平均逃避潜伏期时间较对照组大鼠高(P<0.05),且其平台象限活动时间比例低于对照组大鼠(P<0.05);电针组大鼠在第5天时平均逃避潜伏期时间低于模型组(P<0.05),且其原平台象限活动时间比例相对于模型组要高(P<0.05)。见图1。
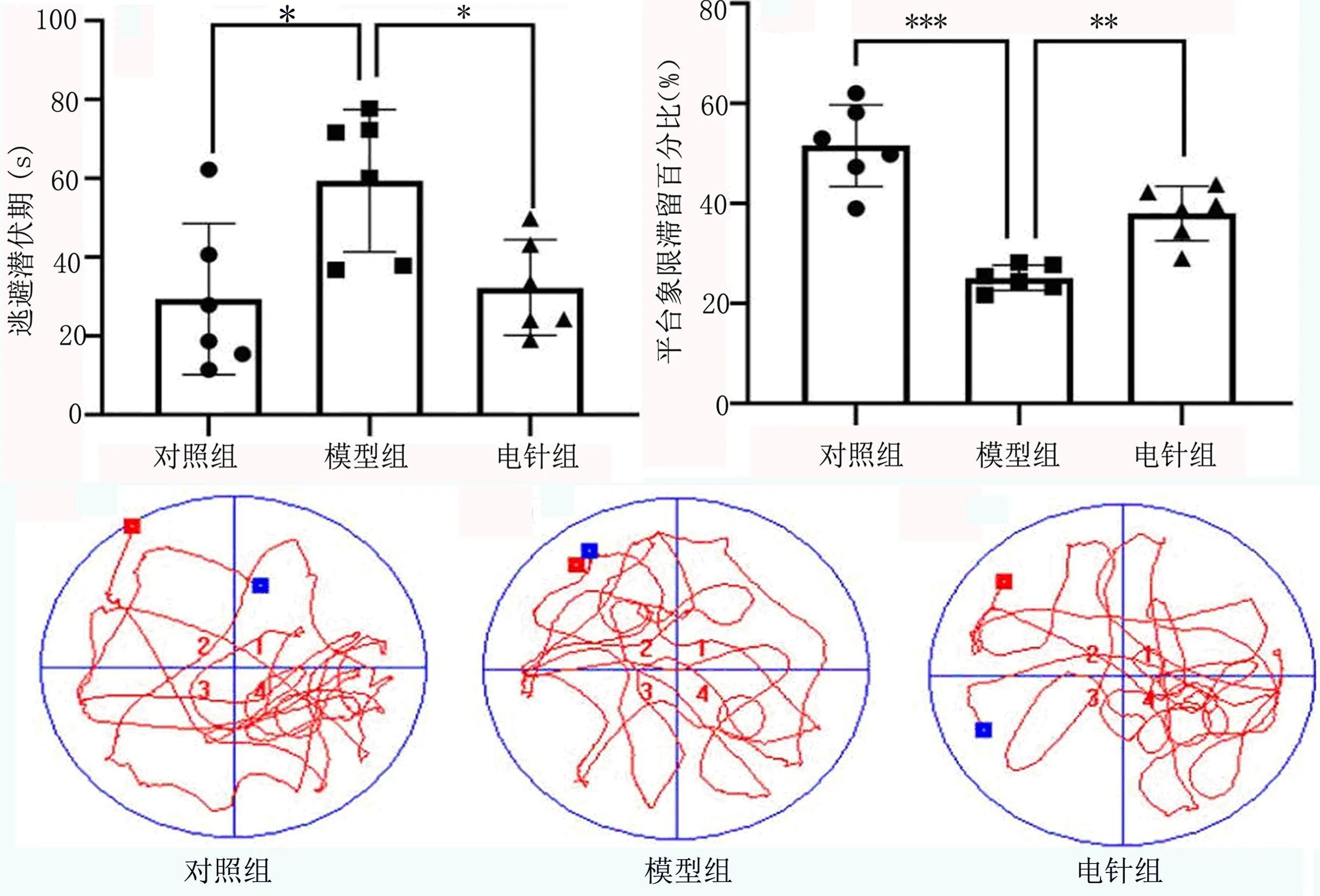
图1 各组大鼠Morris水迷宫逃避潜伏期(s)和平台象限滞留百分比(%)*P<0.05,**P<0.01,***P<0.001
2.2 尼氏染色观察各组大鼠神经元的形态 对照组大鼠海马CA1区神经细胞形态结构完整,细胞核多为圆形或椭圆形且呈淡紫色,核仁清晰可见,尼氏颗粒丰富散布在细胞质中。对于模型组大鼠来说,其细胞形态多呈空泡状,神经元核仁固缩或消失,尼氏颗粒不明显。与模型组相比,电针组海马CA1区的异常形态学变化明显减轻,数目减少明显较少。见图2。

图2 各组大鼠海马CA1区尼氏染色结果 a.对照组 b.模型组 c.电针组
2.3 SIRT1和PGC1-α在各组大鼠海马CA1区表达量的比较 由光学显微镜观察正常大鼠海马的CA1区可发现,其中含有大量的以胞膜呈棕黄色为特征的SIRT1阳性神经元与PGC1-α阳性神经元。对于SIRT1阳性神经元,观察模型组,其SIRT1阳性神经元的数量明显少于对照组(P<0.05),表现为细胞染色变浅,计算其灰度值均数与对照组相比也
有明显的提高(P<0.05);而观察治疗后的电针组,其SIRT1阳性神经元的数量明显多于模型组(P<0.05),免疫组化的染色效果也有一定程度的加深,其平均灰度值较模型组显著降低(P<0.05),对于PGC1-α阳性神经元也有相同的数量、染色效果及平均灰度值的改变。见图3。


图3 各组大鼠海马CA1区SIRT1和PGC1-α的表达(免疫组织化学染色法,×400)与对照组相比,*P<0.05;与模型组相比,#P<0.05
3 讨论
血管性痴呆(VD)的发生比例在逐年上升,慢性脑低灌注被认为是VD的重要危险因素[7]。脑卒中后慢性低灌注会导致脑血流量的下降,导致缺氧后的氧化应激使血管内皮细胞神经细胞等受损,使脑血流量下降进一步加重,这些脑血管病理变化将会导致VD[8]。海马CA1区是人类学习和记忆的重要功能区,慢性脑低灌注时活性氧在脑中积累,导致神经元遭受破坏和中枢胆碱能功能的障碍,从而减少神经元的数量,海马CA1区的功能发生障碍,导致VD患者的学习记忆等认知功能发生障碍[9]。在造模完成后,通过Morris水迷宫行为学测试并统计结果后发现,模型组大鼠的平均逃避潜伏期显著高于对照组,且在撤去平台后,模型组的原平台象限滞留时间百分比远低于对照组。
目前VD的主要治疗方法是西医治疗,通过降低血糖、血压、血脂,保护脑细胞和脑循环等药物进行治疗,并同时戒酒、戒烟,但上述治疗的方法效果均不明显[10]。针疗法是指以毫针刺入腧穴部,使针刺部位产生一定的经气感应后,将强度近似于人体生物电的微量脉冲电流接通在针上,通过针刺与电感双重刺激穴位,使机体的脉络气息得以激发并调整,达到治疗或预防疾病目的的一种方法。百会位于巅顶,是百脉聚会之处,具有醒脑开窍、补脑益智之效;足三里属多气多血之胃经,即可行气血,又可补气血;二穴合用,可行其气,活其血,通督脉,调神志[11]。通过尼氏染色检测海马CA1区神经元的损伤情况显示,与对照组相较,模型组大鼠海马CA1区神经元阳性细胞数量减少,细胞多呈空泡状,神经元核仁明显固缩甚至消失,尼氏颗粒不明显。而与模型组相较,电针组大鼠海马神经元阳性细胞显著提高,细胞空泡状况有所改善,固缩的核仁减少,尼氏颗粒较明显。该结果进一步证实了上述预测的结果。
胆碱能传导通路的受损、炎性因子的过量表达、脂类代谢紊乱、遗传基因表达异常、氧化应激损害等多种机制都可以导致海马CA1区组织的损伤,进而引发VD[12],Sirt1在海马CA1区神经元内的表达是其参与认知功能调节的物质基础,同时也参与调节神经元的分化功能, PGC1-α是在对抗氧化应激中起到关键作用的转录调节因子,能够起到消除自由基,提髙组织抗氧化能力的作用。SIRT1起到类似于一种屏障作用,它将PGC1-α去乙酰化后,有效阻止了蛋白酶体降解PGC1-α,并使靶基因持续产生激活。由此可推断PGC1-α和Sirt1组成一调节系统,用于调节氧化应激导致的损伤反应,在VD恢复的生物学效应中起积极作用。本实验中,通过免疫组化的结果可以发现,与对照组相比,模型组SIRT1和PGC1-α阳性神经元的数量明显下降(P<0.05),通过分析发现,细胞的染色变浅,其平均灰度值与对照组相比也有明显的提高(P<0.05),这与SIRT1通过去乙酰化促进PGC1-α水平这个观点相一致。
VD大鼠海马CA1区SIRT1的表达在电针的作用下可以上调,进而上调其下游的PGC1-α的表达,充分提高脑组织对氧化应激的抵抗反应,阻止血管性痴呆大鼠脑组织被破坏。根据电针组大鼠的免疫组化实验结果,与模型组相比,PGC1-α阳性神经元的数量有所增加(P<0.05),同时可以分析出细胞染色变深,其平均灰度值也有明显的降低(P<0.05),而其SIRT1阳性神经元的数量也多于模型组(P<0.05),细胞染色深,其平均灰度值与模型组相比有明显的降低(P<0.05)这些结果显示通过电针干预疗法可以增加大鼠海马CA1区中SIRT1的表达水平,进而促进了PGC1-α的表达水平,通过以上结果可以推测,通过电针法刺激穴位等一系列效果,使脑组织的抗氧化应激能力得到一定程度的增强,且可以修复由缺血而损伤的神经元。且由实验数据可以表明,电针法的修复作用是由于促进SIRT1的表达效果,进一步增强PGC1-α的表达效应,改善了VD大鼠的学习认知能力及记忆功能,但就其具体通路机制而言,还需进一步研究。
