溶藻弧菌、LPS和Poly I:C对合浦珠母贝几种抗氧化酶活性的影响
2022-02-08翟子钦喻达辉严雪瑜周群玲白丽蓉
翟子钦,喻达辉,梁 霞,王 培,严雪瑜,周群玲,白丽蓉
(1.北部湾大学海洋学院,广西 钦州 535011;2.广西北部湾海洋生物多样性养护重点实验室,广西 钦州 535011;3.钦州市第一人民医院,广西 钦州 535000)
0 引言
合浦珠母贝(pinctadafucata)在中国主要分布在广西、广东以及海南的沿海地区,兼具养殖效益与生态效益。合浦珠母贝属于无脊椎动物,它没有特异性免疫系统,只有非特异性免疫系统[1]。近些年来,随着海洋环境的变化,海水受到不同程度的污染,合浦珠母贝因为病害出现大量死亡。而目前对合浦珠母贝免疫防御机制的研究还比较薄弱。为了探讨病害对合浦珠母贝的影响,提高合浦珠母贝的养殖效率,非常有必要对合浦珠母贝的免疫防御与调控机制进行深入研究。
外源物质主要通过刺激机体产生大量氧自由基来影响抗氧化平衡,从而引起应激反应[2],而抗氧化相关酶是天然免疫的重要效应因子。SOD是一种不可或缺的免疫相关酶,在生物体内是唯一一种以超氧阴离子作为底物的酶[3]。陈萍等[4]研究发现三疣梭子蟹感染溶藻弧菌后,其组织SOD 活性显著降低。王丽等[5]通过对暗纹东方鲀腹腔注射LPS 后发现其肝、肾和鳃3 种免疫器官中的SOD 酶表达水平显著提高。向军喜[6]用Poly I:C 刺激黄姑鱼后发现其肝中总超氧化物歧化酶(T-SOD)活性提高。
CAT 的主要功能是催化功能,它可加快细胞内过氧化氢的分解,防止过多的氧化,从而保护生物体。栗志民等[7]通过不断增加氨氮胁迫浓度,发现马氏珠母贝血清的CAT 活性均表现出先显著升高后下降的趋势。李琼珍等[8]通过对马氏珠母贝限食处理发现其CAT 等酶的活性显著下降,推断限食可以显著地降低插核手术贝的免疫活性。这些研究都说明了CAT 活性与珠母贝免疫功能之间存在相关性。华贵栉孔扇贝被注射溶藻弧菌后血淋巴CAT 的活性有升高趋势[9]。赵永伟等[10]发现,经过LPS 诱导,仔猪肝中的CAT活性显著降低。以上研究表明溶藻弧菌、LPS 等刺激会影响动物CAT 的活性。
T-AOC 可以用于衡量机体的抗氧化酶系统的功能状况,它的大小以及变化规律与生物体的健康密切相关[11]。张博等[12]通过研究发现插核后,合浦珠母贝各组织的T-AOC 与合浦珠母贝的氧化损伤程度相关,基本呈现下降—上升—下降的变化趋势,这说明T-AOC 可以用于衡量合浦珠母贝的抗氧化能力水平。此外,相关研究表明溶藻弧菌、LPS 等会影响动物的T-AOC 活性。张樱等[13]用溶藻弧菌感染三疣梭子蟹,发现T-AOC在血淋巴和肌肉中先升高后下降至正常水平之下,而在肝胰腺中则显著降低。肉鸡在LPS 刺激下其血浆T-AOC 水平极显著降低[14]。
上述研究表明,免疫刺激会引起抗氧化系统的免疫反应。但目前合浦珠母贝抗氧化系统对免疫刺激的免疫反应研究报道较少。为此,本研究通过溶藻弧菌、LPS 和Poly I:C 刺激合浦珠母贝,测定不同时间点SOD、CAT、T-AOC 等免疫相关酶的活性变化情况,分析溶藻弧菌、LPS 和Poly I:C胁迫对合浦珠母贝抗氧化酶活性的影响,探讨免疫刺激对合浦珠母贝非特异性免疫作用的影响,研究结果可为深入研究合浦珠母贝的免疫防御机制提供参考。
1 材料与方法
1.1 实验材料
在广西北海市铁山港养殖区,挑选购买300只外壳完好的二龄合浦珠母贝,于北部湾大学室内养殖系统充气暂养1 周,每天换水1/2,投喂扁藻和小球藻。
1.2 实验设计
随机挑选暂养1 周的合浦珠母贝分为4 组,分别为PBS 组、溶藻弧菌组、LPS 组和Poly I:C组,每组100 只,每组3 个平行。PBS 组合浦珠母贝平均每只注射100 μL 磷酸缓冲盐溶液(pH=6.8),溶藻弧菌组注射 100 μL 弧菌悬液(OD600=0.4),LPS 组注射100 μL LPS 溶液(1×10-3g·L-1),Poly I:C 组注射100 μL Poly I:C 溶液(1×10-3g·L-1),注射部位均为闭壳肌。各组分别在注射后0(未注射)、1 h、3 h、6 h、12 h、24 h、48 h、72 h 和96 h 取血液,每个时间点取8只,液氮速冻,-80 ℃保存备用。
1.3 样品处理及酶活性的测定
从-80 ℃冰箱取出样品,装入离心管后以2 000 r/min 离心10 min,取上清液,4 ℃保存用于酶活测定。SOD、CAT、T-AOC 活性测定均按照南京建成生物研究所研制的试剂盒说明书进行。
1.4 统计分析
利用Excel 和SPSS 22.0 软件处理数据,运用单因素方差分析法和Duncan's 多重比较法进行显著性分析和组间差异比较,*表示该组与对照组差异显著(P<0.05),**表示该组与对照组差异极显著(P<0.01)。
2 实验结果
2.1 溶藻弧菌、LPS 和Poly I:C 对合浦珠母贝SOD 活性影响的实验结果
由图1可知,PBS 组和实验组的SOD 活性均呈先下降后上升的变化趋势。溶藻弧菌组在1 h、6 h、24 h 时,SOD 活性均比PBS 组低,在3 h、12 h、48 h、72 h、96 h 时,SOD 活性均比PBS 组的活性高,其中6 h SOD 的活性显著低于PBS 组,48 h SOD 活性显著高于PBS 组。除24 h 外,LPS组和Poly I:C 组的SOD 的活性均高于PBS 组,其中1 h 和48 h LPS 组的SOD 活性显著高于PBS组,12 h 和48 h Poly I:C 组和PBS 组SOD 活性的差异极显著。

图1 溶藻弧菌、LPS 和Poly I:C 对合浦珠母贝SOD 活性的影响
2.2 溶藻弧菌、LPS 和Poly I:C 对合浦珠母贝CAT 活性影响的实验结果
PBS 组和实验组的CAT 活性均呈现先升高后下降的变化趋势(见图2)。溶藻弧菌组在3 h、6 h、12 h、72 h 时间段的CAT 活性均比PBS 组低,在1 h、24 h、48 h、96 h 时间段均比PBS 组高,其中96 h 的CAT 活性显著高于PBS 组。LPS 组在1 h、6 h、24 h 时间段的CAT 活性均高于PBS组,3 h、12 h、48 h、72 h 和96 h 时间段,LPS 组的CAT 活性均低于PBS 组,但差异均不显著。Poly I:C 组的CAT 活性在24 h、48 h 和96 h 时间段均高于PBS 组,在1 h、3 h、6 h、12 h 和72 h 时间段均低于PBS 组,但差异均不显著。
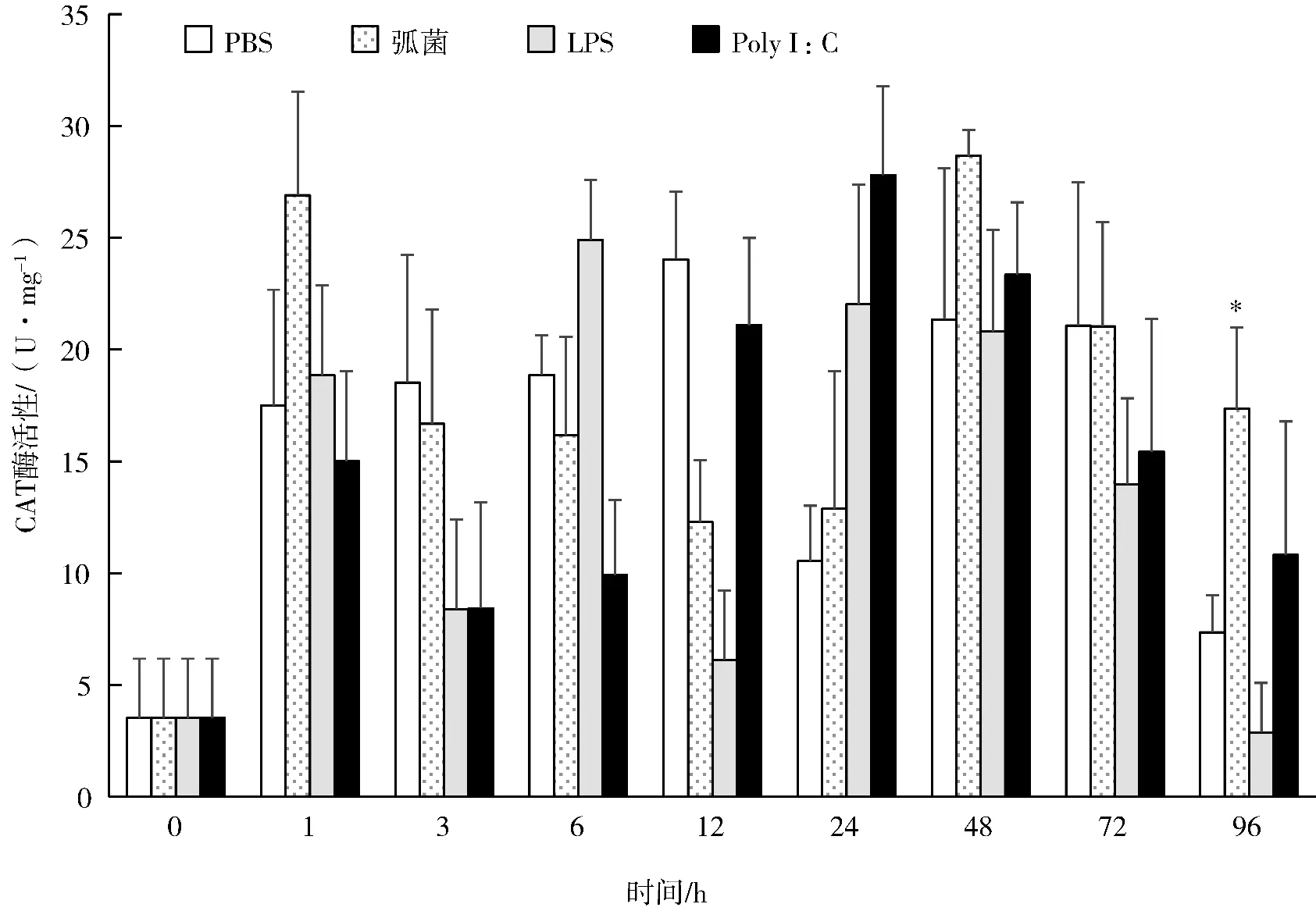
图2 溶藻弧菌、LPS 和Poly I:C 对合浦珠母贝CAT 活性的影响
2.3 溶藻弧菌、LPS 和Poly I:C 对合浦珠母贝T-AOC 活性的影响
实验组和PBS 组在0~96 h 内T-AOC 活性的变化不大(图3)。除96 h 外,溶藻弧菌组的T-AOC 活性均高于0 h 的活性,在12 h、96 h 时间段实验组T-AOC 的活性均比PBS 组高,在3 h、6 h、48 h、72 h 时间段T-AOC 的活性均比PBS 组低,其中12 h T-AOC 的活性显著高于PBS 组。除96 h 外,LPS 组的T-AOC 的活性均低于0 h 的活性,12 h 的T-AOC 活性显著高于PBS 组,3 h、48 h和72 h T-AOC 的活性显著低于PBS 组。除12 h、24 h、96 h 外,Poly I:C 组的T-AOC 的活性均低于0 h 的活性,12 h 和96 h 的T-AOC 的活性均显著高于PBS 组,3 h、48 h T-AOC 活性显著低于PBS 组。
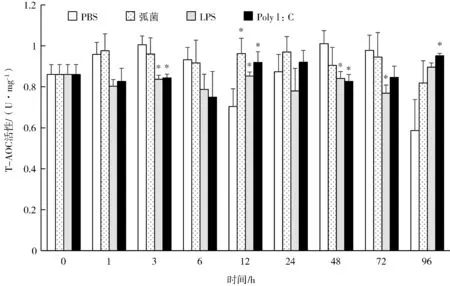
图3 溶藻弧菌、LPS 和Poly I:C 对合浦珠母贝T-AOC 活性的影响
3 讨论
外源物质入侵会刺激动物机体代谢产生大量的氧自由基[15]。氧自由基能够杀死细菌和恶性细胞,增强免疫,但含量过多时会与生物膜不饱和脂肪酸发生反应,造成机体过氧化损伤[16]。同时,机体内存在着抗氧化反应的酶防卫系统,通过清除多余的氧自由基来保护机体[17]。SOD 是生物体抗氧化系统的第一道防线,也是生物体中唯一具有特异性清除氧自由基的抗氧化酶。
3.1 溶藻弧菌、LPS 和Poly I:C 对合浦珠母贝SOD 活性影响的分析
翟秀梅等[18]研究表明感染弧菌会导致凡纳滨对虾的肝胰腺SOD 活性下降。随着中国对虾受鳗弧菌感染的时间延长,其SOD 活性呈先升高后降低的趋势[19]。在本实验中,在注射溶藻弧菌、LPS 和Poly I:C 后,合浦珠母贝的SOD 的活性均先降低后升高,这可能是由于注射外源物质使合浦珠母贝体内产生了大量的氧自由基,消耗了较多的SOD。面对外源胁迫,合浦珠母贝机体表现出积极的反应,为维持机体组织抗氧化水平平衡而引发的应对外界胁迫的生理调节,引发机体SOD 活性代偿性升高,所以SOD活性回升。又因为外源刺激持续存在,但没到完全致死的程度,所以合浦珠母贝的SOD 活性会波动。这与刘亚娟等[20]研究尖吻鲈在氨氮胁迫下的SOD 活性变化所观察到的现象相似。同时也有研究表明,外源刺激会使机体SOD 等活性持续升高或降低。LPS 诱导离体大黄鱼头肾巨噬细胞的SOD 活性显著下降[21]。赵燕静等[22]在低氧环境下给淇河鲫鱼注射Poly I:C 会诱导其肝胰脏的SOD 活性升高。这与本实验研究结果不尽相同,可能是由于实验刺激强度或时间长短、对象的不同所导致的。
3.2 溶藻弧菌、LPS 和Poly I:C 对合浦珠母贝CAT 活性影响的分析
洪婧妮等[23]利用弧菌感染大黄鱼,发现在脾组织中的SOD 酶活性增高而CAT 酶活性降低,这表明生物体内的抗氧化酶防御系统是一个互补的统一整体,它们通过维持酶活性的动态平衡来抵抗外界损害。在本实验中,外源胁迫使合浦珠母贝的活性氧自由基水平升高,SOD 把大量氧自由基转化为过氧化氢和水,诱导CAT 的活性升高,催化过氧化氢分解,从而保护合浦珠母贝。南芝润等[24]研究植物过氧化氢酶时发现,植物在干旱等不利环境条件下,机体受到影响时产生大量氧气,这时通过CAT 发挥作用减少过多氧化来保护生物体,这与本次实验结果相似。之后CAT 活性下降的原因可能是机体CAT 消耗增多,或者过氧化氢减少,产生的CAT 下降,这与周常义等[25]在研究三唑磷对泥蚶急性毒性及血清CAT 酶活性的影响结果相似。
3.3 溶藻弧菌、LPS 和Poly I:C 对合浦珠母贝T-AOC 活性影响的分析
段亚飞等[26-27]研究发现,副溶血弧菌和鳗弧菌感染会导致斑节对虾组织的T-AOC 活性呈先升高后下降的变化趋势。大鼠心肌细胞的T-AOC 活性受LPS 诱导会显著下降[28]。高春生等[29]在水体铜对黄河鲤肝胰脏抗氧化酶活性和总抗氧化能力的影响研究中表明,低浓度Cu2+溶液可增加黄河鲤的T-AOC 活性,高浓度Cu2+溶液会降低T-AOC 活性。这说明外源物质毒害作用较低时,可以诱导机体的积极反应,增加T-AOC活性,但毒害作用太大时就会降低T-AOC 活性。在本次实验时间内,与实验前相比,溶藻弧菌实验组的T-AOC 活性总体升高,说明本实验浓度的溶藻弧菌刺激性较小,可以诱导提高机体的总抗氧化能力;LPS 组和Poly I:C 组的实验浓度相同,但LPS 组的T-AOC 活性总体降低,Poly I:C 组的T-AOC 活性时高时低,开始降低中期又回升,说明本实验浓度的LPS 比Poly I:C 刺激性更大。
4 结论
综上所述,溶藻弧菌、LPS 和Poly I:C 对合浦珠母贝的SOD、CAT、T-AOC 活性有显著影响,随着感染时间的延长会导致免疫酶活性变化,进而影响合浦珠母贝的非特异性免疫系统。合浦珠母贝的SOD、CAT、T-AOC 的活性对入侵机体的溶藻弧菌、LPS 和Poly I:C 反应较为敏感,可以作为免疫反应的生化指标。
