米黑根毛霉α-淀粉酶的定向进化、高效表达及在面包中的应用
2022-02-08王玉川马俊文李延啸刘海杰闫巧娟江正强
王玉川,马俊文,李延啸,刘海杰,闫巧娟,江正强,3
(中国农业大学食品科学与营养工程学院;中国轻工业食品生物工程重点实验室1,北京 100083) (中国农业大学工学院2,北京 100083) (南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心3,南京 210023)
α-淀粉酶(EC 3.2.1.1)能够随机水解淀粉内部的α-1,4-糖苷键,产生葡萄糖、麦芽寡糖和糊精等产物[1]。面包在储存过程中会发生老化导致面包硬化和新鲜风味丧失,通常需要加入一些添加剂来改良面包品质和延缓面包老化[2]。细菌α-淀粉酶较为耐热,在面包加工过程中易过度水解淀粉导致面包瓤发黏。一般真菌α-淀粉酶在中温弱酸条件(30~50 ℃,pH 4.5~5.5)具有高酶活力,适合应用于面包加工中,具有一定耐热性的真菌α-淀粉酶更适合用于面包加工[2]。目前已有许多真菌α-淀粉酶的报道,但产酶水平低和应用效果差仍是限制其在面包中应用的主要问题。如蚜虫假酵母菌(Pseudozymaaphidis)的α-淀粉酶应用于面包加工中,添加量最高达25 000 U/kg,面包的体积没有明显的变化[3];米根霉(Rhizopusoryzae)的α-淀粉酶,高效表达后酶活仅为429 U/mL[4],产酶水平低。
基于定向进化技术对现有α-淀粉酶进行分子改造可有效改善它们的酶学特性。Huang等[5]通过易错PCR对地衣芽孢杆菌(Bacilluslicheniformis)的α-淀粉酶(BLA)进行定向进化提升酶的耐酸性,突变体G81R在酸性pH 4.5下催化效率是野生型的1.4倍。Liu等[6]通过易错PCR对地衣芽孢杆菌的α-淀粉酶(BLA)进行定向进化提升酶的耐酸性,突变体T353I/H400R在酸性pH 4.5下催化效率提高11.3倍。毕赤酵母(Pichiapastoris)作为一种外源蛋白表达系统,具有分泌效率高、产量大和蛋白分离纯化简单等优点[7]。目前已有许多α-淀粉酶表达至毕赤酵母中。嗜碱单胞菌(Alkalimonasamylolytica)α-淀粉酶基因表达至毕赤酵母中,3-L发酵罐培养,毕赤酵母重组酶活力最高为600 U/mL[8]。嗜热杜邦菌(Thermomycesdupontii)的α-淀粉酶成功在毕赤酵母中表达,5 L发酵罐甲醇诱导168 h,酶活高达38 314 U/mL[9]。
米黑根毛霉(Rhizomucormiehei)α-淀粉酶(RmAmy)是一个非Ca2+依赖性α-淀粉酶,最适温度为75 ℃,最适pH为6.0,但在酸性下的酶活力和耐酸性相对较低[10]。本研究利用定向进化技术对RmAmy进行分子改造,以提高该酶在面包中的应用潜力。
1 材料和方法
1.1 材料
1.1.1 试剂
葡萄糖至麦芽五糖标准品纯度≥98%,其余试剂均为分析纯。米黑根毛霉CAU432由本实验室保存。
1.1.2 培养基
台盼蓝初筛固体培养基(g/L):可溶性淀粉10,无氨基酵母氮源13.4,甲醇5,台盼蓝0.1,生物素4×10-4,琼脂15。
酸性台盼蓝初筛固体培养基:台盼蓝初筛固体培养基+100 mmol/L pH 5.0柠檬酸盐缓冲液。
其余培养基参考PichiaFermentation Process Guidelines(Version B,053002,Invitrogen)。
1.2 α-淀粉酶基因随机突变文库的构建
以米黑根毛霉CAU432基因组为模板,设计引物RmAmy-F (GCACAATCGAATTCAAGCCATTGCCACTCGC,EcoRⅠ)和RmAmy-R (GATATGATGCGGCCGCTTAAGCTCTCTGGAAAATAGCG,NotⅠ),将RmAmy编码序列进行易错PCR扩增,构建至载体pPIC9K上。易错PCR(50 μL)体系组成如下:0.2 mmol/L Mn2+、5 mmol/L Mg2+、0.2 mmol/L dGTP和dATP、1.0 mmol/LdCTP和dTTP、0.2 μmol/LRmAmy-F和RmAmy-R、1.25 U Taq DNA polymerase、5 ng重组质粒pPIC9K-RmAmy(实验室保存)[10]。易错PCR条件如下:95 ℃ 5 min;95 ℃ 30 s,53 ℃ 30 s,72 ℃ 90 s,反应循环30次;72 ℃ 10 min。利用琼脂糖凝胶纯化回收易错PCR产物,得到扩增产物mRmAmy。DNA改组参考李一男等[11]的方法进行。
利用限制性内切酶(EcoRⅠ和NotⅠ)酶切随机突变基因,回收酶切产物。EcoRⅠ和NotⅠ酶切pPIC9K载体,回收载体骨架。将酶切产物与载体骨架相连接,利用酚/氯仿/异戊醇纯化,乙醇沉淀得到连接产物,电转法(参考MicroPulserTMElectroporation Apparatus说明)转至大肠杆菌DH 5α中,即为随机突变体表达文库。经菌落PCR验证,选取10个阳性转化子测序。测序结果表明,随机突变文库中碱基突变率约为0.21%,氨基酸突变率约为0.39%。收集随机突变文库所有转化子接入LB培养基中,于37 ℃摇床培养4~5 h,提取质粒和线性化,经乙醇沉淀回收后,电转至毕赤酵母GS115中,并均匀涂布在MD平板培养基上,30 ℃培养72 h。
1.3 RmAmy突变文库筛选和高密度发酵
利用酸性台盼蓝初筛固体培养基(pH 5.0)初筛,具有酶活的菌株在菌落附近呈现清晰透明圈,根据透明圈大小筛选菌株。将初筛产生明显透明圈的毕赤酵母菌株复筛,毕赤酵母菌株培养方法参考赵宁等[12]的方法。初步测定最适pH向酸性方向的突变体为正向突变体。选取正向突变体mRmAmy进行5 L发酵罐发酵,发酵步骤及相关培养基的配置参考PichiaFermentation Process Guidelines(Version B,053002,Invitrogen)。具体操作步骤参考赵宁等[12]的方法,主要分为分批培养,甘油流加培养和甲醇诱导培养3个阶段。分批培养为接种后以30 ℃,pH 4.0和转速600 r/min的条件发酵18~24 h;甘油流加培养是以50%甘油流加,当菌体细胞湿重达到180~220 g/L范围内,停止补料;甲醇诱导培养是以100%甲醇流加进行诱导培养,发酵时间为168 h(30 ℃,pH 6.0,转速800 r/min)。
1.4 突变体mRmAmy纯化
高密度发酵后的发酵液经离心(4 ℃、10 000 r/min和10 min),取20 mL上清液(粗酶液)于磷酸盐缓冲液(pH 8.0)下4 ℃透析12 h后,离心(4 ℃、10 000 r/min和10 min)收集上清液。透析的上清液以0.5 mL/min的流速上样于QSFF柱(20 mmol/L pH 8.0 磷酸盐缓冲液平衡),以20 mmol/L pH 8.0 磷酸盐缓冲液冲洗QSFF柱至OD280小于0.1,将20 mmol/L 磷酸盐缓冲液(150 mmol/L NaCl,pH 8.0)以1.0 mL/min的流速洗脱至OD280<0.1。20 mmol/L 磷酸盐缓冲液(250 mmol/L NaCl,pH 8.0)以1.0 mL/min的流速在KTA蛋白纯化系统进行洗脱,收集具有酶活力的组分,利用SDS-PAGE检测分析。
1.5 α-淀粉酶酶活力和蛋白浓度测定
α-淀粉酶酶活力的测定采用DNS法[13]:将100 μL适当稀释后的酶液(50 mmol/L柠檬酸盐缓冲液,pH 5.0)加入900 μL可溶性淀粉溶液(1.0%,w/v,50 mmol/L 柠檬酸盐缓冲液,pH 5.0)中,混匀后,65 ℃下反应10 min。加入1 mL DNS溶液(1.0%)终止反应,沸水浴10 min,测定OD540下的吸光度值,以葡萄糖为标准。α-淀粉酶的酶活力定义为:在上述反应条件下,每分钟产生1 μmol葡萄糖所需要的酶量定义为1 U。蛋白质浓度测定参考Lowry等[14]的方法,以牛血清蛋白(BSA)为标准品。
1.6 突变体mRmAmy的酶学性质
mRmAmy的最适pH测定按照DNS法在60 ℃下采用6种缓冲体系(50 mmol/L)配制成不同的可溶性淀粉溶液(1%),以酶活力最高点为100%,比较不同缓冲体系中酶活力的差异。缓冲体系分别为:柠檬酸盐缓冲液(pH 3.0~6.0)、醋酸盐缓冲液(pH 4.0~6.0)、磷酸盐缓冲液(pH 6.0~8.0)、MOPS缓冲液(pH 6.5~8.0)、Tris-HCl缓冲液(pH 7.0~9.0)和甘氨酸-NaOH缓冲液(pH 9.0~10.5)。pH稳定性的测定:分别采用不同缓冲体系(50 mmol/L)适当稀释纯酶(蛋白终浓度>1 mg/mL),在50 ℃下水浴30 min后,立即冰水浴30 min,测定酶活,以未处理的纯酶酶活为100%,计算不同pH处理后酶活的差异。
mRmAmy最适温度在pH 5.0(柠檬酸盐缓冲液,50 mmol/L)、30~80 ℃范围内按照DNS法测定,以酶活力最高点为100%,比较不同温度下酶活力的差异。mRmAmy温度稳定性的测定:采用柠檬酸盐缓冲液(50 mmol/L,pH 5.0)适当稀释纯酶(蛋白终质量浓度>1 mg/mL),在不同温度下保温30 min后,立即冰水浴30 min,测定酶活,以未处理的纯酶酶活为100%,计算不同温度处理后酶活的差异。
采用柠檬酸盐缓冲液(50 mmol/L,pH 5.0)配制可溶性淀粉溶液(1%),加入5 U/mL的mRmAmy,在50 ℃下反应12 h,间隔取样(15、30 min,1、2、4、8、12 h),沸水浴5 min灭活。薄层层析TLC以及产物HPLC定量方法参考Wang等[10]的方法。薄层层析TLC条件:吸取适量样品,点样于硅胶板上,在展层剂(正丁醇∶乙酸∶水,2∶1∶1)中展层2次,使用显色剂(甲醇/硫酸,95∶5)完全浸润硅胶板,吹干后在130 ℃烤箱内显色。HPLC条件:氨基色谱柱(5 μm, 4.6×250 mm),柱温45 ℃,流动相为60%乙腈。
1.7 RmAmy三维结构模拟
RmAmy三维结构模拟采用Swiss-Model进行,以米曲霉(Aspergillusoryzae)的Taka α-淀粉酶(PDB code:3kwx.1,序列相似性为47.61%)结构为模板。
1.8 mRmAmy在面包中的应用
700 g高筋小麦粉中加入7 g酵母、378 g水、56 g糖和7 g盐,于搅拌器中低速搅拌和高速搅拌各3 min,加入28 g黄油,再低速搅拌2 min和高速搅拌3 min后。静置10 min,随后分割(150 g/个)室温成型10 min,在38 ℃,80%相对湿度下发酵60 min,最后焙烤20 min(面火180 ℃,底火200 ℃),待面包冷却2 h后测定面包的比容和硬度。分别在水中添加RmAmy和mRmAmy,并搅拌均匀,添加量为1~3 mg/kg(以小麦粉质量计)。
比容测定:采用油菜籽置换法测定面包体积V(mL),天平测定面包质量m(g),比容P=V/m。
硬度测定:将面包中部切成厚度为20 mm的均匀薄片,采用质构仪测定面包芯的硬度(N)。
面包老化测定:将面包置于4 ℃下储藏,测定2 d和4 d的硬度变化。
1.9 数据统计与分析
实验均重复3次,用Excel进行数据统计及分析,利用Origin 2019进行绘图。三维结构中相关氨基酸突变构象变化以及表面电荷分布由Pymol软件进行分析观察,疏水键和氢键由LigPlot+软件进行分析。
2 结果与讨论
2.1 RmAmy随机突变体文库筛选和高密度发酵
经酸性台盼蓝初筛固体培养基(pH 5.0)初步筛选(约为5 000个),大约有25%的突变体在酸性初筛平板中呈现清晰透明圈。选择透明圈较大的菌株接种于50 mL三角瓶中发酵产酶(450个),复筛后发现一株在pH 5.0下具有较高催化活力的突变株,命名为mRmAmy。5-L发酵罐中mRmAmy高密度发酵(摇瓶初始酶活为200 U/mL)如图1所示。随诱导时间增加,α-淀粉酶酶活、蛋白浓度以及菌体湿重呈现增加趋势,SDS-PAGE表明目的条带也逐渐增加。当发酵168 h时,发酵上清液中α-淀粉酶酶活达到最高为11 900 U/mL,蛋白浓度为4.07 mg/mL,菌体湿重最大为408 g/L。mRmAmy在SDS-PAGE上的分子质量与RmAmy一致。高密度发酵的粗酶液经QSFF强阴离子柱一步纯化得到电泳级纯酶,比酶活为3 600 U/mg,纯化倍数为1.23倍,酶活回收率为90.8%。mRmAmy经Endo H去糖基化处理后,mRmAmy呈现单一条带(图2),表明mRmAmy存在糖基化。

α-淀粉酶作为一种重要的工业用酶,产酶水平是其应用的重要指标。mRmAmy高密度产酶水平比RmAmy产酶水平(29 794 U/mL)低,但仍高于大多数α-淀粉酶在毕赤酵母中的表达水平。如嗜碱单胞菌α-淀粉酶基因表达于毕赤酵母中,经3-L发酵罐发酵96 h,酶活仅为600 U/mL[8]。地衣芽胞杆菌α-淀粉酶(BLA)在毕赤酵母中表达,经168 h发酵,酶活最高达900 U/mL[15]。米曲霉(Aspergillusoryzae)α-淀粉酶(AmyA)表达至毕赤酵母中,经72 h发酵后,酶活仅72 U/mL[16]。地衣芽胞杆菌α-淀粉酶(BlAmy)在毕赤酵母中表达,经碳源优化在50-L发酵罐中诱导168 h,酶活最高为11 000 U/mL[17]。mRmAmy经纯化后比酶活(3 600 U/mg)比RmAmy比酶活(3 502 U/mg)略高。mRmAmy比酶活要高于已报道的来源于嗜碱单胞菌(16.6 U/mg)[8]、樟绒枝霉(Malbrancheacinnamomea,1 230 U/mg)[12]和嗜热杜邦菌(2 814 U/mg)[9]的α-淀粉酶。但是低于来源于米曲霉(5 150 U/mg)[16]和毡状地丝霉(Geomycespannorum,9 780 U/mg)[18]的α-淀粉酶。mRmAmy存在糖基化,糖基化现象广泛存在于真核表达系统中,对α-淀粉酶的催化活力、结构完整性和稳定性具有重要作用[19]。

注:1~3分别为粗酶液、纯酶液和纯酶经去糖基化酶处理。图2 α-淀粉酶突变体mRmAmy的SDS-PAGE
2.2 mRmAmy的酶学特性
mRmAmy的最适pH和pH稳定性如图3a和图3b所示。mRmAmy的最适pH为5.0,在pH 4.0~10.0的条件下保温30 min后,能够保持80%以上的酶活力。mRmAmy的最适温度和温度稳定性如图3c所示,mRmAmy的最适温度为65 ℃,在60 ℃下保温30 min,能够保持80%以上的酶活力。
mRmAmy的最适pH相比于RmAmy(pH 6.0)降低1个pH单位,pH稳定性与RmAmy(在pH 4.5~8.0范围内稳定)比,稳定性范围更加广泛,更加耐酸和耐碱。mRmAmy与RmAmy(最适温度75 ℃,在65 ℃以下保持稳定)比,最适温度由75 ℃降低为65 ℃,降低10 ℃,稳定性范围降低了5 ℃。真菌α-淀粉酶的最适pH一般处于弱酸性至中性范围内。mRmAmy最适pH为5.0,与黄曲霉(Aspergillusflavus,pH 5.0)[20]和小孢根霉(Rhizopusmicrosporus,pH 5.0)[21]α-淀粉酶相同。低于来源于米曲霉(pH 5.6)[16]和嗜热杜邦菌(pH 6.5)[9]的α-淀粉酶,高于来源于多变拟青霉(Paecilomycesvariotii,pH 4.0)[22]的α-淀粉酶。mRmAmy的pH稳定范围比大多数真菌来源的α-淀粉酶更为宽泛。如米曲霉α-淀粉酶仅在pH 4.5~6.5之间保持稳定[4],毡状地丝霉α-淀粉酶在pH 5.0~9.0之间保持稳定[23],而嗜热杜邦菌α-淀粉酶在pH 4.5~10.0范围内保持稳定[9]。与真菌来源的α-淀粉酶相比,mRmAmy具有较高的最适温度和良好的热稳定性,其最适温度高于来源于嗜热杜邦菌(60 ℃)[9]和米曲霉(60 ℃)[4]的α-淀粉酶,但低于来源于毡状地丝霉(70 ℃)[18]和帚状曲霉(Aspergilluspenicillioide,80 ℃)[24]的α-淀粉酶。mRmAmy在60 ℃以下保持稳定,最适温度为65 ℃。此外,mRmAmy在较低温度下的酶活高于RmAmy,尤其是在30~50 ℃之间具有更高的酶活力,有利于在烘焙食品加工中的应用。


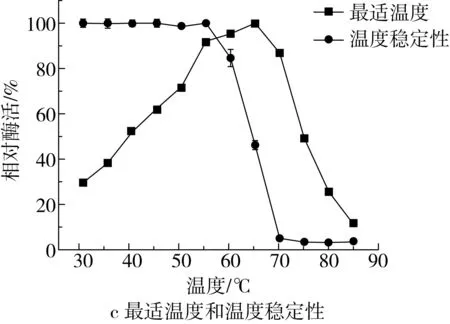
图3 mRmAmy的最适pH、pH稳定性、最适温度和温度稳定性
mRmAmy在pH 5.0和50 ℃下水解可溶性淀粉的产物经薄层层析(TLC)分析,结果如图4所示,mRmAmy保留了野生型RmAmy的优良的水解特性(较高的产麦芽糖能力)[10]。12 h水解产物进行定量分析(表1),mRmAmy水解可溶性淀粉产生的葡萄糖和麦芽糖含量,均高于RmAmy水解的产量,原因可能在于mRmAmy在pH 5.0、50 ℃具有更高的酶活力(图3)。
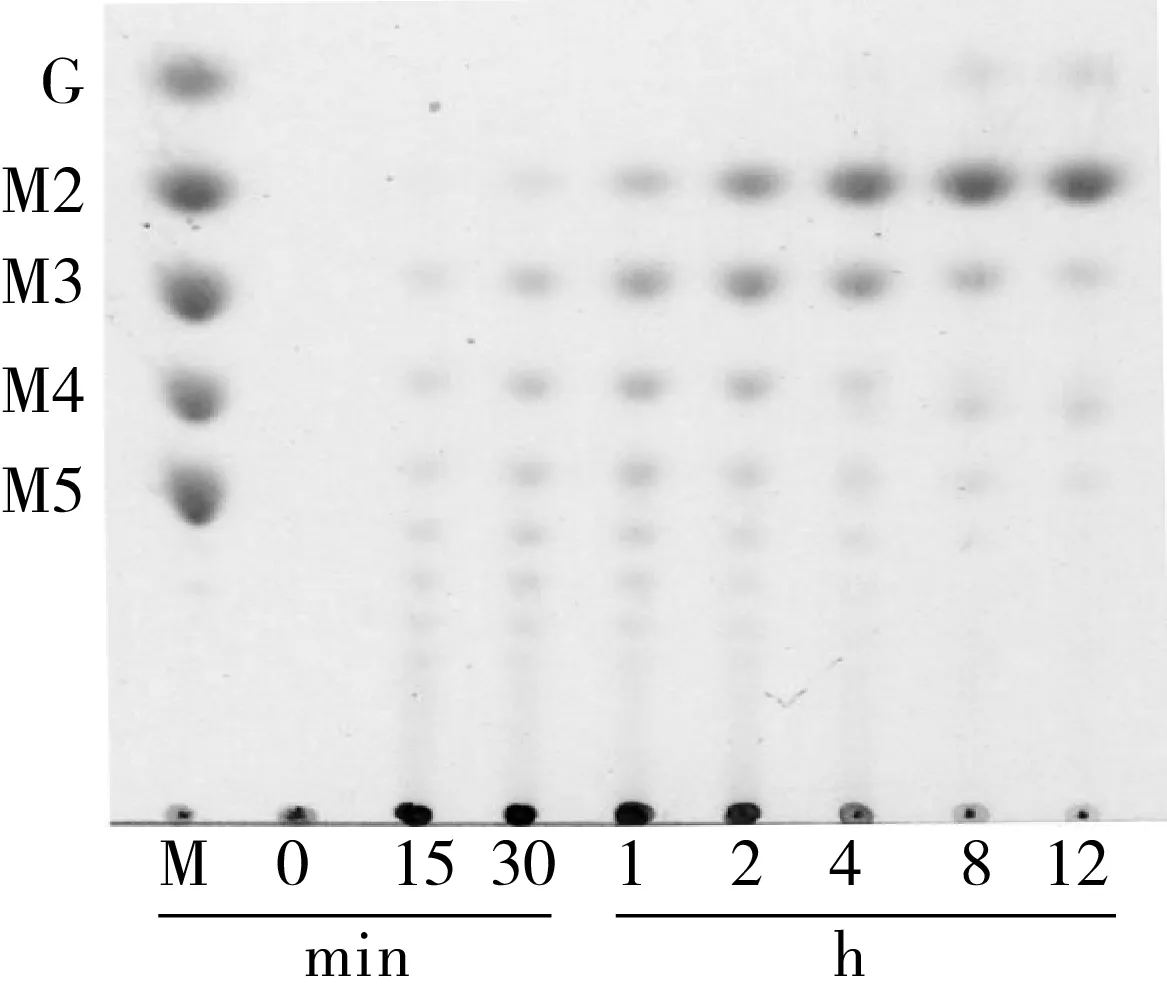
注:G、M2、M3、M4和M5分别为葡萄糖、麦芽糖、麦芽三糖、麦芽四糖和麦芽五糖。图4 α-淀粉酶突变体mRmAmy水解特性
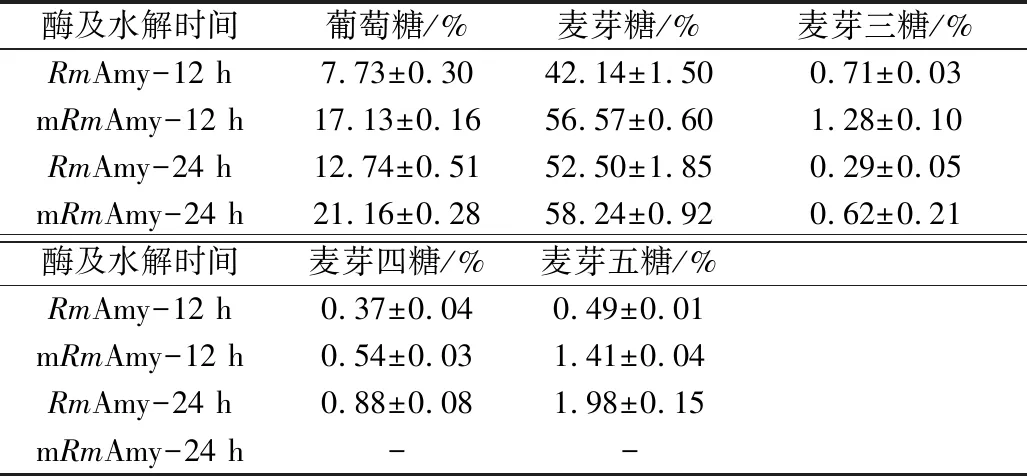
表1 RmAmy及mRmAmy水解可溶性淀粉的产物定量分析
2.3 RmAmy序列以及三维结构分析
经测序,mRmAmy中有3处氨基酸与RmAmy不同,分别为Ser213Phe、Gly226Asp和Ile382Thr。与同源性较高的α-淀粉酶进行多重序列比对发现,Ser213和Ile382为非保守氨基酸,而Gly226为保守氨基酸。
以米曲霉Taka α-淀粉酶(PDB code:3kwx.1,氨基酸同源性为47.61%)结构为模板,经Swiss-Model进行同源结构模拟,得到RmAmy三维模拟结构如图5所示。与GH13家族α-淀粉酶三维结构相似,RmAmy呈现典型的(β/α)8桶结构(TIM桶结构),其中Asp198、Glu222和Asp288为关键催化氨基酸(图5)。标记出3个突变氨基酸(Ser213Phe,Gly226Asp和Ile382Thr)后可以发现突变氨基酸均位于酶分子表面。经过Pymol进行野生型RmAmy与突变体mRmAmy的表面静电分布进行观察,发现突变后,酶分子凹槽右侧的电势由弱正电转化为强负电,而这一变化是由Gly226Asp引起的。

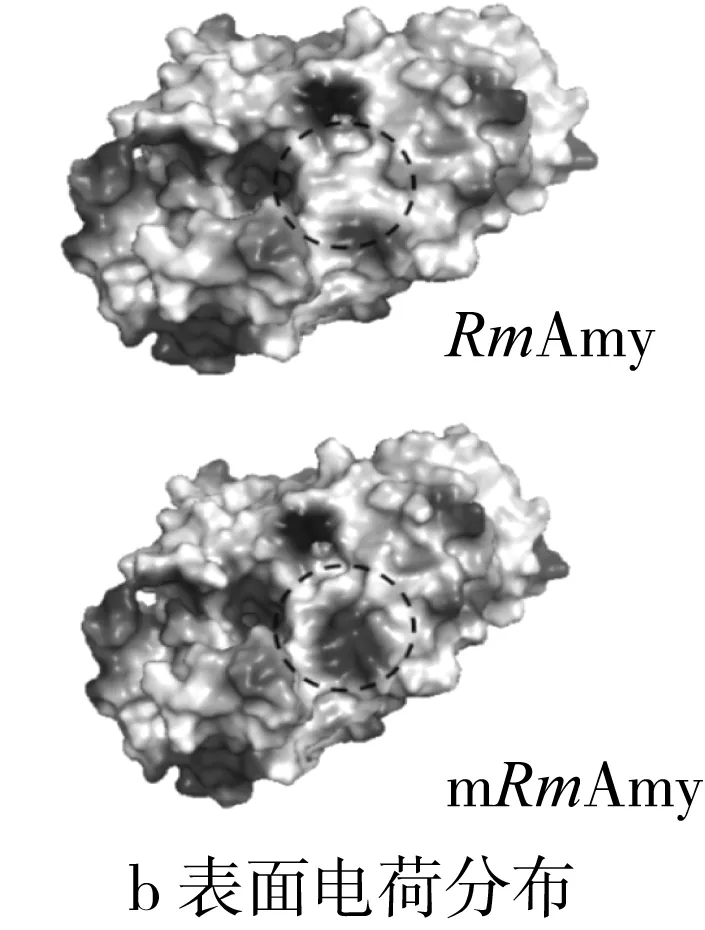

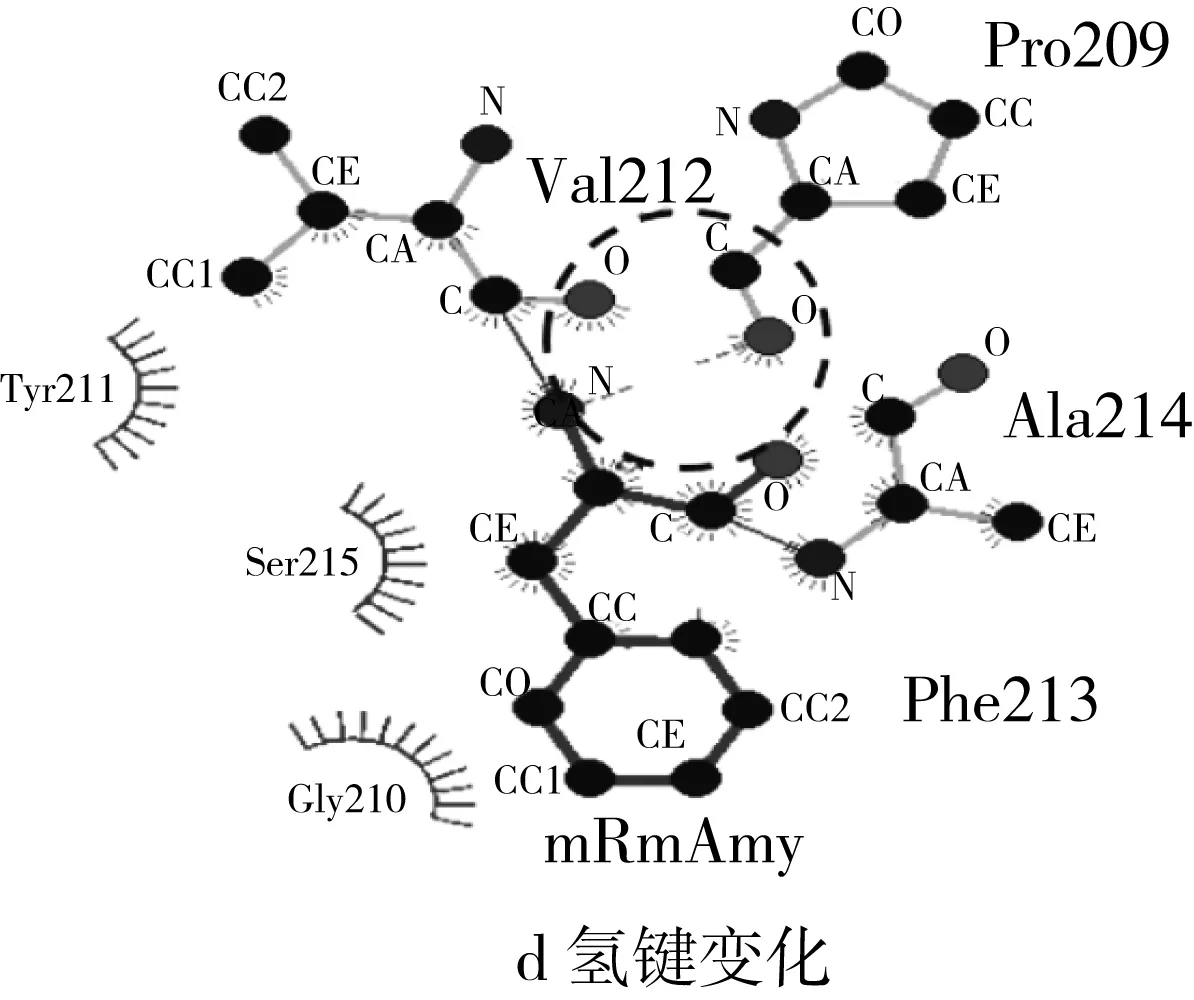
图5 α-淀粉酶RmAmy和mRmAmy结构、表面电荷分布及氢键变化
酶分子稳定性主要受二硫键、氢键、离子键和疏水作用等相互作用力影响。通常,亲水性残基位于蛋白质分子内部不利于蛋白质的稳定性,而疏水性氨基酸在内部取代亲水性残基可能增强蛋白质的稳定性[6]。与蛋白质内部相反,亲水氨基酸取代蛋白质表面的疏水性氨基酸则可能增强蛋白质的稳定性[25]。地衣芽孢杆菌的α-淀粉酶经定向进化改变性质,结果表明Thr353Ile突变体在pH 4.5的催化效率提升3.5倍,原因在于位于分子内部的突变中,Ile具有更高α螺旋倾向性,且为疏水性氨基酸,增强了酶在酸性条件下的稳定性[6]。地衣芽孢杆菌的α-淀粉酶利用定点突变改变酸性稳定性,突变位点Leu134Arg位于酶分子表面,突变之后,由疏水性氨基酸(Leu)转变为亲水性氨基酸(Arg),表面亲水性增强,同时形成新的氢键网络,增强酶蛋白的酸性条件的稳定性[25]。本研究中3个突变氨基酸均位于蛋白表面,观察酶分子表面疏水性变化,其中Gly226Asp和Ile382Thr氨基酸的突变使得酶分子表面亲水性增强,这可能是mRmAmy在酸性条件下稳定性上升的原因,而Ser213Phe使得表面亲水性减弱,可能是mRmAmy热稳定性降低的原因。酶分子催化凹槽附近带电氨基酸的变化可能会影响该酶的最适pH[26],突变体mRmAmy中,226位的Gly突变为Asp,由不带电氨基酸转变为带电氨基酸,改变酶分子凹槽附近的电势平衡,从而改变mRmAmy的最适催化条件。催化区域附近的氢键网络和盐桥对低pH下α-淀粉酶的稳定性有着重要影响[27],由LigPlot+观察突变前后相关氨基酸位点附近氢键作用力的变化(图5c,虚线表示氢键作用力及其距离)。213位氨基酸由Ser突变为Phe后,Ser213-Pro209之间的氢键由2个减少为1个,导致酶分子稳定性改变,这可能是mRmAmy热稳定性降低的原因,而226位与382位氨基酸的变化并未引起氢键数目的变化。
2.4 mRmAmy在面包中的应用
如表2所示,添加1 mg/kg α-淀粉酶,与对照相比,野生型RmAmy并没有明显变化,而突变体mRmAmy比容增加11.9%,硬度减小18.2%。在mRmAmy添加量为3 mg/kg时,面包比容达到最大,比对照增加14.4%,硬度减小25.8%。随着储存时间的增加,面包的硬度也呈现增加趋势。在mRmAmy添加量为3 mg/kg时,面包延缓老化效果最好,储存第4天时,相比于对照硬度减小30.5%。
真菌α-淀粉酶在面包应用已有许多研究报道。如蚜虫假酵母菌(Pseudozymaaphidis)的α-淀粉酶应用于面包中,添加量最高达25 000 U/kg,感官评价随着添加量增而增加,但面包的体积和柔软性没有明显的变化[3]。Shea等[28]研究真菌α-淀粉酶(Grindamyl A 5 000)改善面包品质,添加量为10 mg/kg时,面包比容比对照增大4.5%,硬度降低15.7%。因此,结果表明mRmAmy在烘焙食品加工中具有应用潜力。
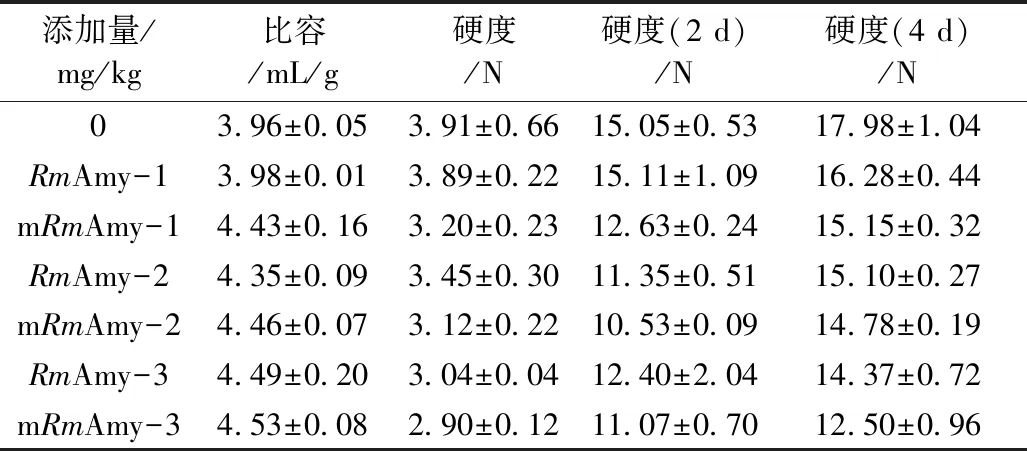
表2 RmAmy及mRmAmy在面包中的应用效果
3 结论
米黑根毛霉的α-淀粉酶经定向进化得到一个最适pH降低的突变酶mRmAmy,高密度发酵后酶活最高达11 900 U/mL。相比于野生型α-淀粉酶,mRmAmy最适pH和温度得到降低,pH稳定范围更广。突变酶应用于面包制作中,能够增加面包比容,减小面包硬度,延缓面包老化。因此,mRmAmy在烘焙领域中具有应用前景。
