基于网络药理学分析北豆根抗阿尔茨海默病的作用机制
2022-02-08孟雪莲刘松瑶薛京苏
孟雪莲,刘松瑶,薛京苏
(辽宁大学 药学院,辽宁 沈阳 110036)
0 引言
老龄化问题已成为全球共性问题,根据中国的人口年龄结构特点,中国社会构成已经符合典型的老龄化社会特点[1].阿尔茨海默病(Alzheimer′s disease,AD)是威胁老年人健康和生命的神经系统疾病之一.全球老龄化问题的加剧,也导致了AD发病率的显著上升.AD的主要临床表现症状为记忆和认知功能损伤,其主要的病理特征为Aβ斑块在大脑皮质、海马等部位的堆积以及神经元中神经原纤维缠结(NFTs)的形成,进一步可引起神经元的损害和死亡[2-6].AD的发病机制复杂多样,目前应用于临床的药物均以延缓疾病进程为主,尚无能终止疾病发展的药物[7].
中医在中国已经发展了两千余年,因其独特的魅力,近年来受到了广泛关注.与西药不同,中药是通过多靶点多途径复合干预,实现对疾病的治疗,不同途径间也可能存在相互影响,以实现对系统和机体的整体调控[8-9].网络药理学是一门新兴学科,它从系统层面揭示药物对机体的整体调控作用,通过特定的数据分析方法寻找不同药效成分的作用靶点和通路,阐释药物对疾病的干预的过程,实现了传统中药研究与现代药理学研究的紧密联系.网络药理学的出现使得新药研发从“一个基因、一种药物、一个疾病”为主导的传统模式转变为“网络靶向、多组分疗法”的新模式[10-12].
北豆根是防己科植物蝙蝠葛(Menispermum dauricum DC.)的干燥根茎,原名蝙蝠葛根,性寒凉,具有清热、解毒、祛风、止痛的功效,对多种炎症具有治疗作用[13-14].北豆根中活性成分众多,其中生物碱类成分含量为1.7%~2.5%,由于其结构的多样性和生物活性的广泛性成为研究的重点[15].北豆根常见的药理作用有抑菌、抗心律失常、降压、抗肿瘤、抗炎等[16-20],近年来有文献报道,北豆根主要成分蝙蝠葛碱具有抗AD作用[21-23].
本研究建立了针对北豆根活性成分抗AD的网络药理学分析方法,寻找其潜在作用靶点和作用通路,通过相关方法分析其可能的作用机制,研究结果具有一定的理论和实际意义.
1 实验方法
1.1 数据库的构建
1.1.1 构建北豆根主要活性成分的相关靶点数据库
在TCMSP数据平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,https://www.tcmspw.com/tcmsp.php)、BATMAN-TCM数据库(http://bionet.ncpsb.org.cn/batman-tcm/)中检索北豆根的有效化学成分,以生物利用度(OB)、类药性(DL)和含量作为条件筛选出研究对象.有效化学成分的2D结构下载自PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/),将其导入SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/)中,选择人类(Homo sapiens)作为研究物种(下述研究过程均选择人类为研究物种),预测得到相关的潜在作用靶点.合并多个化学结构的搜索结果,并去除重复项,输入到string数据库(https://string-db.org/)中,筛选0.95置信区间的靶点,得到北豆根中主要化学成分的相关靶点数据库.
1.1.2 构建AD疾病靶点相关数据库
以“Alzheimer′s disease”为检索词在GeneCards数据库(https://www.genecards.org/)、OMIM数据库(https://omim.org/)中搜索,查找与AD疾病相关的潜在基因靶点.经筛选将疾病靶点输入到string数据库中,设置0.95置信区间,得到AD疾病靶点相关数据库.
1.1.3 构建“药物成分-疾病”交集靶点数据库
将1.1.1构建的北豆根主要化学成分相关靶点数据库和1.1.2构建的AD疾病靶点相关数据库导入到BioVenn软件(http://www.biovenn.nl/index.php)中交互处理,得到“药物成分-疾病”交集靶点数据库.
1.2 构建蛋白相互作用(PPI)网络
将得到的交集靶点导入string数据库,筛选0.95置信区间,以确保数据的可靠性,得到“药物成分-疾病”交集靶点之间的相互作用信息.将相互作用信息导入到Cytoscape 3.7.2软件,进行蛋白靶点间的拓扑分析.
1.3 构建“药物成分-交集靶点-疾病”网络
建立药物成分、交集靶点、AD之间的成分-靶点、靶点-疾病对应关系数据文件和相应的属性文件,采用Cytoscape 3.7.2软件来构建“药物成分-交集靶点-疾病”网络模型图,进一步使用Network Analyzer功能进行拓扑参数分析计算.
1.4 基因本体(GO)富集和京都基因与基因组百科全书(KEGG)通路富集分析
将“药物成分-疾病”交集靶点导入到DAVID数据库(https://david.ncifcrf.gov/)中,并设置Identifier为OFFICIAL GENE SYMBOL、List Type为Gene List,进行GO富集分析和KEGG通路富集分析.筛选P<0.01的通路为可靠通路,利用OmicShare Tools(https://www.omicshare.com/tools/home/index/index.html)可视化研究结果.
1.5 构建“药物成分-交集靶点-作用通路”网络
筛选KEGG分析中的通路,得到关键靶标参与的关键通路.建立药物成分、交集靶点、作用通路、AD之间的成分-靶点、靶点-通路、靶点-疾病对应关系数据文件和相应的属性文件,利用Cytoscape 3.7.2软件构建“药物成分-交集靶点-作用通路”网络模型图,并进行分析.
1.6 分子对接验证
利用Discovery Studio 2016 Client软件对得到的北豆根主要活性成分与筛选得到的关键靶点蛋白进行分子对接验证.
2 实验结果
2.1 数据库的构建
根据筛选标准得到北豆根中7种主要活性成分(见图1),包括蝙蝠葛碱、粉防己碱(双苄基四氢异喹啉类生物碱)、蝙蝠葛啡诺林碱、蝙蝠葛任碱(阿朴啡类生物碱)、蝙蝠葛辛(氧化异阿朴啡类生物碱)、光千金藤碱(原阿朴啡类生物碱)、青藤碱(吗啡烷类生物碱).经SwissTargetPrediction数据库预测和string数据库筛选得到192个北豆根化学成分相关潜在作用靶点.数据库检索AD疾病靶点相关数据库,经筛选最终得到1 106个相关潜在基因靶点.将两者导入BioVenn软件中交互处理,得到92个交集靶点(见图2).

图1 北豆根7种主要活性成分

图2 北豆根7种活性成分相关靶点与阿尔茨海默病相关靶点的交集靶点数
2.2 构建蛋白相互作用(PPI)网络
将2.1得到的92个交集靶点输入到string数据库中,经0.95置信区间筛选,得到85个“药物成分-疾病”交集靶点之间的相互作用信息(见图3).结果表明,src酪氨酸蛋白激酶(sarcomatyrosineprotein kinase,SRC)、信号转导和转录激活蛋白3(signal transducer and activator of transcription3,STAT3)、热休克蛋白90AA1(heat shock protein 90AA1,HSP90AA1)、磷脂酰肌醇3-激酶调节亚基1(phosphatidylinositol 3-kinase regulatory subunit 1,PIK3R1)、磷脂酰肌醇-3-激酶催化亚基α(phosphatidylinositol 3-kinase catalytic subunitalpha,PIK3CA)、蛋白激酶Bα(protein kinase Bα,AKT1)等为度值(Degree)较大的靶点蛋白,可能是关键靶点.

图3 “药物成分-疾病”交集靶点PPI网络图
2.3 构建“药物成分-交集靶点-疾病”网络
利用Cytoscape 3.7.2软件构建“药物成分-交集靶点-疾病”网络模型图(见图4),并进行分析.结果涉及93个节点(包括7个化学成分、85个交集靶点和1个疾病)和278条边,其中脾酪氨酸激酶(spleen tyrosine kinase,SYK)、sigmaR1受体(type 1 sigma receptor,SIGMAR1)、PIK3CA、Janus激酶3(Janus kinase 3,JAK3)、多巴胺D2受体(dopamine receptor D2,DRD2)、集落刺激因子1受体(colony stimulating factor 1 receptor,CSF1R)、AKT1等均为度值较大的靶点蛋白,并能与多个成分相互作用,证明了北豆根中的这7种主要活性成分具有多成分-多靶点共同作用的特点.
2.4 GO富集和KEGG通路富集分析
利用OmicShare Tools进行GO富集分析可视化,设置P<0.01,得到GO功能富集分析图(见图5),涉及53个条目.其中,在生物过程(Biological Process)方面,主要涉及刺激反应(response to stimulus)、细胞过程(cellular process)、代谢过程(metabolic process)、生物过程的调节(regulation of biological process)等;在细胞组分(Cellular Component)中,主要包括细胞器(organelle)、细胞膜(membrane)等;在分子功能(Molecular Function)方面,主要包括结合(binding)、催化活性(catalytic activity)等.

图5 GO功能富集分析图
KEGG通路富集分析得到高级气泡图(见图6).在分析得出的108条潜在作用通路中,具有显著意义的(P<0.01)有90条.结合相关文献,筛选出与AD相关的通路有31条,如血管内皮生长因子(vascular endothelial growth factor,VEGF)、红细胞癌基因B(erythroblastic oncogene B,ErbB)、肿瘤坏死因子、Fc段受体Ⅰ(Fc epsilon receptor Ⅰ,Fcε RI)、低氧诱导因子-1(Hypoxia-inducible factor-1,HIF-1)和凋亡等信号通路,取排名前20的通路形成高级气泡图.提示北豆根可以通过以上多条通路来发挥治疗AD的作用.
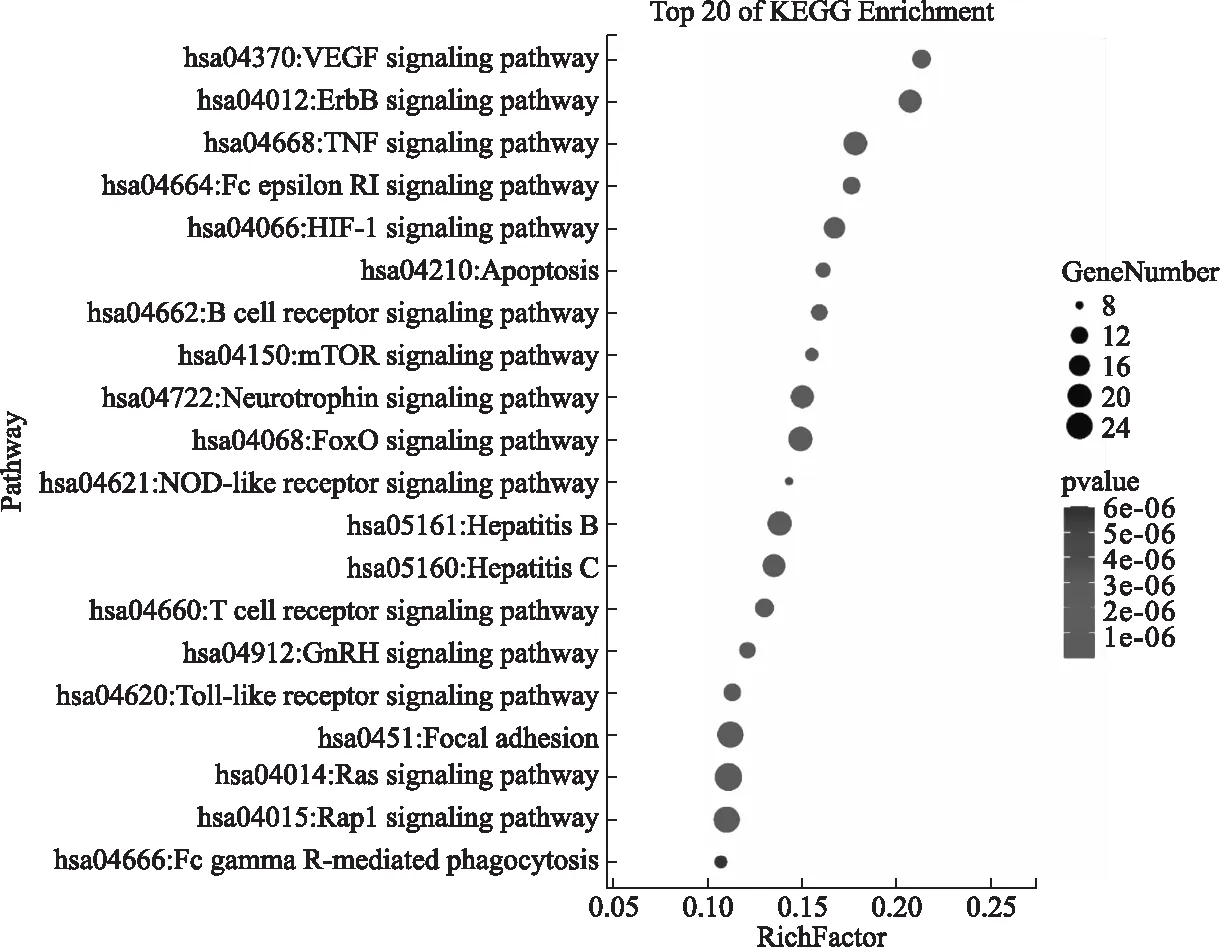
图6 北豆根化学成分抗阿尔茨海默病作用靶点的KEGG富集气泡图
2.5 构建“药物成分-交集靶点-作用通路”网络
通过KEGG分析,最终得到7个活性成分、69个关键核心靶点和31条相关通路.利用Cytoscape 3.7.2软件构建“药物成分-交集靶点-作用通路”网络模型图,分析结果如表1所示.结果涉及108个节点(包括7个化学成分、69个交集靶点、31条通路和1个疾病)和668条边.度值越大表示与之相连的节点越多,即在整个网络中的调控作用越大.结果表明,度值较大的化学成分有粉防己碱(Tetrandrine,29)、蝙蝠葛啡诺林碱(Dauriporphinoline,26)、蝙蝠葛碱(Dauricine,24)等.度值较大的靶点蛋白有AKT1、PIK3CA、磷脂酰肌醇3-激酶催化亚基δ(phosphatidylinositol 3-kinase catalytic subunit delta,PIK3CD)、丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、PIK3R1等,可能是北豆根干预AD疾病发挥作用的靶点.这些靶点涉及的通路有磷脂酰肌醇3激酶-蛋白激酶B(PI3K-Akt)、大鼠肉瘤(Ras)、黏着斑、端粒结合蛋白(Rap1)等信号通路.其中PI3K-Akt通路涉及的靶点数最多(29个),该通路可能是北豆根发挥抗AD作用的关键通路.
2.6 分子对接验证
利用Discovery Studio 2016 Client软件将得到的7个主要活性成分与筛选得到的关键靶点蛋白AKT1、PIK3CA、PIK3CD进行分子对接验证(见表2).LibDockscore代表分子对接的吻合度,分数越高代表配体与受体蛋白结合性越好.结果显示,筛选出来的北豆根的7个主要活性成分都能与AKT1、PIK3CA、PIK3CD蛋白很好地结合,从而在PI3K-Akt通路上发挥作用.分子对接结果与网络药理学筛选结果一致,验证了其可靠性.图7—9为分别与3个蛋白结合性最好的化合物的分子对接结果.

表1 “药物成分-交集靶点-作用通路”网络分析结果
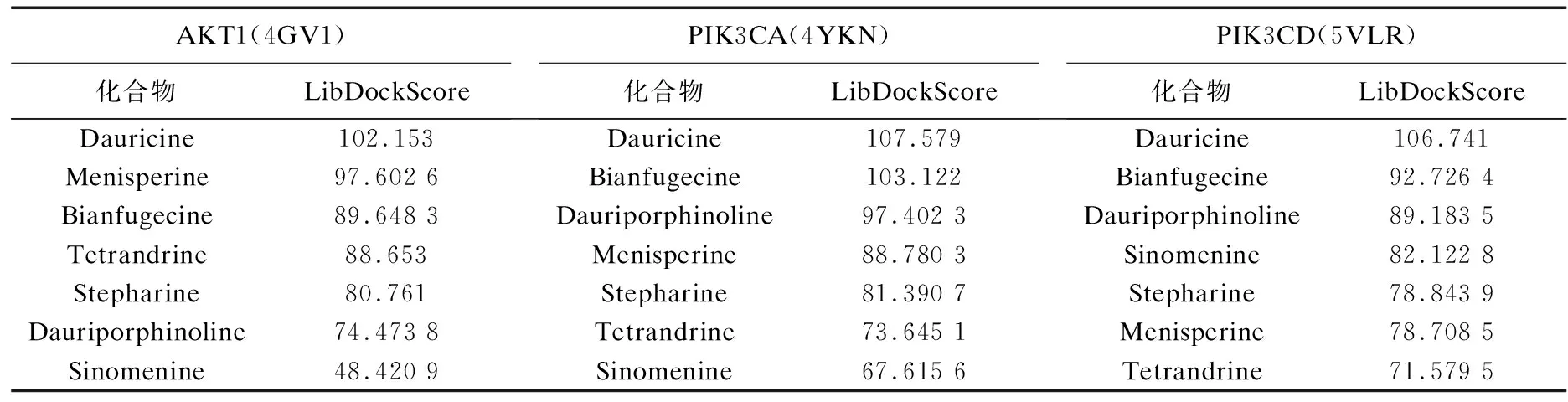
表2 北豆根主要活性成分与关键蛋白的对接结果

图7 Dauricine-PIK3CD分子对接结果
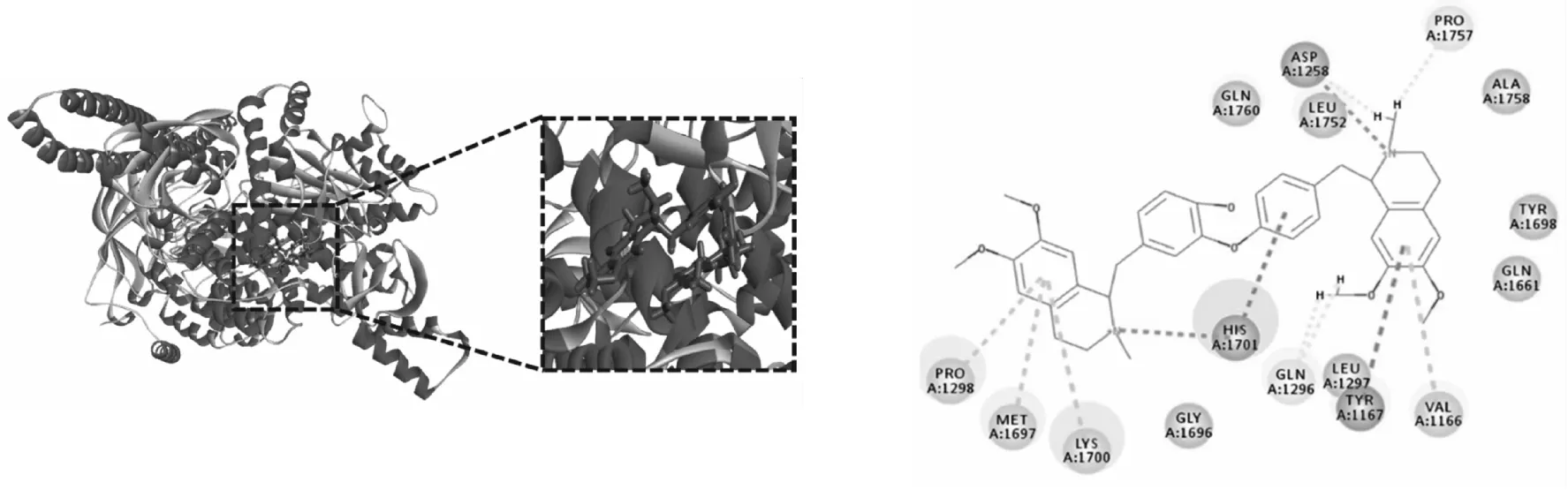
图8 Dauricine-PIK3CA分子对接结果
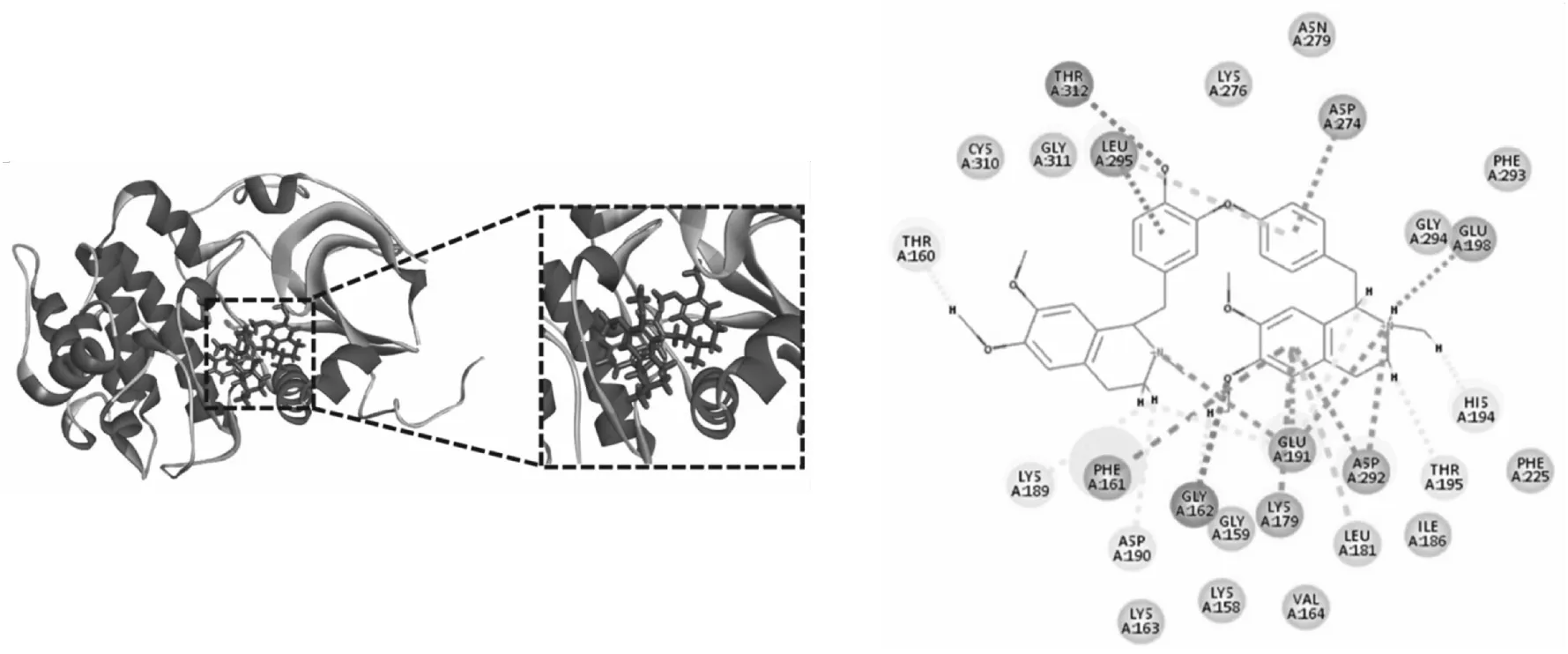
图9 Dauricine-AKT1分子对接结果
3 分析与讨论
本文聚焦当下严重影响老年人身心健康的AD,通过网络药理学分析,研究了北豆根的主要活性成分对该疾病的潜在作用靶点和作用途径,进而研究北豆根化学成分干预AD疾病的作用机制.经筛选得到北豆根7种主要活性成分均为生物碱,揭示北豆根发挥抗AD的主要成分为生物碱类成分.预测该7种主要活性成分潜在作用靶点得到192个,其中与AD相关的靶点有92个,即“药物成分-疾病”交集靶点.构建PPI网络和“药物成分-交集靶点-疾病”网络,结果反映了北豆根主要活性成分与交集靶点在系统水平上的复杂相互作用,表明北豆根干预AD可能是由多种成分调控多个靶点来发挥疗效的.GO富集分析结果表明,北豆根干预AD的相关生物过程涉及刺激反应、代谢过程、对生物反应的调控等.通过KEGG通路富集分析和筛选后,显著作用通路有VEGF、ErbB、TNF、Fc ε RI、HIF-1和凋亡等信号通路,提示北豆根可能通过以上多条通路来发挥防治AD的作用.构建“药物成分-交集靶点-作用通路”网络进一步分析,北豆根7个活性成分与69个AD关键核心靶点相关,并参与31条AD相关信号通路.结果表明,北豆根可能主要通过PI3K-Akt信号通路来发挥抗AD作用,AKT1、PIK3CA、PIK3CD、PIK3R1、IKBKB、GSK3B等可能为北豆根干预AD疾病的关键靶点.
PI3K-Akt通路可以调节细胞的增殖、分化及凋亡等信号转导通路,可以由多种生物因子激活,引发下游一系列信号级联反应,逐步发挥特定的生理反应,调节机体状态[24].Akt是PI3K的重要靶点,能够调控下游相关蛋白[25-26].核因子κB抑制蛋白激酶β(IKBKB)是核因子κB抑制因子(IκB)激酶,Akt可以将IKBKB磷酸化并使之激活,从而使IκB磷酸化,进而使核转录因子核因子κB(NF-κB)与IκB解离开来,恢复其转录活性[27].NF-κB会介导炎性细胞因子如一氧化氮合酶(iNOS)、白介素(IL-1β)、白介素6(IL-6)及肿瘤坏死因子(TNF-α)等的释放,过度的炎性反应会促使AD的发生和发展[28].GSK3B作为Akt的下游底物,能够通过NF-κB信号转导通路增加β-分泌酶(BACE1)介导APP蛋白的剪切,从而增加Aβ的生成和沉积[29];GSK-3β也可以作用于Tau蛋白,经GSK-3β作用后,Tau蛋白可发生过度磷酸化,进而导致神经元中NFTs形成并发生细胞凋亡,该生理过程最终将表现出一系列AD的经典症状[30];同时也能通过调节凋亡蛋白家族Bcl-2等来实现对神经细胞凋亡的调控[31].因此研究PI3K/Akt/GSK-3β信号转导通路具有重要意义,其与AD的高度相关性成为了深入了解AD的成因及拓展AD治疗新方法新思路的关键.
结合PPI和“药物成分-交集靶点-疾病”网络分析结果,SRC、STAT3、HSP90AA1、SIGMAR1、DRD2、JAK3均可能是北豆根中活性成分干预AD的关键靶点蛋白,Ras、Rap1、叉头转录因子(FoxO)、MAPK和TNF等信号通路都可能是其发挥药效的关键通路.表明北豆根干预AD的作用是多成分多靶点综合调控,多信号通路联合作用的结果.
本文的研究结果表明了北豆根干预AD主要通过7种活性成分(蝙蝠葛碱、青藤碱、蝙蝠葛辛、光千金藤碱、蝙蝠葛任碱、蝙蝠葛啡诺林碱、粉防己碱)作用于AKT1、PIK3CA、PIK3CD、PIK3R1等关键靶点蛋白介导PI3K-Akt等信号通路来发挥作用,揭示了北豆根多成分-多靶点-多通路抗AD的作用特点.本研究运用网络药理学方法初步预测了北豆根治疗AD潜在的作用机制,其详细机制仍需进一步的实验验证.本研究可为北豆根及其活性成分抗AD的体内外作用机制研究提供思路.
