核受体因子FTZ-F1在斜纹夜蛾响应虫螨腈及辛硫磷胁迫中的作用机制
2022-02-08刘志翔谭安江
宋 妍,刘志翔,谭安江,2,盛 晟,2,*
(1.江苏科技大学生物技术学院,江苏镇江 212100;2.中国农业科学院蚕业研究所,江苏镇江 212100)
核受体型转录因子是昆虫蜕皮激素信号通路中一类十分重要的转录因子,在昆虫的发育、变态、生殖等方面发挥至关重要的作用(Mangelsdorfetal.,1995)。Fushitarazu factor 1(FTZ-F1)是一种核受体型转录因子,最初从果蝇Drosophila中被鉴定发现(Yuetal.,1997)。FTZ-F1可在昆虫多个组织中作为一个功能因子响应蜕皮激素信号,同时调控下游基因的表达(Choetal.,2014),进而影响昆虫的生长发育。例如,在黑腹果蝇D.melanogaster中沉默DmFTZ-F1会引起果蝇幼虫死亡,同时也会导致果蝇幼虫发生严重的蜕皮缺陷(Sultanetal.,2014)。沉默德国小蠊BlattellagermanicaBgFTZ-F1会导致其发育受阻及蜕皮失败(Cruzetal.,2008),同时还发现,BgFTZ-F1参与了德国小蠊保幼激素的合成(Borras-Castellsetal.,2017)。在家蚕Bombyxmori中,BmFTZ-F1通过结合于表皮蛋白基因BmWCP5特定位点,调控其正常表达,从而参与调控家蚕蜕皮和羽化(Alietal.,2012)。因此,FTZ-F1基因在昆虫的发育过程中发挥极其重要的作用。
有关解毒酶基因在害虫抗药性中的作用机制已有深入研究,但昆虫发育相关基因在害虫耐药性中的作用机制仍较少报道。蜕皮激素信号通路在昆虫生长发育中发挥重要作用,但近年来的研究也发现,该通路中的一些关键基因介导了昆虫耐药性的形成。例如,沉默核受体基因BmHR96后,家蚕幼虫对辛硫磷的敏感性显著上升(Liuetal.,2022);氟啶虫酰胺处理褐飞虱Nilaparvatalugens后,NlUSP,NlE78和NlTLL等7个核受体基因显著上调表达,沉默NlHR3,NlUSP,NlTLL,NlHR83,NlPNR,NlFTZ-F1及NlHR4均能使褐飞虱若虫死亡率升高,表明上述基因在褐飞虱耐受氟啶虫酰胺中可能发挥重要作用(Xuetal.,2017)。
近年研究还发现,FTZ-F1在害虫抗药性形成中发挥重要作用。例如,在小菜蛾Plutellaxylostella中,FTZ-F1通过调控细胞色素P450基因CYP6BG1的表达,使其对氯虫苯甲酰胺产生抗性(Lietal.,2019);FTZ-F1通过调控淡色库蚊Culexpipienspallens表皮蛋白CPLCG5,使其对溴氰菊酯的敏感性上升(Xuetal.,2020)。然而,有关FTZ-F1是否参与昆虫响应农药胁迫的报道仍仅限于个案,亟需在更多物种中加以验证。FTZ-F1如何与昆虫解毒酶基因互作,继而影响昆虫对农药的耐受性也缺乏深入了解。
斜纹夜蛾Spodopteralitura属鳞翅目(Lepidoptera)夜蛾科(Noctuidae),是一种重要的多食性害虫,近年来对桑树的为害也呈逐渐加重的趋势。尽管目前已在斜纹夜蛾中克隆出FTZ-F1基因(Tangetal.,2011),但针对其功能研究尚未系统开展。另一方面,化学防治目前仍然是防治桑树斜纹夜蛾的最主要手段。由于桑园害虫防治独特的用药要求,虫螨腈、辛硫磷等传统药剂仍然是防治桑树斜纹夜蛾的常用药剂,导致斜纹夜蛾对这两种农药的耐受性不断升高(Ahmadetal.,2007;Ahmadetal.,2015),这两种农药对桑树斜纹夜蛾的防治效果越来越差。虽然斜纹夜蛾的抗药性机制研究已十分深入(Lietal.,2021),但FTZ-F1是否在斜纹夜蛾耐受杀虫剂中发挥作用仍不明确。本研究以斜纹夜蛾FTZ-F1为研究对象,旨在探究其是否参与了斜纹夜蛾对桑园常用杀虫剂辛硫磷和虫螨腈的耐受性形成。研究结果有助于深入揭示FTZ-F1在害虫化学农药耐受性中的作用,拓展对害虫耐受化学农药的分子机制的认识。
1 材料与方法
1.1 供试昆虫
供试斜纹夜蛾幼虫已在江苏科技大学生物技术学院桑树保护研究室连续人工饲养40代以上,期间未暴露任何农药处理。饲养环境:温度25℃±1℃,相对湿度50%~70%,光周期14L∶10D。幼虫饲养于透明塑料方盒(长×宽×高=13 cm×13 cm×6 cm)中,喂食人工饲料(Shengetal.,2014)。羽化后,将成虫转移至四壁覆盖透明纱网的产卵笼中(长×宽×高=30 cm×30 cm×60 cm),纱网上涂抹10%蜂蜜水以补充营养,养虫笼中提供一张A4纸作为成虫产卵基质。
1.2 斜纹夜蛾FTZ-F1的生物信息学分析
从GenBank(http:∥www.ncbi.nlm.nih.gov/)下载草地贪夜蛾S.frugiperda、家蚕B.mori、烟草天蛾Manducasexta、甜菜夜蛾Spodopteraexigua等昆虫的FTZ-F1序列作为查询模板,使用BioEdit软件中的tblastn程序,从本课题组前期构建的斜纹夜蛾转录组数据库(NCBI登录号:PRJNA810583)中鉴定斜纹夜蛾FTZ-F1,并使用NCBI的BlastX在线程序对鉴定得到的斜纹夜蛾FTZ-F1进行验证。使用ORF Finder(https:∥www.ncbi.nlm.nih.gov/orfnder/)在线软件预测SlFTZ-F1基因的开放阅读框。等电点(pI)和理论分子量由ExPASy在线软件(https:∥web.expasy.org/compute_pi/)预测。利用DNAMAN 8将斜纹夜蛾FTZ-F1氨基酸序列与其他昆虫物种的FTZ-F1氨基酸序列进行序列比对,使用MEGA 7.0软件以邻接(neighbor-joining)法构建系统发育树(Kumaretal.,2016),各分支置信度经Bootstrap法重复检验1 000次。
1.3 虫螨腈和辛硫磷处理
分别按照亚致死浓度(LC30)的近似整数值配制虫螨腈及辛硫磷供试药液,其中,虫螨腈的浓度为15.0 mg/L,辛硫磷的浓度为50.0 mg/L。采用浸叶法,将半径为2 cm的新鲜圆形桑叶浸没于供试药液中30 s后取出晾干,并分别将其喂食斜纹夜蛾3龄幼虫,以蒸馏水处理作为对照。在杀虫剂处理后1,12,24,36和48 h,分别收集存活的幼虫,-80℃保存备用。
1.4 qRT-PCR检测斜纹夜蛾FTZ-F1基因的表达水平
使用RNAiso Plus (Thermo Scientific,美国)提取1.3节收集的斜纹夜蛾幼虫总RNA,使用NanoDrop2000分光光度计(Thermo Scientific,美国)和1.5%琼脂糖凝胶电泳分别检测总RNA的浓度和完整性;随后,使用PrimeScript®RT试剂盒(TaKaRa,中国)合成cDNA第1链。qRT-PCR反应体系(20 μL):2×iQTMSYBR®Green Ⅰ 10 μL,上下游引物(10 μmol/L)各1 μL,cDNA模板2 μL,RNase-free ddH2O 6 μL。反应程序:95℃ 5 min;95℃ 15 s,60℃ 31 s,40个循环。反应完成后,温度从60℃逐步升至95℃,绘制熔解曲线,以检测是否存在引物二聚体。以斜纹夜蛾磷酸甘油醛脱氢酶基因GAPDH作为内参,目的基因和内参基因的引物见表1。每个处理进行3个生物学重复,每个重复3头幼虫。使用2-ΔΔCt方法计算目的基因的相对表达水平(Livak and Schmittgen,2001)。
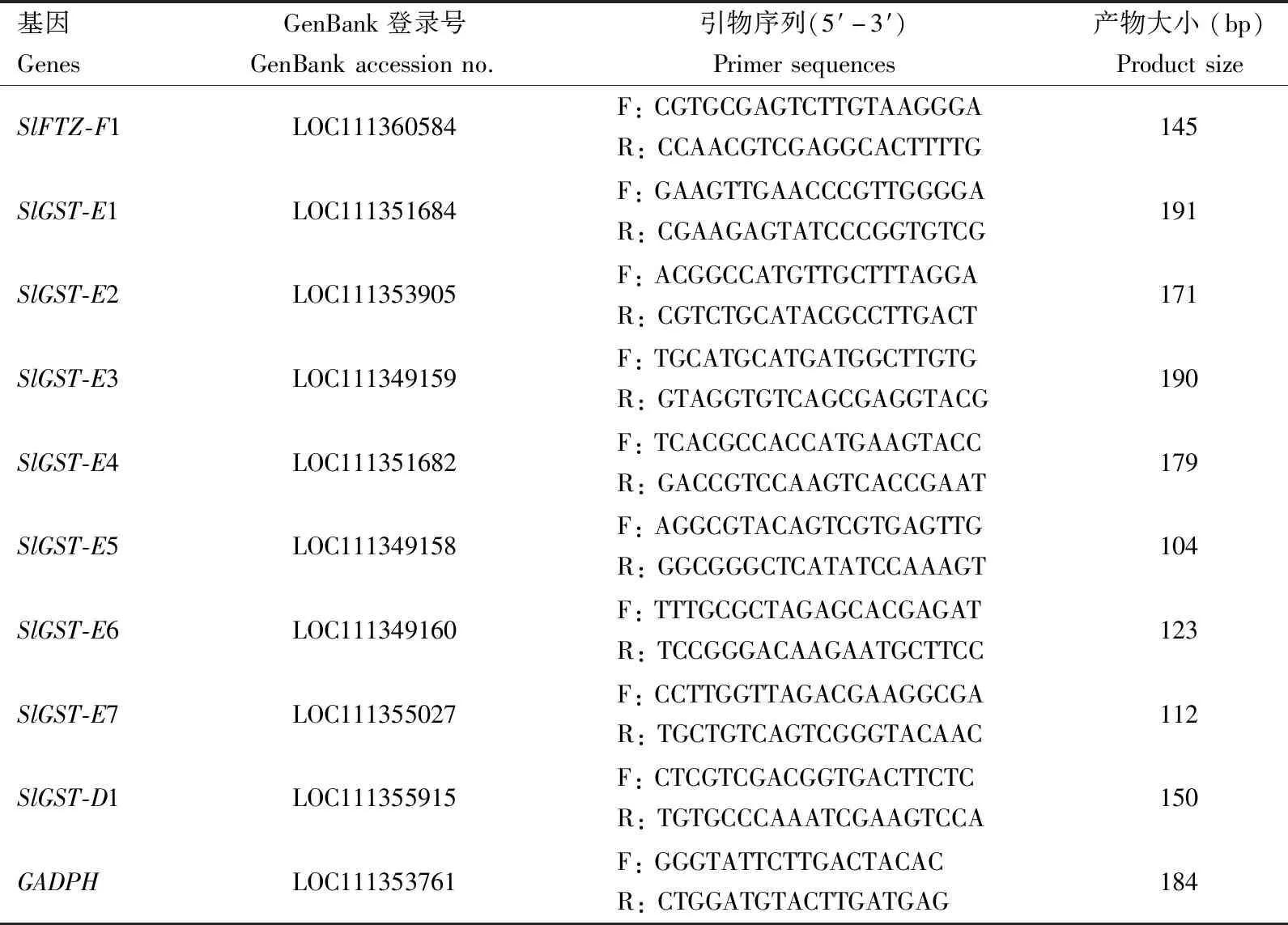
表1 qRT-PCR引物序列Table 1 Primer sequences in qRT-PCR
1.5 dsRNA的合成
利用BLOCK-iTTM RNAi Designer(https:∥rnaidesigner.thermofisher.com/)在线软件设计斜纹夜蛾FTZ-F1基因的5′端含有T7启动子序列的dsRNA引物(表2)。使用invitroTranscription T7 Kit (for siRNA Synthesis)(TaKaRa,中国)体外合成斜纹夜蛾FTZ-F1基因的dsRNA,以合成的绿色荧光蛋白(GFP)基因的dsRNA作为阴性对照。采用NanoDrop 2000分光光度计(Thermo Scientific,美国)测定其浓度和纯度,使用1%琼脂糖凝胶电泳检测合成dsRNA的完整性。使用Nanoject Ⅱ显微注射器(Drummond Scientific,美国)分别将1 μL dsSlFTZ-F1(1 000 ng/μL)或dsGFP(1 000 ng/μL)从斜纹夜蛾3龄幼虫腹部第3节与第4节的节间褶处注射至其体内。注射后24 h和48 h,收集存活的幼虫,提取总RNA,并反转录合成cDNA,利用qRT-PCR技术检测dsRNA注射后斜纹夜蛾FTZ-F1的表达水平,方法同1.4节。每个处理进行3次生物学重复,每个重复3头幼虫。

表2 合成dsRNA所用寡核苷酸序列Table 2 Sequences of oligonucleotides used in dsRNA synthesis
1.6 干扰FTZ-F1后斜纹夜蛾经杀虫剂处理的死亡率测定
收集注射dsSlFTZ-F1 48 h后的斜纹夜蛾3龄幼虫,分别将LC30浓度虫螨腈和辛硫磷处理过的桑叶喂食上述试虫,处理方法同1.3节。喂食后24和48 h记录斜纹夜蛾的死亡情况。以注射dsGFP的斜纹夜蛾幼虫喂食虫螨腈和辛硫磷为对照,每个处理重复3次,每个重复观测10头幼虫。
1.7 干扰斜纹夜蛾FTZ-F1后解毒酶基因表达水平的测定
为探究沉默FTZ-F1对斜纹夜蛾体内主要解毒酶基因表达的影响,选取8个斜纹夜蛾谷胱甘肽S-转移酶SlGST基因(表1),使用qRT-PCR技术检测干扰FTZ-F1后上述SlGST基因的表达水平,qRT-PCR方法同1.4节,所用引物见表1。每个处理进行3次生物学重复,每个重复3头幼虫。
1.8 数据分析
使用R软件(R Core Team,2014)进行数据分析。亚致死浓度虫螨腈和辛硫磷处理斜纹夜蛾3龄幼虫后SlFTZ-F1的相对表达量差异经由单因素方差分析(ANOVA)和Tukey氏测验进行比较,注射dsRNA后不同时间点SlFTZ-F1的相对表达量、被沉默SlFTZ-F1的斜纹夜蛾幼虫取食亚致死浓度虫螨腈和辛硫磷处理的桑叶后的死亡率、沉默SlFTZ-F1后斜纹夜蛾幼虫SlGST基因的相对表达量采用t检验进行差异显著性分析。
2 结果
2.1 SlFTZ-F1基因的序列特征及系统发育
从本课题组前期构建的斜纹夜蛾幼虫转录组(NCBI登录号:PRJNA810583)中鉴定得到一个斜纹夜蛾FTZ-F1基因,并将其命名为SlFTZ-F1(GenBank登录号:LOC111360584),其开放阅读框长1 665 bp,编码555个氨基酸,等电点为6.39,理论分子量61.77 kD。BlastX比对结果表明,SlFTZ-F1与草地贪夜蛾SpodopterafrugiperdaFTZ-F1的氨基酸一致性最高(84.95%)。多序列比对结果表明,SlFTZ-F1与褐飞虱Nilaparvatalugens、埃及伊蚊Aedesaegypti、棉铃虫Helicoverpaarmigera、赤拟谷盗Triboliumcastaneum、西方蜜蜂Apismellifera、草地贪夜蛾S.frugiperda、家蚕B.mori、黑腹果蝇D.melanogaster、甜菜夜蛾S.exigua的FTZ-F1氨基酸序列均具有相似的DNA结合域、FTZ-F1 box及配体结合域(图1)。系统发育树表明,鳞翅目昆虫的FTZ-F1聚为同一个亚支,斜纹夜蛾SlFTZ-F1与草地贪夜蛾SfFTZ-F1聚为一支,家蚕BmFTZ-F1与棉铃虫HaFTZ-F1聚为一支,甜菜夜蛾SeFTZ-F1与烟草天蛾MsFTZ-F1聚为一支,显示出FTZ-F1在鳞翅目物种间保守的亲缘关系(图2)。
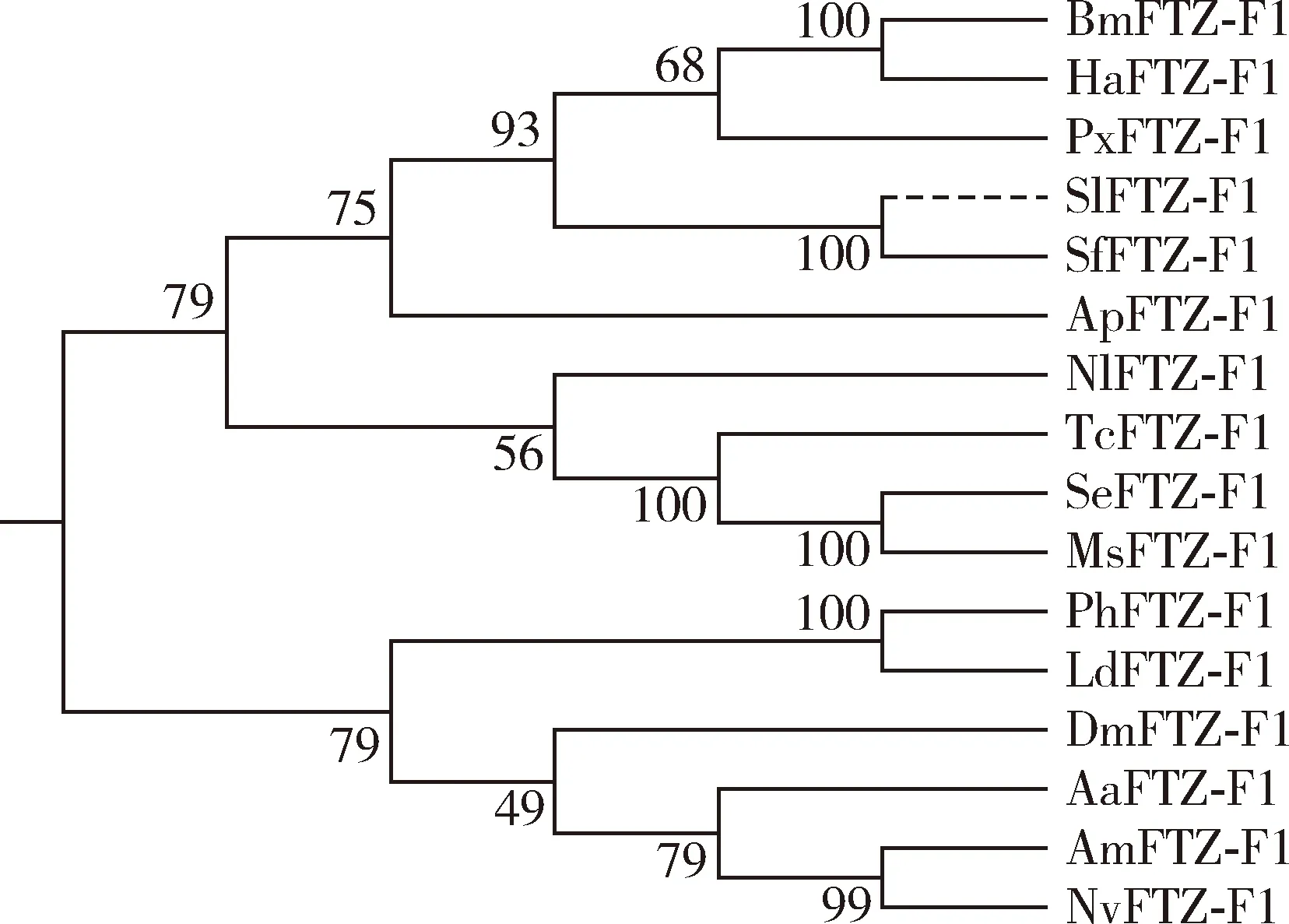
图2 基于氨基酸序列邻接法构建的不同昆虫种转录因子FTZ-F1系统发育树Fig.2 Phylogenetic tree of transcription factor FTZ-F1 in different insect species based on amino acid sequence by the neighbor-joining method蛋白来源物种及其GenBank登录号Origin species of proteins and their GenBank accession numbers:Nl:褐飞虱Nilaparvata lugens,APU50621.1;Aa:埃及伊蚊Aedes aegypti,CAO79104.1;Ha:棉铃虫Helicoverpa armigera,XP_021187002.1;Tc:赤拟谷盗Tribolium castaneum,XP_008191375.1;Am:西方蜜蜂Apis mellifera,XP_006557455.1;Sf:草地贪夜蛾Spodoptera frugiperda,XP_035437309.1;Bm:家蚕Bombyx mori,XP_021205999.1;Dm:黑腹果蝇Drosophila melanogaster,NP_730359.1;Se:甜菜夜蛾Spodoptera exigua,AMP42756.1;Nv:丽蝇蛹集金小蜂Nasonia vitripennis,XP_001600363.2;Ap:豌豆长管蚜Acyrthosiphon pisum,XP_001945464.2;Ph:体虱Pediculus humanus corporis,XP_002430379.1;Ms:烟草天蛾Manduca sexta,AAL50351.1;Px:小菜蛾Plutella xylostella,KAG7313439.1;Ld:马铃薯甲虫Leptinotarsa decemlineata,XP_023015475.1.
2.2 杀虫剂处理后SlFTZ-F1基因的表达模式
亚致死浓度虫螨腈和辛硫磷处理斜纹夜蛾3龄幼虫显著改变SlFTZ-F1的表达水平(图3)。其中,与蒸馏水处理的对照组相比,虫螨腈处理后1,24和36 h,SlFTZ-F1的表达量显著上调(P<0.05);辛硫磷处理后24和36 h,SlFTZ-F1的表达量显著上调(P<0.05)。其余时间点处理组SlFTZ-F1的表达量与对照组相比无显著差异(P>0.05)(图3)。
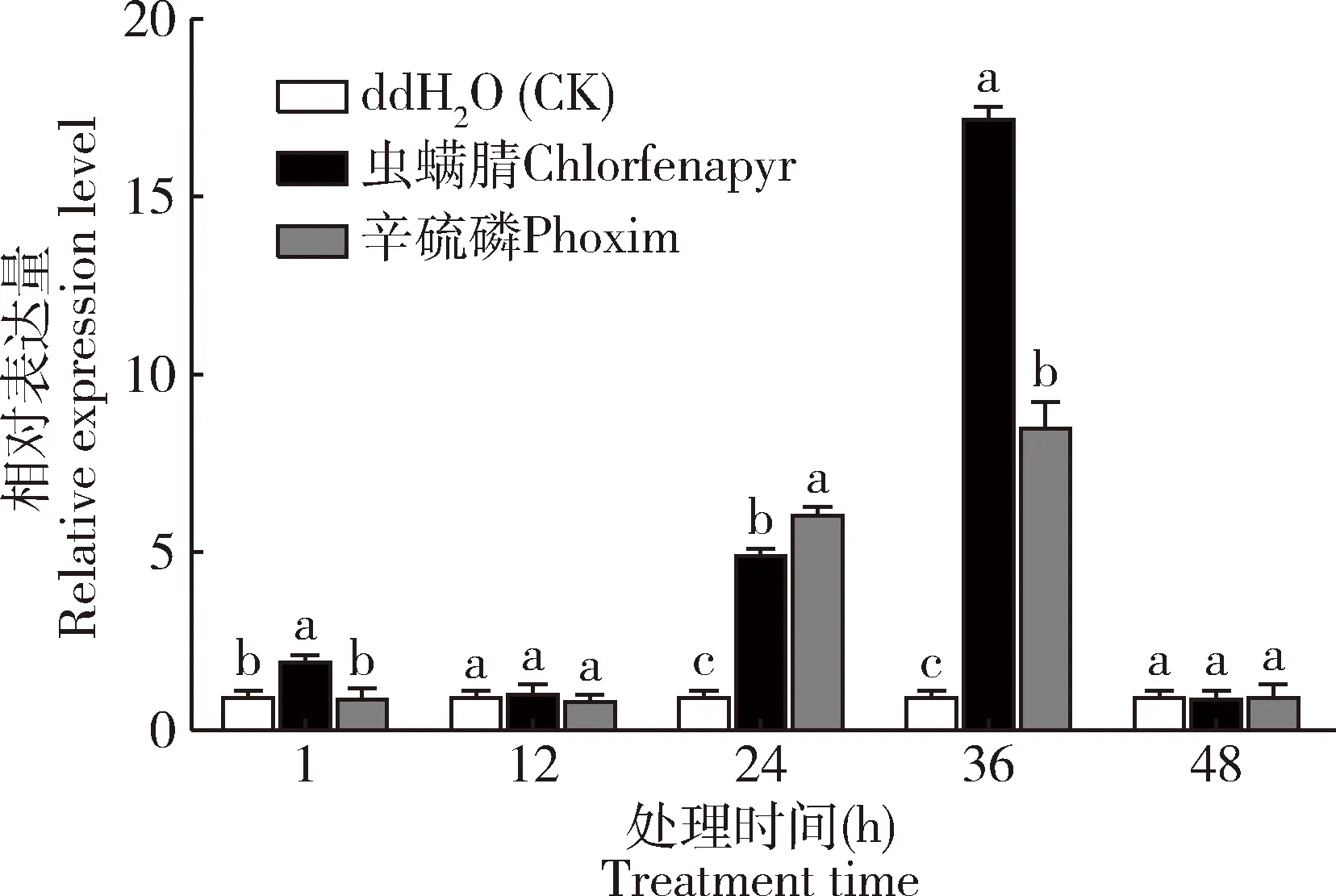
图3 斜纹夜蛾3龄幼虫取食LC30浓度虫螨腈和辛硫磷处理桑叶不同时间后SlFTZ-F1的相对表达量Fig.3 Relative expression levels of SlFTZ-F1 in the 3rd instar larvae of Spodoptera litura after feeding on the mulberry leaves treated with LC30of chlorfenapyr and phoxim at different time points处理组分别饲喂15.0 mg/L虫螨腈和50.0 mg/L辛硫磷浸叶处理的桑叶;对照组饲喂经蒸馏水浸泡并晾干的桑叶。图中数据为3次独立生物学重复的平均值±标准误(n=9);柱上不同小写字母表示同一时间点不同组间基因表达量差异显著(P<0.05,采用单因素方差分析和Tukey氏检验)。The larvae in the treatment groups were fed with the mulberry leaves treated with 15.0 mg/L chlorfenapyr and 50.0 mg/L phoxim,respectively,by leaf dipping method,and those in the control group were fed with the mulberry leaves immersed into distilled water and subsequently airing.Data in the figure are represented as mean±SE of three independent experiments (n=9).Different lowercase letters above bars indicate significant differences in the gene expression level among different groups at the same time point (P<0.05) by one-way ANOVA and Tukey’s test.
2.3 沉默SlFTZ-F1后斜纹夜蛾幼虫对虫螨腈及辛硫磷的敏感性
注射dsSlFTZ-F1后48 h,SlFTZ-F1的表达量与对照组相比极显著降低(P<0.01),而注射dsSlFTZ-F1 24 h时的表达量与对照组相比显著上调(P<0.05)(图4),表明注射dsSlFTZ-F1后48 h时成功敲降了SlFTZ-F1的表达水平。将注射dsSlFTZ-F1后48 h的斜纹夜蛾幼虫暴露于亚致死剂量的虫螨腈和辛硫磷,死亡率统计结果表明,与对照组相比,虫螨腈和辛硫磷处理后48 h时,沉默了SlFTZ-F1的斜纹夜蛾幼虫的死亡率分别显著升高了22%和28%(P<0.05),但两种杀虫剂处理后24 h斜纹夜蛾幼虫的死亡率均未发生显著变化(P>0.05)(图5)。
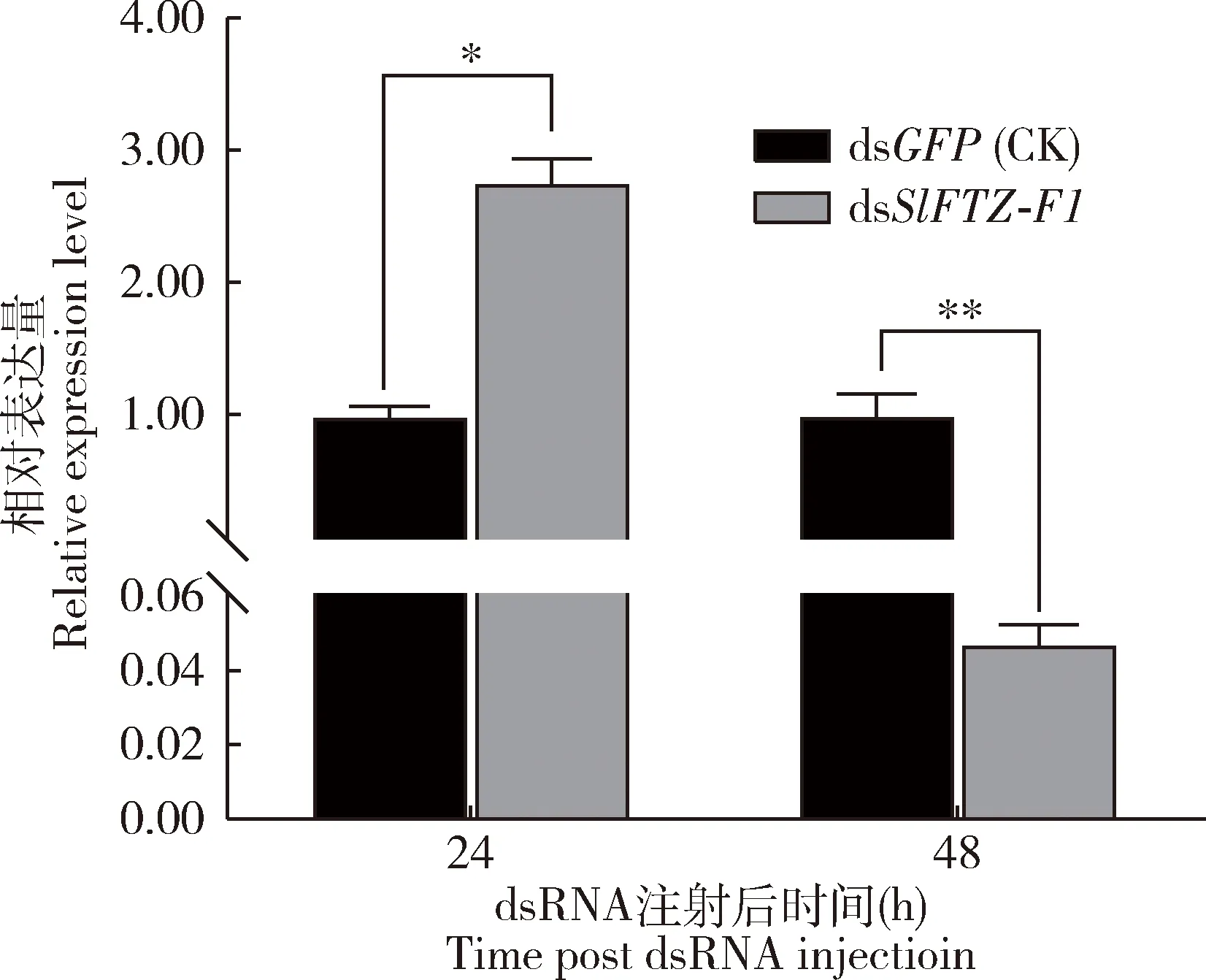
图4 注射dsRNA后不同时间斜纹夜蛾3龄幼虫SlFTZ-F1的相对表达量Fig.4 Relative expression levels of SlFTZ-F1 in the 3rd instar larvae of Spodoptera litura at different time after injection of dsRNA图中数据为3次独立生物学重复的平均值±标准误(n=9);柱上星号和双星号分别表示两组间差异显著(P<0.05)和极显著(P<0.01)(t测验)。Data in the figure are represented as mean±SE of three independent experiments (n=9).The asterisk and double asterisk above bars indicate significant difference (P<0.05) and extremely significant difference (P<0.01),respectively,between the two groups by t-test.
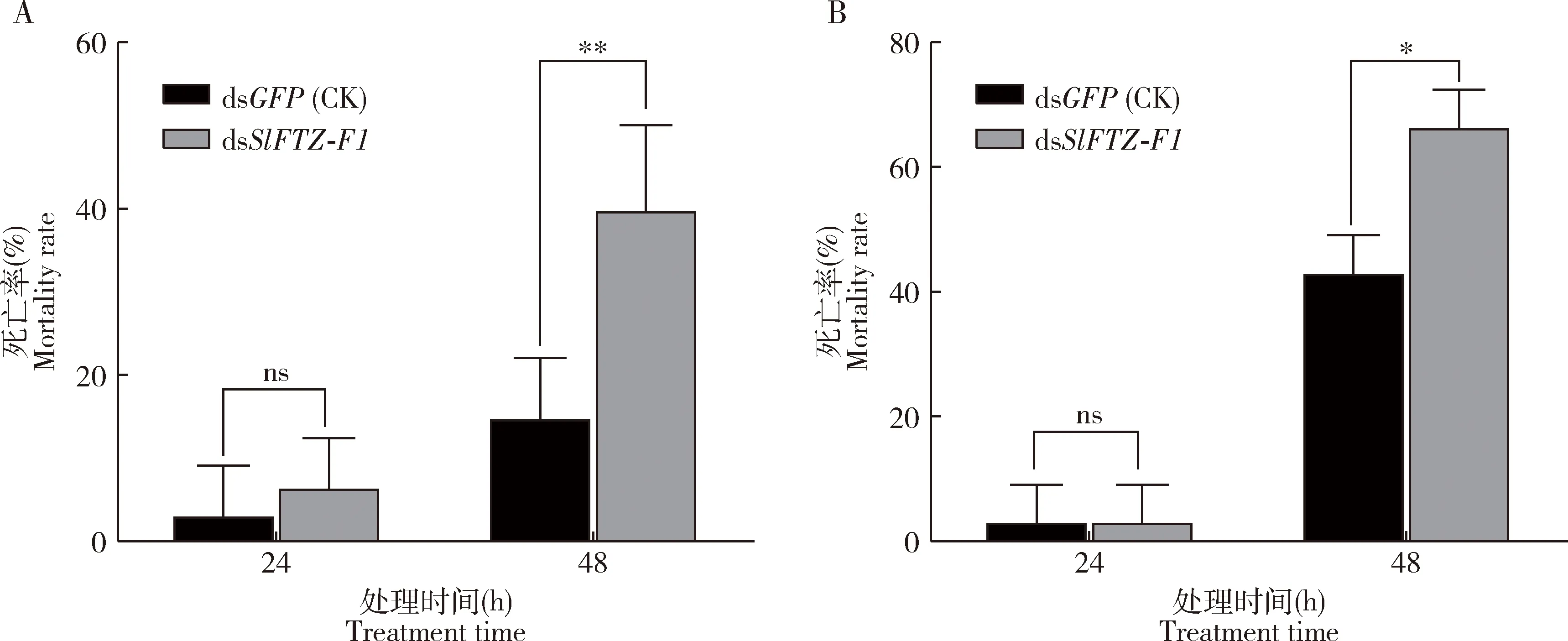
图5 RNAi沉默SlFTZ-F1后取食LC30浓度虫螨腈(A)和辛硫磷(B)浸叶处理的桑叶时斜纹夜蛾幼虫的死亡率Fig.5 Mortality rates of Spodoptera litura larvae feeding on the mulberry leaves treated with LC30 of chlorfenapyr (A) and phoxim by leaf dipping method (B) after silencing SlFTZ-F1 by RNAi图中数据为3次独立生物学重复的平均值±标准误(n=30);柱上星号、双星号和ns分别表示两组间差异显著(P<0.05)、差异极显著(P<0.01)和差异不显著(P>0.05)(t检验)。Data in the figure are represented as mean±SE of three independent experiments (n=30).The asterisk,double asterisk and ns above bars indicate significant difference (P<0.05),extremely significant difference (P<0.01) and no significant difference (P>0.05),respectively,between the two groups (t-test).
2.4 沉默SlFTZ-F1后SlGST基因的表达模式
为探究SlFTZ-F1与斜纹夜蛾主要解毒酶基因的相互关系,本研究测定了沉默斜纹夜蛾3龄幼虫SlFTZ-F1后8个SlGST基因的表达模式。qRT-PCR结果表明,注射dsSlFTZ-F1后48 hSlGST-D1,SlGST-E1,SlGST-E2,SlGST-E3,SlGST-E4,SlGST-E5,SlGST-E6及SlGST-E7的相对表达量与注射dsGFP的对照组相比均显著降低(P<0.05)(图6)。
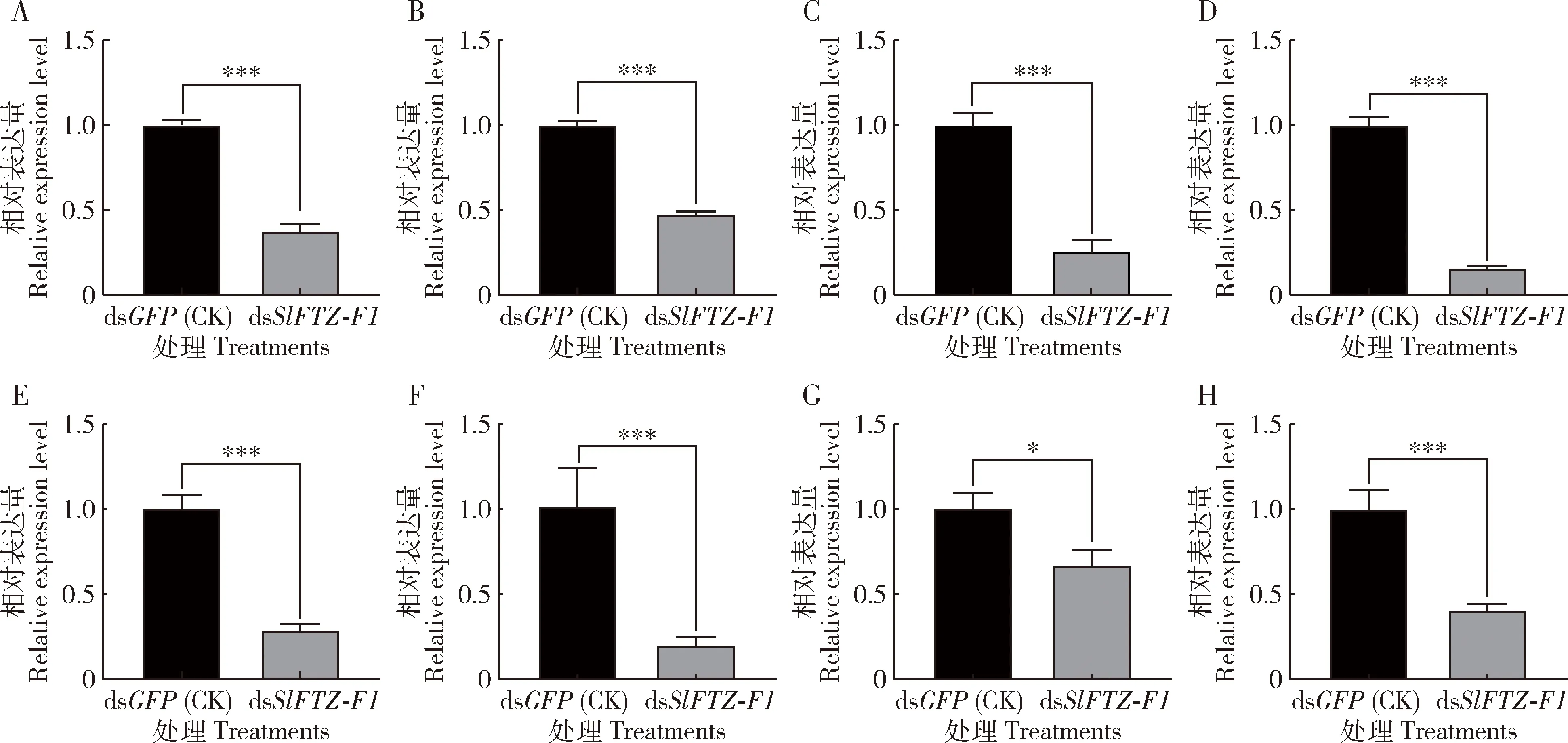
图6 RNAi沉默SlFTZ-F1后斜纹夜蛾3龄幼虫体内SlGST基因的表达量Fig.6 Expression levels of SlGST genes in the 3rd instar larvae of Spodoptera litura after silencing SlFTZ-F1 by RNAiA:SlGST-E1;B:SlGST-E2;C:SlGST-E3;D:SlGST-E4;E:SlGST-E5;F:SlGST-E6;G:SlGST-E7;H:SlGST-D1.RNAi后48 h测定基因表达量。图中数据为3次独立生物学重复的平均值±标准误;柱上星号和三星号分别表示两组间差异显著(P<0.05)和极显著(P<0.001)(t测验)。The expression levels of genes were detected at 48 h after RNAi.Data in the figure are represented as mean±SE of three independent experiments.The asterisk and triple asterisk above bars indicate significant difference (P<0.05) and extremely significant difference (P<0.001),respectively,between the two groups by t-test.
3 讨论
FTZ-F1是一种孤儿核受体型转录因子,在昆虫幼虫至蛹变态过程中响应20E和可能的保幼激素信号,从而调控昆虫的发育过程(Guoetal.,2020)。本研究首先从前期构建的斜纹夜蛾转录组数据库中鉴定得到一个FTZ-F1基因。序列分析表明,SlFTZ-F1与其他物种的FTZ-F1均具有保守的DNA结合结构域、FTZ-F1 box及配体结合结构域。系统发育分析也表明,SlFTZ-F1与其近缘种草地贪夜蛾的FTZ-F1聚在了同一个亚枝(图2),显示了较为保守的亲缘关系。有关FTZ-F1在昆虫蜕皮激素合成及生长发育中的作用机制已有不少研究(Ekokaetal.,2021),但其在昆虫耐受农药胁迫中的作用机制尚不明确。Xu等(2017)发现,NlFTZ-F1在褐飞虱遭受氟啶虫酰胺处理后表达量显著上升。本研究中,在杀虫剂虫螨腈与辛硫磷胁迫后24与36 hSlFTZ-F1的表达量显著高于对照组,表明杀虫剂胁迫处理后可诱导显著SlFTZ-F1上调表达,从而暗示FTZ-F1可能参与了斜纹夜蛾响应这两种常用杀虫剂的生理过程。为深入揭示FTZ-F1在斜纹夜蛾耐受农药中的作用机制,本研究在注射dsSlFTZ-F1后48 h成功沉默了SlFTZ-F1的表达。在此基础上发现,将沉默了SlFTZ-F1的斜纹夜蛾幼虫暴露在亚致死剂量的虫螨腈和辛硫磷后48 h,斜纹夜蛾幼虫的死亡率显著上升,从而表明FTZ-F1在斜纹夜蛾响应常用杀虫剂胁迫中发挥了重要作用。值得注意的是,用两种杀虫剂分别处理被沉默了SlFTZ-F1的斜纹夜蛾幼虫后24 h,试虫的死亡率与对照组相比并无显著差异(图5),表明两种药剂处理被干扰了SlFTZ-F1的斜纹夜蛾幼虫需要经过较长时间才能发挥作用。由于昆虫耐药性与体内复杂的代谢活动密切相关,而FTZ-F1调控的蜕皮激素合成及其相关生理活动也直接影响昆虫代谢活动。因此,本研究中沉默FTZ-F1引起的斜纹夜蛾对虫螨腈和辛硫磷敏感性的增强可能与沉默FTZ-F1后斜纹夜蛾体内代谢活动发生变化有关,在未来的研究中,需进一步对该推论进行研究。
GSTs是一种多功能的代谢解毒酶,在内源性和外源性化合物的解毒过程中发挥着关键作用,也是昆虫产生杀虫剂耐受性的主要原因之一(Liuetal.,2017;Pavlidietal.,2018;Khanetal.,2020)。许多研究已经证实,害虫对杀虫剂的高抗性与GST活性增强或转录水平上升有关。GST基因的过表达是亚洲小车蝗Oedaleusasiaticus对芦丁耐受性增强的重要原因(Wangetal.,2020),扶桑绵粉蚧Phenacoccussolenopsis虫螨腈抗性品系中GST酶活性显著高于敏感品系(Nazaretal.,2020)。在斜纹夜蛾中,GST对其耐受农药的作用机制已得到深入研究(何承帅等,2021;Lietal.,2021),在前期研究中,我们从构建的差异转录组数据库中筛选得到8个上调表达的斜纹夜蛾GST基因,即本研究的8个SlGST基因,且这8个SlGST基因在亚致死剂量虫螨腈和辛硫磷处理后的不同时间点显著上调表达,表明GST基因在斜纹夜蛾幼虫响应这两种杀虫剂胁迫中可能发挥重要作用(另文发表)。尽管如此,转录因子是否调控斜纹夜蛾GST基因的转录水平尚未涉及。
本研究中,通过检测斜纹夜蛾GST基因的表达量发现,在被沉默了SlFTZ-F1的斜纹夜蛾幼虫中,所选的8个GST基因表达量均显著下调(图6),表明SlFTZ-F1可调控斜纹夜蛾GST表达,暗示FTZ-F1可能与GST共同介导了斜纹夜蛾对虫螨腈和辛硫磷的耐受性。类似的有关转录因子通过调控GST基因的表达导致害虫产生抗药性的研究已有不少报道。例如,在马铃薯甲虫L.decemlineata中发现,转录因子CncC调控与溴氰菊酯抗性有关的GST-1等多个解毒酶基因的表达(Kalsi and Palli,2015)。此外,在冈比亚按蚊Anophelesgambiae中,转录因子Maf-S被报道调控P450基因的表达,从而导致按蚊对拟除虫菊酯和DDT的敏感性增加(Inghametal.,2017)。转录因子结合位点的研究对于研究蛋白质与DNA的相互作用具有重要意义。在家蚕中,FTZ-F1与表皮基因WCP5上游的CRE结合来调节其表达(Alietal.,2012)。FTZ-F1还可通过与黑腹果蝇EDG84A基因的两个顺式元件结合来调节EDG84A的表达(Sultanetal.,2014)。最近研究发现,FTZ-F1可以通过结合小菜蛾CYB6PG1的启动子区域来调控CYB6PG1的表达(Lietal.,2019)。因此,在未来的研究中,可深入研究斜纹夜蛾FTZ-F1对GST的结合调控关系,从而深入解析FTZ-F1如何通过与GST互作介导斜纹夜蛾对杀虫剂的耐受性。
综上,本研究发现桑园常用杀虫剂虫螨腈和辛硫磷能显著诱导斜纹夜蛾发育相关的转录因子SlFTZ-F1上调表达,沉默SlFTZ-F1显著降低斜纹夜蛾对两种杀虫剂的耐受性,降低重要解毒酶GST基因的表达水平。本研究获得的结果将拓展对昆虫发育相关的转录因子在害虫耐药性中的作用机制的认识,为斜纹夜蛾的抗性治理提供新思路。
