己糖激酶Ⅱ在乳腺癌中的表达及对细胞增殖能力的影响
2022-02-07王翠瑶单良岳金金庞一心张秀梅
王翠瑶,单良,岳金金,庞一心,张秀梅
(1.锦州医科大学生物化学与分子生物学教研室;2.锦州医科大学附属第一医院检验科,辽宁 锦州 121000)
葡萄糖是正常组织细胞的最重要能源,在细胞内有两条主要的产能途径:无氧氧化和有氧氧化。正常细胞在有氧环境中通常依靠有氧氧化来供能,只有在缺氧条件下以无氧氧化来供能,糖的无氧氧化又称糖酵解,是一条低效的产能途径,因此正常细胞有氧氧化通常抑制无氧氧化,被称为巴斯德效应。但已有研究证实:肿瘤细胞为满足其快速增殖的需要,需要消耗大量的葡萄糖,即使在氧气充足的条件下,也主要依靠无氧氧化供能,这种代谢特征被称为Warburg效应或有氧糖酵解[1]。有氧糖酵解为肿瘤细胞的生长提供以下优势:一是迅速产生能量;二是为肿瘤细胞生物大分子的合成提供原料。有氧糖酵解作为肿瘤标志性特征被广泛接受,目前靶向糖酵解的抗肿瘤药物正在研制中[2]。糖无氧氧化的代谢过程是将葡萄糖经6-磷酸葡萄糖等一系列代谢转变最后生成乳酸。己糖激酶(hexokinase,HK)是糖无氧氧化的第一个关键酶,催化葡萄糖生成6-磷酸葡萄糖的反应。HK 催化的反应中间产物也是调节糖代谢和其他生物合成途径的一个焦点。因此HK成为调节肿瘤生长和转移的重要靶点。目前发现己糖激酶存在4种同工酶(HKⅠ、HKⅡ、HKⅢ和HKⅣ),在这些同工酶中,HKⅡ在多种肿瘤中过量表达,并与不良预后密切相关[3-6]。本研究旨在探讨HKⅡ调控乳腺癌细胞葡萄糖消耗、生长增殖及其在浸润性乳腺导管癌组织样本中的表达情况,并分析其表达水平与预后的相关性,从而为揭示乳腺癌发生、发展的机制并为乳腺癌的临床诊疗提供详实的实验依据。
1 资料与方法
1.1 一般资料
MCF7和MDA-MB-231细胞是本实验室自有细胞,浸润性乳腺导管癌组织芯片(包括138例浸润性乳腺导管癌组织芯片和69例相应的癌旁组织芯片)购自上海芯超公司,并委托上海芯超公司完成免疫组织化学实验及后期统计工作。HKⅡ干扰RNA购自上海吉玛公司,葡萄糖检测试剂盒购自南京建成公司。
1.2 方法
1.2.1 细胞培养、分组及转染
MCF7和MDA-MB-231细胞在RPMI-1640完全培养液中进行传代培养。细胞状态良好时接种于6孔板或12孔板中,待细胞密度至60%~70%开始转染HKⅡ-shRNA和shRNA-control,其序列分别为shRNA-HKⅡ#1:5'-CTGGCTAACTTCATGGATA-3',shRNA-HKⅡ#2:5'-TGAGTTTGACCAGGAGATT-3',shRNA-HKⅡ#3:5'-CTGTGAAGTTGGCCTCATT-3',shRNA-control:5'-TTCTCCGAACGTGTCACGT-3',转染6 h后更换为含有10%胎牛血清和双抗的RPMI-1640完全培养液。
1.2.2 采用Western Blot法检测HKⅡ蛋白的表达水平
转染过程同上,于换液后36 h时弃去培养液收集细胞。采用IP裂解液裂解细胞提取总蛋白,采用BCA蛋白浓度测定试剂盒检测蛋白浓度,蛋白样品加入相应比例的SDS凝胶上样缓冲液 (5×Loading Buffer),煮沸变性5 min,冷却后进行SDS-PAGE电泳,电泳后75 V转膜2.5 h。TBST稍加漂洗PVDF膜后放在封闭液(含5%脱脂奶粉的TBST)中室温封闭1 h,用HKⅡ和Actin抗体4 ℃孵育过夜。TBST洗涤后用二抗室温孵育2 h,TBST洗涤后ECL发光,Western Blot成像系统采集图象。
1.2.3 检测培养液中葡萄糖的浓度
转染过程同上,MCF7和MDA-MB-231转染30 h后收集并更换1次完全培养液,换液6 h后再分别收集培养液,按照试剂盒说明书检测培养液中葡萄糖的浓度。
1.2.4 MTT实验检测细胞增殖情况
将处于对数生长期的细胞以每孔5×103个接种于96孔板中,分组情况同前。待细胞贴壁后,更换新鲜培养液并转染shRNA-HKⅡ。转染72 h后,每孔加入5 g/L的MTT溶液20 μL,37 ℃避光孵育4 h后,弃去液体,每孔再加入150 μL DMSO,震荡2 min使结晶完全溶解后检测490 nm波长处的吸光度(A)值,实验重复3次。细胞增殖抑制率=实验组A490/对照组A490×100%。
1.3 统计学方法

2 结 果
2.1 HKⅡ在浸润性乳腺导管癌组织和癌旁组织中的表达水平
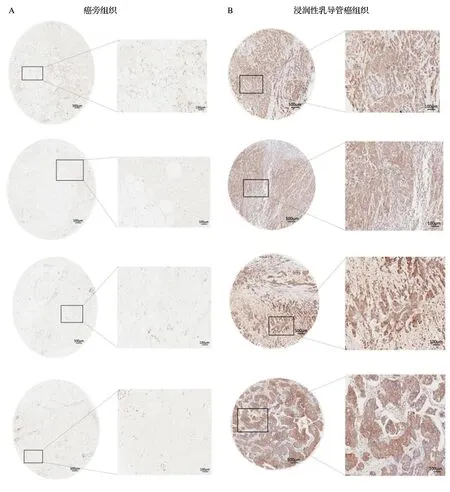
A:HKⅡ在癌旁组织的表达情况;B:HKⅡ在乳腺导管癌中的表达情况

表1 HKⅡ在浸润性乳腺导管癌及癌旁组织中的差异表达(%)
2.2 浸润性乳腺导管癌中HKⅡ的表达水平与临床特征的关系
采用Spearman检验分析138例浸润性乳腺导管癌患者中HKⅡ的表达与浸润性乳腺导管癌患者的年龄、性别、TNM分期、病理分期等临床特征的关系。结果显示HKⅡ的表达与浸润性乳腺导管癌患者的年龄、性别、TNM分期和病理分期均无显著相关性(P>0.05),见表2。

表2 HKⅡ的表达与临床病理特征相关性
2.3 HKⅡ表达水平与乳腺癌患者生存的关系
我们首先在138例浸润性乳腺导管癌患者中进一步分析HKⅡ的表达水平与乳腺癌患者生存的相关性。通过绘制Kaplan-Meier生存曲线和采用Log-rank进行检验后发现,HKⅡ的表达水平与浸润性乳腺导管癌患者的总生存期(P<0.001)显著相关,Kaplan-Meier生存曲线趋势提示HKⅡ高表达的乳腺癌患者生存期低于HKⅡ低表达患者,见图2A。这些结果提示:HKⅡ的表达水平与浸润性乳腺癌患者的预后相关,HKⅡ高表达不利于浸润性乳腺导管癌的预后。接下来我们又进一步对选自KMPLOT 数据库的3951位乳腺癌患者HKⅡ的表达水平与其生存期的相关性进行分析,Kaplan-Meier生存曲线趋势也提示HKⅡ高表达的乳腺癌患者生存期也明显低于HKⅡ低表达患者,见图2B。

A:138例浸润性乳腺癌患者的Kaplan-Meier分析;B:KMPLOT 数据库的3951位乳腺癌患者的Kaplan-Meier分析
2.4 乳腺癌患者生存影响因素
采用Cox比例风险回归模型进行单因素分析后的结果表明:HKⅡ的表达情况影响乳腺癌患者的总生存期,HKⅡ高表达是影响乳腺癌患者总生存期的危险因素。多因素分析显示,HKⅡ的表达水平是影响乳腺癌患者总生存期的独立危险因素,HKⅡ高表达的乳腺癌患者的总生存期(P=0.001;HR=3.333,95%CI:1.630~6.816)较低表达患者更短,见表3。综上所述,HKⅡ高表达提示浸润性乳腺导管癌患者的预后不良。
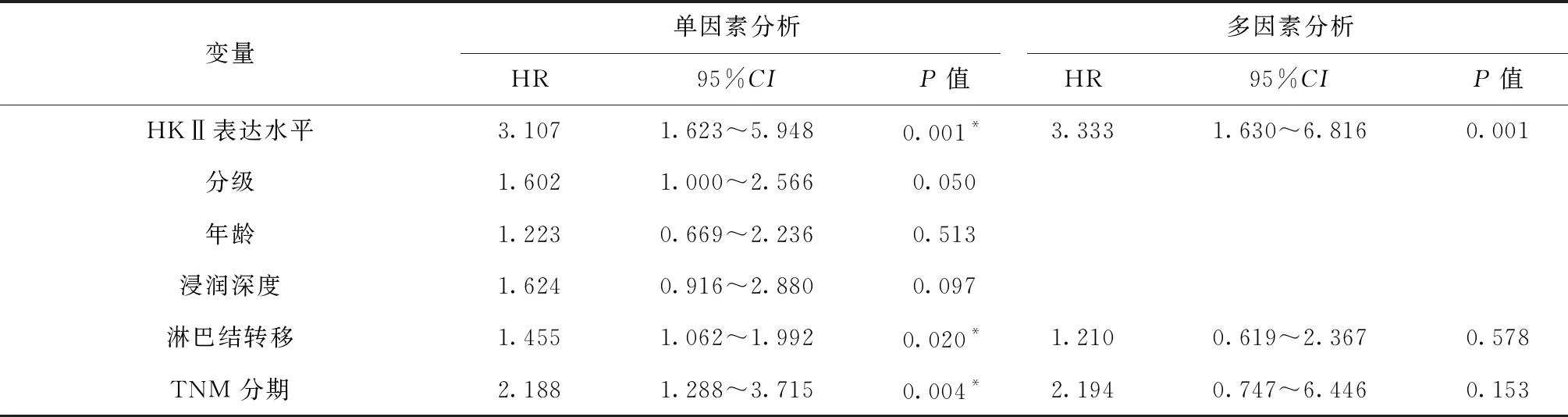
表3 乳腺癌患者总生存期影响因素的比例风险回归模型
2.5 HKⅡ促进乳腺癌细胞葡萄糖消耗和生长增殖
HKⅡ是糖酵解途径的第一个关键酶,催化糖酵解途径的第一步不可逆反应,即将葡萄糖磷酸化生成葡萄糖-6-磷酸,故推测沉默HKⅡ可能影响乳腺癌细胞对葡萄糖的摄取。首先我们采用shRNA-HKⅡ和shRNA-control转染MCF7和MDA-MB-231细胞,并通过Western Blot验证转染效率,见图3A。接下来采用葡萄糖检测试剂盒检测转染后培养液中葡萄糖的浓度,结果显示:沉默HKⅡ后细胞培养液中葡萄糖浓度明显增加,见图3B,这表明HKⅡ促进葡萄糖的摄取。那么HKⅡ是否通过葡萄糖代谢进而影响乳腺癌细胞的生长增殖?我们接下来采用MTT法检测干扰HKⅡ后乳腺癌细胞的增殖情况,结果显示:沉默HKⅡ后,乳腺癌细胞的增殖明显减慢,结果提示:HKⅡ通过促进糖代谢进而促进细胞增殖,见图3C。

A:HKⅡ干扰效率;B:HKⅡ干扰后培养液中葡萄糖的浓度;C:HKⅡ干扰后细胞增殖情况;*P<0.05,#P>0.05
3 讨 论
目前乳腺癌的诊断、治疗和预后虽然已经取得了比较明显的进展,但长期生存率仍不令人满意。因此,发现并深入研究更有效的乳腺癌早期诊断的分子靶标是改善乳腺癌患者生存质量及提高其生存率的关键[7-11]。HKⅡ作为HK组织特异性同工酶亚型之一,是催化糖无氧氧化的第一个关键酶,该酶催化的葡萄糖分解代谢途径中最上游的反应,其活性的增加对于将葡萄糖转移到肿瘤细胞的磷酸戊糖途径等分支途径中至关重要。已有研究证实HKⅡ在多种肿瘤中表达异常升高,葡萄糖无氧氧化的流量亦显著增加[12-13]。肿瘤细胞中过度的无氧氧化产生大量乳酸造成肿瘤微环境的酸化,也是肿瘤进展的关键诱因,HKⅡ过表达可促进糖酵解及肿瘤细胞的生长增殖或侵袭转移过程。本研究发现,在69对乳腺癌病理样本中,浸润性乳腺导管癌患者癌组织中HKⅡ的表达水平明显高于癌旁组织。HKⅡ在浸润性乳腺导管癌中可能是扮演癌基因的角色。同时提示其可能与临床病理特征和预后相关。我们进一步研究发现,HKⅡ的表达水平与浸润性乳腺导管癌患者的生存期存在相关性。单因素生存分析提示,相较于HKⅡ低表达患者,高表达患者总体生存期更短。多因素生存分析提示,HKⅡ高表达是浸润性乳腺导管癌患者的独立危险因素。以上结果为探索浸润性乳腺导管癌的病理机制提供一定参考,也可能为乳腺癌的临床诊断和治疗提供靶点。已有研究证实HKⅡ是喉鳞状细胞癌、多形性胶质母细胞瘤和胃腺癌的潜在预后标志物,与我们的实验结果一致。
已有研究证实HKⅡ高表达与胆囊肿瘤的恶性程度和不良预后显著相关,抑制HKⅡ的表达可显著抑制胆囊癌细胞的增殖、迁移和侵袭,同时大大降低了细胞对葡萄糖消耗和乳酸产量[14]。在肝细胞癌中的研究也发现:敲除HKⅡ可以抑制肝癌细胞的糖酵解水平而促进氧化磷酸化并增加肿瘤细胞对二甲双胍的敏感性[15]。因此本研究在细胞水平探讨HKⅡ对乳腺癌细胞葡萄糖消耗和细胞增殖的影响。我们在MCF7和MDA-MB-231中沉默HKⅡ,结果发现细胞消耗的葡萄糖明显减少,这说明抑制HKⅡ的表达可以抑制糖酵解的流量,减少细胞对葡萄糖的摄取。有研究表明肿瘤细胞通过增加糖酵解的流量为其快速增殖所需的生物大分子的合成提供原料[16-19]。那么在乳腺癌细胞中干扰HKⅡ的表达是否能够抑制细胞增殖?本研究结果显示,在MCF7和MDA-MB-231细胞中干扰HKⅡ的表达显著抑制细胞增殖。因此我们的研究证实在乳腺癌细胞中通过抑制HKⅡ的基因表达抑制了细胞对葡萄糖的摄取,进而抑制乳腺癌细胞的增殖。
综上所述,HKⅡ促进乳腺癌细胞糖酵解及生长增殖,参与乳腺癌的发生发展过程,而且是乳腺癌预后不良的独立危险因素,具体作用机制还需进一步深入研究。总之,通过抑制HKⅡ表达来降低糖酵解水平可为靶向HKⅡ进行乳腺癌治疗提供理论指导。
