EZH2抑制剂EPZ-6438对胃癌细胞侵袭和转移的作用研究
2022-02-07潘浩磊张凯赟李楠张佳博贺武斌
潘浩磊,张凯赟,李楠,张佳博,贺武斌
(1.锦州医科大学第一临床学院;2.锦州医科大学药学院;3.锦州医科大学附属第一医院,辽宁 锦州 121000)
胃癌是十大恶性肿瘤之一,其发病率和死亡率已经跃居第二位[1]。在一些偏远欠发达地区和胃癌早期筛查普及率低的地区,胃癌发病率和死亡率已经超过了肺癌[2]。胃癌由于早期症状不明显不能被早期诊断,往往出现明显症状时到医院诊断已是晚期,导致治愈率大大降低。同时,胃癌患者的生存期由于其术后的复发和转移受到严重制约。因此,侵袭转移也是胃癌治疗的重点和难点,胃癌细胞侵袭转移的大致过程包括上皮间质转化(epithelial-mesenchymal transition,EMT)、伪足形成、促侵袭转移因子分泌等[3]。
EZH2是PcG基因家族中一种果蝇zeste基因增强子(E(z))的人类同源物[4]。研究表明,EZH2过表达于如肺癌、肠癌、多发性骨髓瘤、 头颈部癌等肿瘤组织中,并且与肿瘤的发生发展密切相关[5]。EZH2的高表达能增加胃癌细胞的增殖和抗凋亡能力[6]。EPZ-6438作为一种有效的选择性EZH2抑制剂,能抑制野生型和突变型EZH2,有研究报道,EZH2抑制剂能通过抑制EZH2来抑制肿瘤细胞的增殖[7]。在结直肠癌中,EZH2抑制剂EPZ-6438通过抑制EZH2介导的STAT3启动子上的H3K27me3水平,抑制结直肠癌细胞的增殖[8]。GSK126 通过阻断Wnt/β-连环蛋白途径抑制干细胞样骨髓瘤细胞的增殖,并通过在异种移植小鼠模型中使用RPMI8226细胞证实GSK126的体内抗肿瘤作用[9]。由于EZH2抑制剂的研究多是围绕EZH2来展开研究的,其非抑制EZH2方面的研究报道较少。因此,我们用EZH2抑制剂EPZ-6438来研究其对胃癌细胞的侵袭和转移,并初步从EMT的角度解释其作用机制。
1 材料与方法
1.1 实验材料与试剂
人胃癌细胞株HGC-27、MKN-28、MGC-803、MKN-45、AGS细胞购自中国科学院上海细胞库,胎牛血清、胰酶、1640培养基(Gibco公司,美国),EPZ-6438(纯度:99.84%,selleck,美国),8 μm孔径Transwell培养小室、基质胶(美国康宁公司),DMSO(二甲基亚砜)购自天津佰伦斯生物科技有限公司,E-cadherin、N-cadherin、Vimentin、MMP-2、MMP-9和β-actin抗体(CST,美国),辣根标记的二抗(中国中杉金桥公司)。
1.2 实验方法
1.2.1 细胞培养
HGC-27、MKN-28、MGC-803、MKN-45、AGS细胞用含10%胎牛血清及1%青-链霉素双抗的1640培养基,置于5% CO237 ℃恒温细胞培养箱中培养。
1.2.2 药物处理
将EPZ-6438按照说明书用DMSO配置后进行分装,长期保存于-80 ℃冰箱,实验时取分装母液用DMSO 进行稀释,Control组溶剂对照组,加入同等体积的DMSO。
1.2.3 MTT实验
将对数生长期的细胞按每孔5000个接种于96孔板中,待细胞贴壁后按照给药不同浓度加入EPZ-6438,继续培养48 h后,以每孔20 μL的体积加入MTT溶液,孵育4 h。取出96孔板,吸掉含MTT的培养基,加DMSO 150 μL溶解,室温放摇床震荡至结晶完全溶解。在490 nm 波长处用酶标仪测定各孔的OD(吸光度值),计算细胞存活率。
1.2.4 Transwell侵袭实验
(1)将实验细胞培养液预先更换为无血清的1640培养基培养12 h;(2)按照说明书将培养基与基质胶以1∶6的比例配置成可铺板的基质胶,注入Transwell小室的上室,缓慢吸出,勿产生气泡,铺好胶的小室放入培养箱中待其凝固;(3)将实验细胞用无血清培养基重悬后接入小室上室中,置于与小室对应大小的培养板中,培养板中提前加入含10%胎牛血清的1640培养基中,即小室下室浸泡在10%胎牛血清的1640培养中;(4)培养箱中培养24 h;(5)取出培养板,用棉签小心擦去小室上室内层残余细胞,经过3次PBS浸泡清洗后4%的多聚甲醛固定15 min,PBS浸泡清洗3次,结晶紫染色10 min,PBS浸泡清洗3次,待干;(6)倒置显微镜下观察并计数3个视野细胞数,计算侵袭率,实验重复3次,用Graphpad Prism 6.0软件进行分析并制图。
1.2.5 细胞划痕实验
(1)将实验细胞重悬为单细胞悬液后进行铺板;(2)细胞长至铺满90%时,用10 μL无菌枪头以培养板孔的中间标记作为参照沿培养板盖进行划痕,一次划痕,勿重复,尽可能使划痕均匀,用PBS浸洗掉漂浮细胞后,无血清培养基继续培养;(3)分别于0、24 h拍照;(4)根据0、24 h细胞划痕图片用image J软件分析计算迁移率,重复3次实验。
1.2.6 Western Blot实验
(1)收集实验细胞样品,提取蛋白,按照BCA试剂盒进行蛋白定量,制成相同蛋白浓度的样品;(2)蛋白电泳,转膜后封闭1 h,4 ℃一抗孵育过夜;(3)二抗常温孵育1 h,显影,保存图片并进行分析。
1.3 统计学方法
采用Graphpad Prism 6.0软件对数据进行分析并作图,计量资料多组间比较采用方差分析,组间比较采用q检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 Transwell侵袭实验检测并筛选高侵袭力的胃癌细胞
我们将 HGC-27、MKN-28、MGC-803、MKN-45、AGS细胞重悬后进行细胞计数,以相同数量的细胞用Transwell实验进行侵袭能力检测,我们发现,4种胃癌细胞中,HGC-27细胞的侵袭力最高,见图1。因此,我们选择HGC-27细胞进行后续实验。
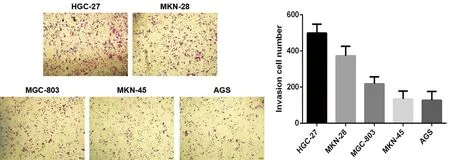
图1 Transwell实验检测胃癌细胞系的侵袭力
2.2 EPZ-6438对HGC-27细胞增殖的影响
EPZ-6438的浓度在20 μmol/L以下时,对HGC-27细胞的增殖影响不大,为了排除EPZ-6438对HGC-27细胞增殖的影响,我们后续试验选择EPZ-6438的浓度范围为0~20 μmol/L,见图2。
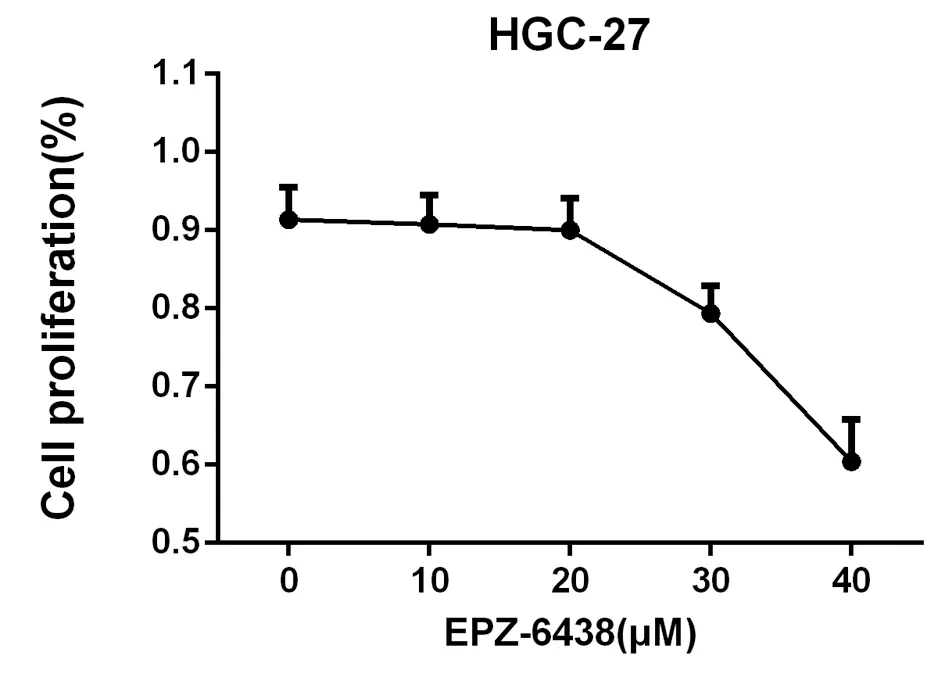
图2 不同浓度EPZ-6438对HGC-27细胞毒性的影响
2.3 EPZ-6438对HGC-27细胞侵袭和转移的影响
根据前期MTT实验结果,我们选择EPZ-6438的作用浓度为0、5、10、15 μmol/L,用含0、5、10、15 μmol/L的EPZ-6438的无血清培养基处理24 h,Transwell结果发现,随着浓度的逐渐增加,EPZ-6438能明显抑制HGC-27细胞的侵袭(F=28.812,P<0.05),见图3。细胞划痕实验结果发现,依浓度递增,EPZ-6438能明显抑制HGC-27细胞的转移(F=44.621,P<0.05),见图4。

与对照组比较,*P<0.05;**P<0.01
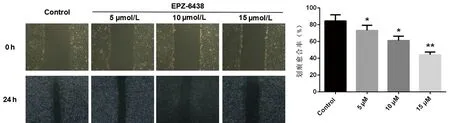
与对照组比较,*P<0.05;**P<0.01
2.4 Western Blot检测EPZ-6438对HGC-27细胞中E-cadherin、N-cadherin和Vimentin的表达
与对照组相比,EPZ-6438能明显降低HGC-27细胞中N-cadherin(F=47.761,P<0.05)和Vimentin(F=100.52,P<0.05)的表达,并促进E-cadherin的表达(F=16.613,P<0.05),见图5。
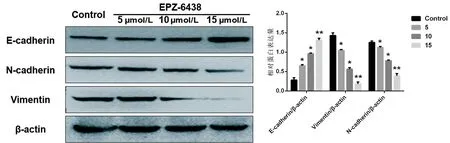
注与对照组比较,*P<0.05;**P<0.01
2.5 Western Blot检测EPZ-6438对HGC-27细胞中基质金属蛋白酶MMP-2和MMP-9的表达
与对照组相比,EPZ-6438能明显降低HGC-27细胞中MMP-2(F=24.472,P<0.05)和MMP-9(F=35.611,P<0.05)的表达,见图6。
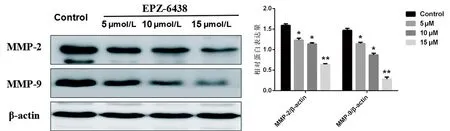
与对照组比较,*P<0.05;**P<0.01
3 讨 论
胃癌在我国消化系统肿瘤中的发病率居高不下,除了与感染幽门螺杆菌和EB病毒有关外,还与过量食用红肉等不良的饮食习惯以及吸烟、酗酒相关[10]。此外,遗传易感性也被认为是胃癌发生和发展的主要原因[11]。EZH2是是多梳抑制复合物2的核心催化亚基,是一种能够催化组蛋白H3的27号位点赖氨酸3甲基化(H3K27me3)的甲基转移酶[12]。研究证实,EZH2在胃癌等多种肿瘤组织及细胞中存在高表达[13]。以往对EZH2抑制剂的研究均是围绕EZH2对肿瘤细胞的增殖及凋亡的研究,其非抑制EZH2的功能方面的研究较少。因此,本实验中,我们用EZH2的抑制剂EPZ-6438,并选择高侵袭力的HGC-27细胞作为研究对象,来研究EPZ-6438对胃癌细胞侵袭和转移的影响。根据MTT结果,EPZ-6438在20 μmol/L以下时,对HGC-27细胞没有明显的毒性,因此后续试验我们选择EPZ-6438的浓度范围为0~20 μmol/L。
通常,胃癌的复发和转移的异常生物学进程包括原癌基因的异常激活、抑癌基因发生突变或失活、DNA碱基发生错配以及修复功能失调、表观遗传学修饰、EMT(上皮间质转化)等[14]。EMT是上皮极性细胞由于受周围环境改变发生生理或病理变化后转变为间质型特征的细胞的过程,形态学改变主要表现为细胞形态由多边形变为梭形,EMT被证实在胚胎发育、组织修复、炎症以及癌症进展中存在异常激活[15]。既往研究认为,肿瘤细胞在上皮间质转化进程,因获得间质表型而具有更强的运动能力及细胞外基质降解能力,最终导致肿瘤细胞的局部和远处转移。上皮细胞通过EMT过程获得单个细胞的迁移和侵袭能力,进而脱离原发灶进入循环系统。肿瘤细胞从原发灶转移到其他组织器官后,进行MET转换,从间质细胞转化为具有上皮表型的细胞,真正形成转移灶[16]。研究发现,在EMT激活的肿瘤细胞过程中往往伴随着N-钙粘蛋白、波形蛋白等蛋白的表达升高,E-钙粘蛋白和密封蛋白等蛋白的表达降低[17]。基质金属蛋白酶 (MMP) 是蛋白酶家族成员之一,主要由蛋白酶、生长因子、细胞表面受体以及黏附分子等构成。研究证实,大多数癌症的进展与MMP活性相关[18]。其中,作为MMP家族一类可以降解细胞外基质的锌依赖性蛋白水解酶,MMP-2和MMP-9被认为与癌症侵袭、血管生成等密切相关[19]。N-钙黏着蛋白能与FGF受体发生作用,促进MMP-9 的表达,进而通过增强EMT进程促进癌细胞的侵袭和转移[20]。在本实验中,EPZ-6438能明显抑制胃癌细胞的侵袭和转移,且呈浓度依赖性。进一步研究发现,EPZ-6438能明显降低HGC-27细胞中N-cadherin和Vimentin的表达,并促进E-cadherin的表达。为了证实N-cadherin和Vimentin减少是否会影响基质金属蛋白酶的表达,对EPZ-6438处理的胃癌细胞进行检测,发现MMP-2和MMP-9表达减少,这与前面侵袭和转移的实验结果一致,该结果表明EPZ-6438能明显抑制胃癌细胞HGC-27的侵袭和转移,其机制可能与EPZ-6438抑制胃癌细胞发生上皮间质转化密切相关。
综上所述,EPZ-6438能明显抑制胃癌细胞的侵袭和转移,其机制可能与抑制胃癌细胞发生上皮间质转化有关。EPZ-6438调控胃癌细胞上皮间质转化来抑制其侵袭和转移的具体分子信号机制有待进一步研究。
