hucMSC-exo介导的mir-124对大鼠肝再生的影响及机制
2022-02-07刘旺陈梅肖经华许芝彬
刘旺,陈梅,肖经华,许芝彬
(1.广州市番禺区第五人民医院内科;2.广州市番禺区第五人民医院超声科,广东 广州 510000;3.马来西亚拉曼大学理学院,马来西亚 坎帕尔50744)
肝脏涉及能量代谢及胆汁的生成,且具有组织损伤后重建的能力。小鼠模型的研究表明,将70%肝脏切除后,在第7~10天其重量和体积完全恢复。组织学层面的肝再生涉及多种因素[1]。例如:细胞因子、信号通路、生长因子等。microRNAs(miRNAs)是一种小的非编码RNA,通过转录后调控靶基因的表达参与许多生物学过程[2]。越来越多的证据表明miRNAs在肝脏再生中起着关键作用[3-6]。
有报道称mir-21促进细胞周期蛋白D1的翻译,促进细胞周期的进展;还发现mir-21/PTEN轴可通过调节PI3K/Akt信号促进肝细胞增殖[7-8]。与此相反,在大鼠肝组织中mir-127在部分肝切除术后出现下调,mir-127的过度表达抑制了大鼠肝brl-3a细胞的增殖,阻滞了G2/M期细胞周期[9]。然而,miRNA在肝再生中的作用是什么?尚待进一步研究证实。
细胞外转运蛋白和脂肪的mRNA的循环。外泌体或胞外囊泡由多种细胞分泌,广泛存在于体液中,可在细胞间转运miRNAs、蛋白质和mRNAs[11]。此前研究结果表明,外源性mir-10可以通过调节肝切除大鼠肝细胞增殖,抑制EphA4的出现,促进肝再生[12]。外源性miRNAs也被证明可以作为良恶性肝病的诊断生物标志[13]。本研究的目的是探讨促进肝移植术后肝再生的可能机制,探讨肝切除术后介入治疗的新靶点。
1 材料和方法
1.1 实验动物及分组
清洁饲养成年雄性SPF级SD大鼠,10~12 周龄,总共126只,体重约250~300 g。室温应控制在20~25 ℃,常规清洁饲养,清洁饲料应定期更换;将大鼠的饲养室温保持在20~25 ℃,并创造一个有规律的昼夜交替周期。本实验需严格遵守实验基本原则,对实验动物进行合理合法的处理。
1.2 实验方法
1.2.1 建立70%大鼠肝脏动物模型:制备的hucMSCs悬浮液用PBS洗涤2次,并在无血清和低葡萄糖的LG-DMEM培养基中培养48 h。在1000 g下离心20 min,然后继续分别2000 g下离心20 min、10 000 g下离心20 min。将浓缩的上清液装载在5 mL 30%蔗糖/D2O缓冲液,然后在100 000g下超速离心60 min。收集微泡的浓缩部分,并用PBS稀释,纯化的胞外体漂浮在无核酸酶的水中,-80 °C下储存以备将来分析。
1.2.2 细胞培养:大鼠肝细胞BRL-3A细胞在37 ℃的5% CO2培养箱中培养。
1.2.3 表达载体构建及转染:mir-124模拟物、mir-124激动剂、mir-124抑制剂和相对阴性对照(基因药物)。将Foxg1的开放阅读框插入pcDNA3 Foxg1过表达载体,该载体由1个载体(USA,invitrogen)的多个克隆位点构建。使用异丁烯6转染试剂(USA,Promega)进行转染。转染效率通过随后的qPCR或Western Blot印迹分析进行验证。
1.2.4 CCK-8测定:使用细胞计数对细胞生长的估计将不同处理的细胞培养特定时间,然后将10%的细胞添加到培养基,2 h后,使用微孔板读取器(USA,bio-TEK)测量450 nm的吸光度。
1.2.5 BrdU检测:混合法检测细胞增殖将经不同处理的大鼠肝脏中的Brl-3a细胞与BrdU溶液(10 μM)混合,在37 °C下培养30 min。BrdU标记和检测试剂盒(USA,sigma-Aldrich)用于分析BrdU的掺入。
1.2.6 实时定量PCR(qPCR):从大鼠肝组织或培养细胞中提取总RNA,并使用Trizol和super transcriptase III将其反转录为DNA。使用2-ΔCT法分析相对表达,并使用U6表达作为标准化的内部对照。
1.2.7 免疫印迹:使用Ripa缓冲液和蛋白抑制剂鸡尾酒从培养细胞或大鼠肝组织中分离总蛋白。通过SDS-PAGE分离相同量的蛋白质,膜用5%脱脂乳密封,与一级抗体孵育,然后与相应的二级抗体孵育。用于研究的主要抗体如下。Chtf8(1∶500、PA5-109543、透明质原、USA)、Foxg1(1∶1000、PA5-26794、透明质原、USA)和β-肌动蛋白(1∶5000,PA1-16889,透明质原,USA)。
1.2.8 荧光素酶报告分析:克隆Foxg1野生型(WT)或突变型(MUT)3'-UTR,构建在pGL3-LUC荧光素酶载体(USA,Promega)上。作为可显色的特殊蛋白质载体,将实验对象的肝细胞和mir-124模拟物(可以选择其他参照组)一起转染。在记录蛋白质的相对活性48 h后,等待进一步记录酶的相应测试结果。
1.2.9 纳米颗粒追踪分析和扫描电子显微镜:样品在半瓦灯下干燥,然后在扫描电子显微镜下立即拍摄外泌体。
1.2.10 RNA提取:microRNA微阵列从pH或pH+exo组大鼠肝组织中分离总RNA,并用PURELINK miRNA分离试剂盒纯化。上海汉工贸有限公司生产的AFM芯片和基因芯片构建列阵差异表达的miRNA由sangerbox(http://www.sangerbox.com)分析。
1.3 质粒构建
质粒构建是分子生物学研究中最常用的实验技术。原理依赖于限制性核酸内切酶,DNA连接酶和其他修饰酶的作用,分别对目的基因和载体DNA进行适当切割和修饰后,将二者连接在一起,再导入宿主细胞,实现目的基因在宿主细胞内的正确表达。
(1)质粒构建方式:质粒构建方式多样,常规的T4连接酶,T4连接酶可用于平末端也可用于粘性末端连接;(2)质粒载体的制备:质粒载体的制备既可以选择单酶切也可以选择双酶切,使载体的末端具有特异性,防止自连。
2 结 果
2.1 从参与肝再生的hucMSCs外显体中鉴定miRNA
为了确认参与肝脏再生的hucMSCs来源的外泌体miRNA,实验采用了miRNA微阵列芯片来识别不同表达的miRNA。在实验中,我们发现在外泌体治疗后,肝组织中的mir-193a、mir-124和mir-93显著上调,而mir-204和mir-10a-5p则呈下降趋势,见图1。

*表示P<0.05的显著性差异;**表示P<0.01的显著性差异
mir-124和mir-93是促进brl-3a细胞生长的有效模拟载体。通过qPCR分析各组前体miRNA的相对表达,并检测各实验组大鼠肝组织中前体miRNA的表达水平,以调查和解释miRNA表达变化的来源。实验结果显示,70%肝切除术后,外泌体注射组和70%肝切除术后非外泌体注射组的pre-93和mir-193a显著增加,外泌体注射组的pre-mir-204和pre-mir-10a-5p降低,在外体注射组和非注射组之间,前mir-124没有显著差异,见图2右图。
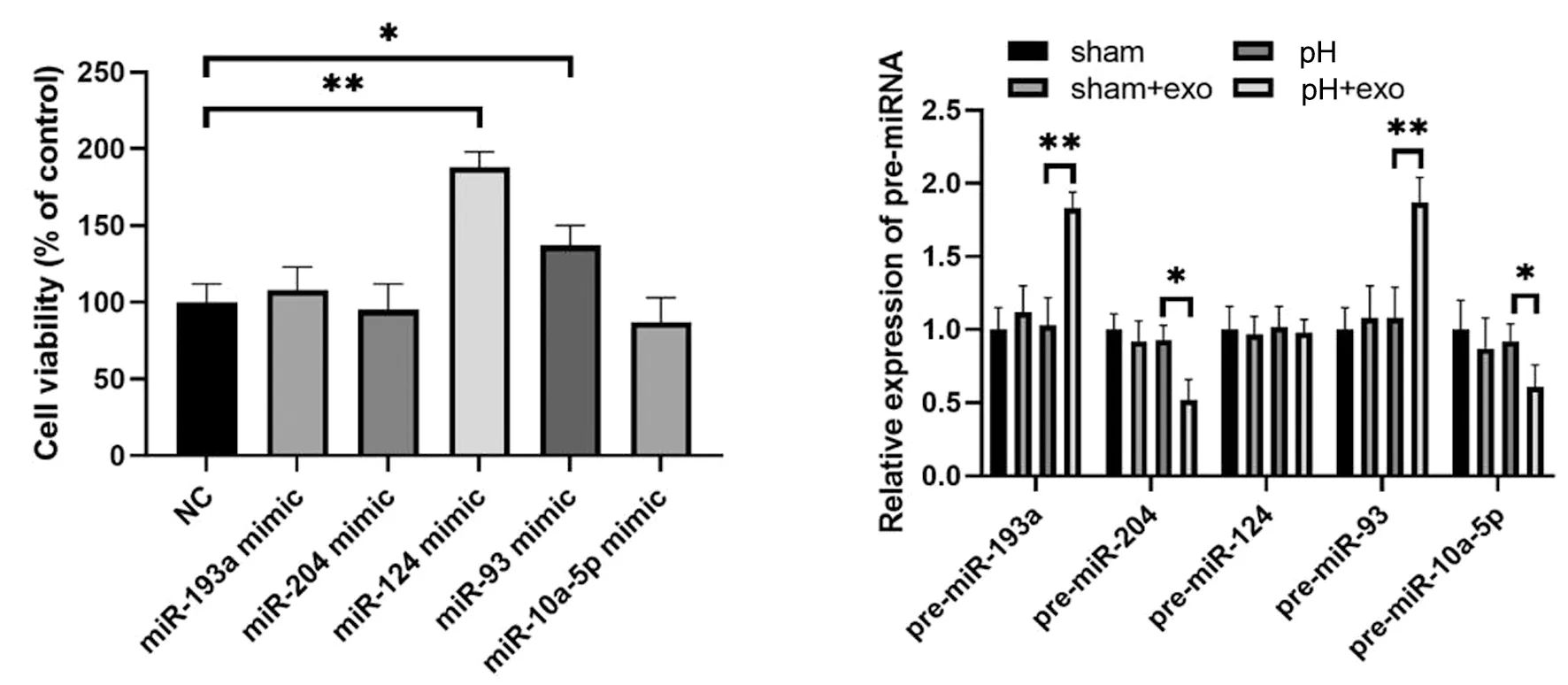
左图:将miRNA模拟物或阴性对照(NC)转染brl-3a大鼠肝细胞,检测细胞增殖;右图:各组前miRNA相对表达的qPCR分析图-3 mir-193a的qPCR分析mir-204、mir-124、mir-93和mir-10a-5p在hucMSCs衍生的外泌体中的相对表达
通过qPCR分析mir-193a、mir-204、mir-124、mir-93和mir-10a-5p在hucMSCs衍生的外泌体中的相对表达。进一步推测miRNA表达的变化可能来自来源于hucMSCs的外泌体。进一步证实,hucMSCs分泌的mir-124的表达显著高于对照组,见图3,这也表明hucMSCs衍生的分泌的mir-124有可能促进SD大鼠肝切除后的肝再生过程。
**表示P<0.01的显著性差异
2.2 mir-124促进大鼠肝脏再生,改善大鼠70%肝切除术后肝损伤
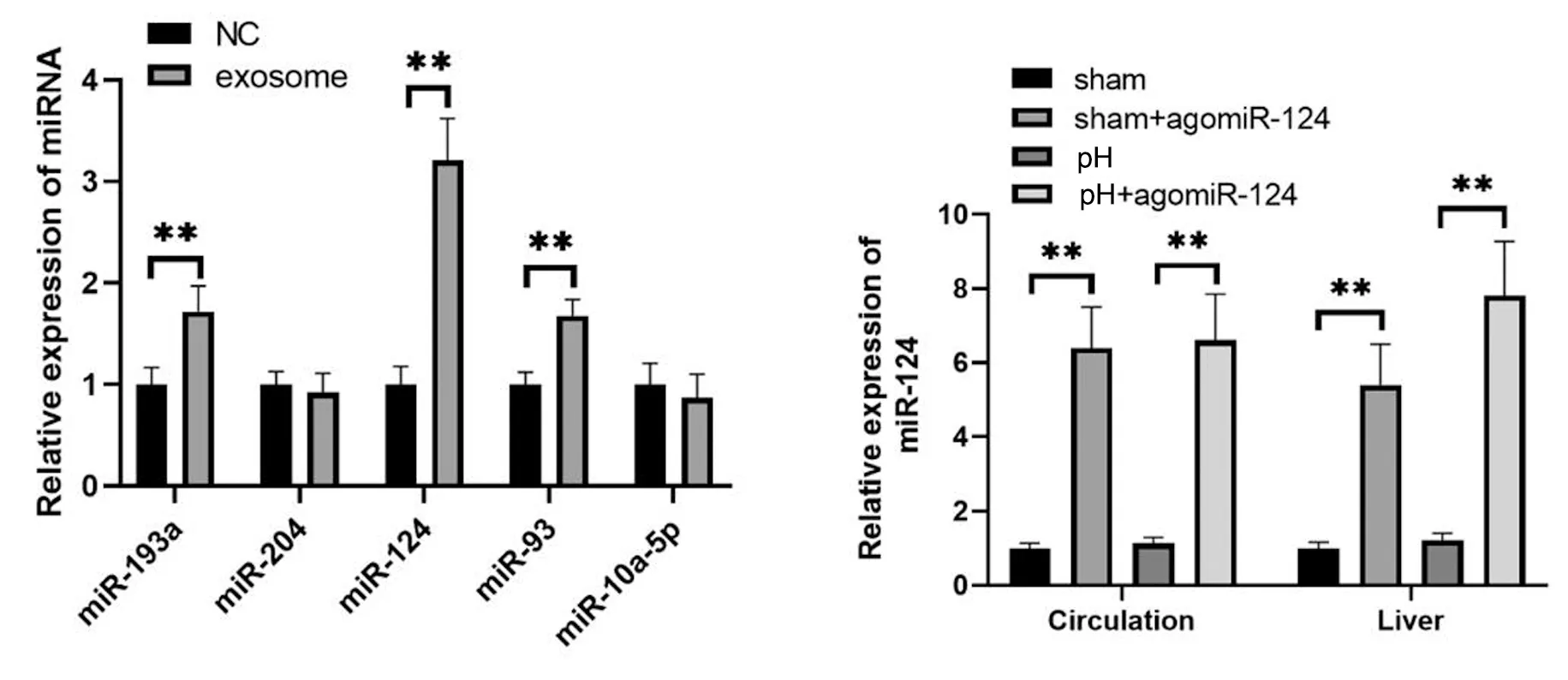
用agomir-124对各实验组大鼠进行干预。干预因素为:治疗过程是否使用agomir-124。对肝组织中的mir-124做qPCR分析。结果显示,各组中mir-124差异具有统计学差异。表明agomir-124治疗的介入效果确切。部分肝切除术增加了mir-124在循环和结缔组织中的表达,进一步提高了mir-124的表达,见图4。在肝脏和血液循环,对不同时间节点肝脏/体重比记录,mir-124的过度表达显著增加了部分肝切除术后的肝脏/体重比,见图5。对第3天肝组织切片进行HE染色和PCNA染色检测,见图6、图7。进一步发现,agomir-124还能改善肝坏死,促进肝细胞增殖,降低血清ALT/AST水平,见图8。由此可见mir-124对肝再生有正向调节作用。

*表示P<0.05的显著性差异;**表示P<0.01的显著性差异

**表示P<0.01的显著性差异
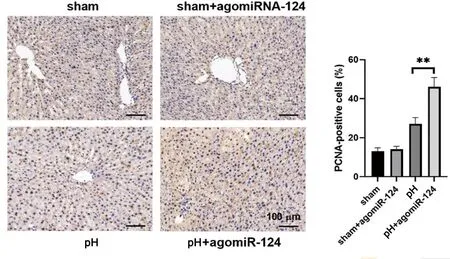
**表示P<0.01的显著性差异
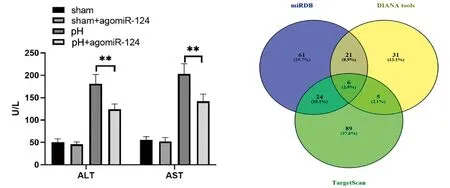
**表示P<0.01的显著性差异
2.3 mir-124直接靶向Foxg1调节大鼠肝细胞增殖
为了进一步了解mir-124调节肝再生的机制,我们进行了生物信息学分析以预测mir-124的潜在靶点。利用miRDB、DIANA和TargetScan在线工具进行生物信息学分析,预测mir-124的潜在靶点,发现了6个常见的目标点(Chetf8、Pasp、CHSYS、Adam9、Strbp、Foxg1),见图9。
通过qPCR分析6个常见靶点(chtf8、PASP、chsy1、ADAM9、strbp和Foxg1)的相对表达水平。结果显示,mir-124模拟物显著抑制chtf8和Foxg1的表达,见图10。此外,使用mir-124模拟物或NC转染brl-3a细胞,并通过Western Blot分析chtf8和Foxg1蛋白的表达。研究发现,mir-124的过度表达显著降低了Foxg1蛋白的水平,但没有改变chtf8蛋白的表达,见图11。
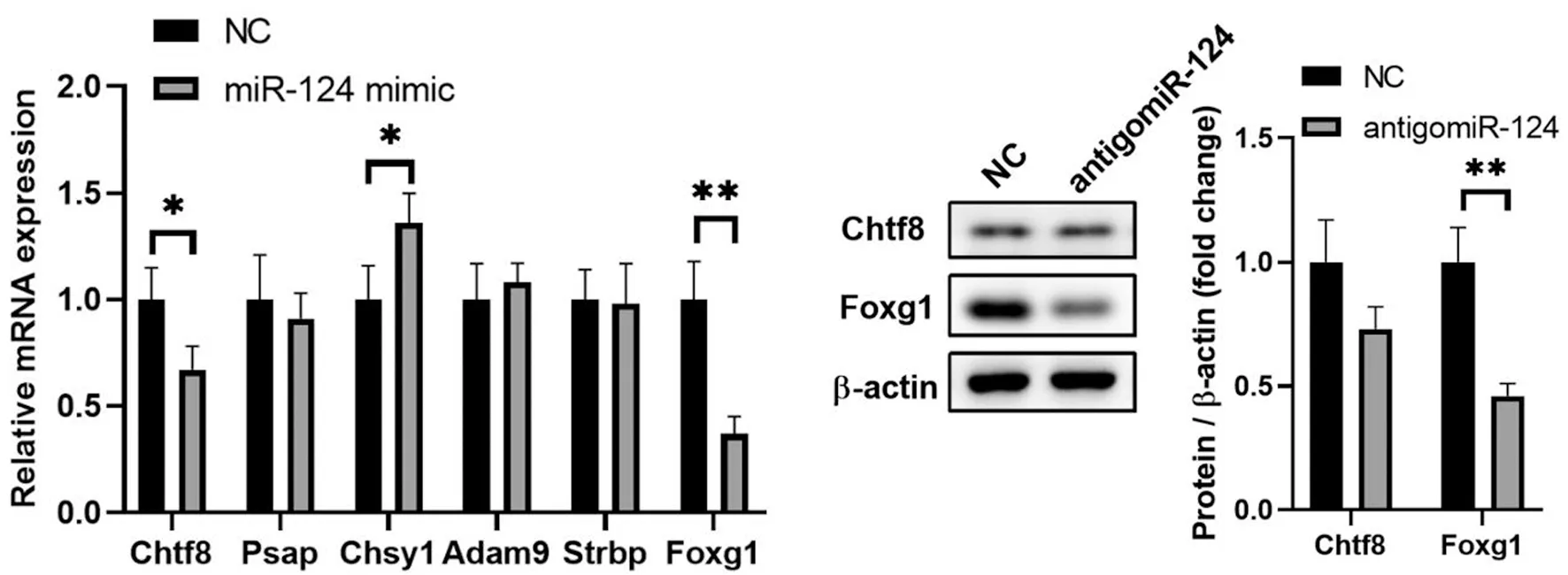
*表示P<0.05的显著性差异;**表示P<0.01的显著性差异
2.4 外源性mir-124 Foxg1下调,肝部分切除后促进大鼠肝再生
为了进一步验证mir-124和Foxg1在肝部分切除术后肝再生中的作用,进一步比较了假手术组和肝部分切除组大鼠肝脏中Foxg1的蛋白表达水平。
Western Blot分析假手术组、pH组、假手术+exo组和pH+exo组大鼠肝脏中Foxg1蛋白的表达。结果发现,pH组Foxg1的表达低于假手术组,外源性干预进一步促进了Foxg1的表达,见图12。

**表示P<0.01的显著性差异
Western Blot分析假手术组Foxg1蛋白的表达sham+agomir-124和pH+agomir-124大鼠肝脏的表达也发现了类似的结果,见图13。
3 讨 论
人骨髓间充质干细胞(hucMSC)特别是人脐带骨髓间充质干细胞是一种新型的再生细胞资源再生疗法。然而,MSCs生物学基础需要深入了解。外泌体是一种重要的生物因子,其内含物种类繁多,具有多种生物学功能。在当前研究中,我们从脐带间充质干细胞中收集外泌体,并检测其细胞保护作用,对组织修复的影响。蛋白质组学分析表明,显著富集的蛋白质组分在代谢中发挥监管作用。生理层面,MSC-Exo使脂联素水平升高。此外,MSC-Ex显著加速了干细胞的分化,huc-MSCs衍生外泌体可发挥与其代谢调节能力相关的组织再生作用。
在部分肝切除术后,残肝组织在收到反馈信号的刺激后启动增殖,从而恢复肝脏的生理功能,不同细胞因子的参与使这个过程复杂多样[14]。间充质干细胞(MSCs)及其衍生的外体已被证明是治疗肝纤维化、急性肝损伤和肝癌等肝脏疾病的新策略[15]。由大多数类型细胞分泌,被包裹在脂质囊泡中直径为40~100 nm的生物分子称为外泌体[16]。据考证,mir-124作为一种基因调控分子,能有效改变Wnt/β-连环蛋白通路,获得信息反馈,改善缺血、营养不良等因素引起的肝细胞坏死或暂时性功能障碍[17]。另外来自于hucMSCs衍生的外泌体则能利用抗氧化电位减少因CCl4引起的肝硬化和糖尿病等疾病的发生[18]。最近的研究集中在MSC来源的外泌体在肝再生中的治疗作用[19]。
本研究表明,hucMSCs衍生的外体可以保护大鼠肝部分切除后的肝损伤并促进肝再生。使用大鼠肝组织进行miRNA微阵列分析,无论是否进行外体处理。多个失调的mirna已被发现,mir-124已显示出促进大鼠肝细胞增殖的能力。
microRNAs (miRNAs)是重要的富集分子,在组织中可以调节基因转录和连接小胶质细胞极化相关通路的表达。在已知的miRNA中,mir-124是一个在小胶质细胞中高表达的特异性miRNA。在生理条件下,mir-124调控细胞在其休眠中起关键作用。在病理条件下,mir-124下调通过极化细胞进入增加神经炎症M1表型,而mir-124上调通过将细胞极化成M2来减少炎症表型。这些研究表明mir-124是否有潜力成为一种有效的微极化剂,细胞转化为M2表型,从而促进创伤性脓液神经发生。这是一种很有前途的方向。将mir-124传递到组织并发挥其作用的是外泌体,在内膜小体囊泡(30~100 nm)含有蛋白质、脂质、mRNA和小分子核糖核酸。外泌体的优点包括它通过血脑屏障(血脑屏障)的能力,mir-124修复损伤的可能性很大它的双脂膜使其嵌入mir-124稳定并在交付后发挥作用。值得注意的是,最新的研究表明,外泌体减少了损伤炎症,促进损伤后功能恢复和mir-124富集的外泌体(Exo-mir-124)促进N9小胶质细胞的M2极化,体内细胞发生增强。然而,是否Exo-mir-124可以调节小胶质细胞的极化及其基础机制仍然未知。
为了排除大鼠肝细胞内源性来源mir-124的可能性,检测了mir-124整体的表达,未能找出mir-124的差异,但观察结果显示mir-124具有外泌体,有望成为临床肝再生治疗的新标志物。mir-124普遍存在于头颈部鳞状细胞癌、前列腺癌、胶质母细胞瘤和非小细胞肺癌等癌症中,其本身具有抑癌作用。mir-124的特异性表现导致HCC中的表观遗传沉默。当细胞周期素依赖的蛋白酶发育受到阻碍时,肝细胞组织萎缩甚至死亡的现象称为mir-124的过度表达。
当mir-124的肝脏环境发生变化时,其功能是不同的。肝脏疾病中mir-124过度表达的治疗需要进一步研究。FoxG1在卵巢癌细胞中有很高的表达。Foxg1还通过启用Wnt信号启用HCC-EMT。研究结论Foxg1是直接靶点,在下调作用下,Foxg1可以促进pH后的肝再生。然而,外源性mir-124/Foxg1如何改善pH后大鼠的肝损伤尚不清楚。参与肝脏再生调节的信号通路及其与mir-124/Foxg1的关系有待进一步研究。
综上所述,该研究结果表明,由hucMSCs衍生的外泌体mir-124通过负性调节大鼠部分肝切除模型中的Foxg1,促进肝再生,抑制肝损伤。这些发现可用于开发肝再生的新疗法。
