高分子量透明质酸抑制横纹肌肉瘤细胞迁移的初步研究
2022-02-07苏静艳郑景贤赵亚浩佟慧丽
苏静艳,郑景贤,赵亚浩,佟慧丽*
(1.东北农业大学细胞与遗传工程黑龙江省重点实验室,哈尔滨 150030;2.东北农业大学生命科学学院细胞与发育生物学实验室,哈尔滨 150030)
透明质酸(Hyaluronic acid,HA)是由N-乙酰氨基葡萄糖和葡萄糖醛酸构成,是重复二糖单元组成的多糖,属于氨基聚糖家族,作为细胞外基质重要成分,广泛存在于人体组织。1 MDa以上透明质酸被定义为高分子量HA(High molecular weight hyaluronic acid,HMW-HA)。HMW-HA具有抗增殖、抗氧化、抗肿瘤和抗血管生成特性,参与伤口愈合[1-2]。正常生理状态下,透明质酸以高分子量形式存在,在病理情况如炎症发生时,透明质酸降解为小分子,发挥抗炎、抗细菌感染等作用[3-4]。透明质酸通过结合细胞表面各种受体分子如CD44、HMMR、LAYN等发挥生物学活性[5-6]。对CD44高表达的实体肿瘤,化学修饰后的透明质酸和基于透明质酸的纳米载体可用于化疗药物递送,增强药物作用潜能及细胞毒性,获得较好抗肿瘤作用[7]。
此外,不同生物个体中透明质酸以不同分子量范围存在,裸鼹鼠是目前寿命最长的啮齿类动物,与其他哺乳动物相比,可产生超高分子量的透明质酸(>6.1 MDa),研究表明超高分子量的透明质酸通过抑制其受体CD44与其他蛋白相互作用下调p53基因表达,使小鼠和人类细胞免受应激诱导的细胞周期停滞和细胞死亡[8]。同时裸鼹鼠体内超高分子量透明质酸的存在,使其体内细胞产生接触抑制,并抵抗癌症发生[9],近年来引发学界关注。因此推测高分子量的透明质酸抗癌效果较好。
横纹肌肉瘤(Rhabdomyosarcoma,RMS)是儿童和青少年中最常见的(约50%)软组织肉瘤,是一种以早期肌源性分化为特征的恶性肿瘤[10]。其恶性程度高,侵袭和转移能力强,放化疗效果不理想,易复发,预后不良,是临床治疗难题。本文通过研究高分子量透明质酸(1.2 MDa)抑制横纹肌肉瘤细胞迁移,旨在为高分子量透明质酸在抗肿瘤研究中提供新的思路和策略,具有广阔的应用前景和价值。
1 材料与方法
1.1 试验材料
本试验采用的RD(人恶性胚胎横纹肌瘤细胞)(CL-0193)购自武汉普诺赛生命科技有限公司,采用RD细胞专用培养基(CM-0193)培养细胞。
1.2 试验试剂及仪器
高分子量透明质酸(1.2 MDa,9004-61-9,中国)。Cdc42抗体(bs-3555R,博奥森,中国),Arp2/3抗体(bs-10563R,博奥森,中国),GAPDH抗体(10494-1-AP,Proteintech,中国)。辣根过氧化物酶(HRP)标记的山羊抗兔二抗(bs-0925GHRP,博奥森,中国)。Cy5标记的小鼠抗兔二抗(bs-0369M-Cy5,博奥森,中国)。甘氨酸、Tris、聚丙烯酰胺、过硫酸铵、TEMED、胰蛋白酶、PBS溶液(Sigma,美国),微丝绿色荧光探针Actin-Tracker Green(C1033)、RIPA Buffer细胞裂解液、SDS-PAGE蛋白上样缓冲液(5×)、超敏型抗荧光淬灭剂、细胞核染料DAPI、Tween 20、Trition-X-100、牛血清白蛋白BSA(碧云天,中国),PVDF膜、超敏型曝光液(Millpore,美国),其他化学试剂均为国产分析纯。
生物超净工作台(苏州安泰,中国),电子分析天平(Mettler Toledo,瑞士),超低温冰箱(SANYO,日本),双板垂直电泳仪及转膜仪(北京六一,中国),CO2培养箱(Thermo,美国),倒置显微镜(Olympus,日本),化学发光成像仪(MiniChemiTM 500,Sage Creation Science,中国),超高分辨显微镜(Deltavision OMX SR,GE,美国)。
1.3 试验方法
1.3.1 细胞划痕试验
将RD细胞接种于6孔板中,待细胞贴壁后,用100 μL移液管尖端均匀绘制无细胞区域,用PBS清洗细胞3次以去除细胞碎片,补充新鲜培养基(不含血清)。拍照记录细胞生长情况,37℃,5%CO2培养24 h后,再次对细胞拍照,采用Image J分析细胞划痕面积,细胞迁移率:
迁移率(%)=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100。
1.3.2 高分子量透明质酸的细胞添加试验
采用PBS磷酸盐缓冲液稀释高分子量透明质酸至浓度为1 μg·μL-1(透明质酸工作液)。取贴壁生长的RD细胞,去除旧的细胞生长培养液,以PBS清洗细胞后,加入新鲜细胞生长培养液和高分子量透明质酸的混合溶液,充分混匀,其中透明质酸终浓度分别为50、100和200 μg·mL-1。对照组向细胞中添加PBS和新鲜生长培养液的混合溶液。以6孔板为例(单孔细胞培养液总体积为2 mL),试验组和对照组药品添加量如表1所示。将添加高分子量透明质酸或者PBS对照的细胞放置于37℃,5%CO2培养箱中继续培养48 h,用于后续荧光定量,Western blot检测及细胞免疫荧光试验。
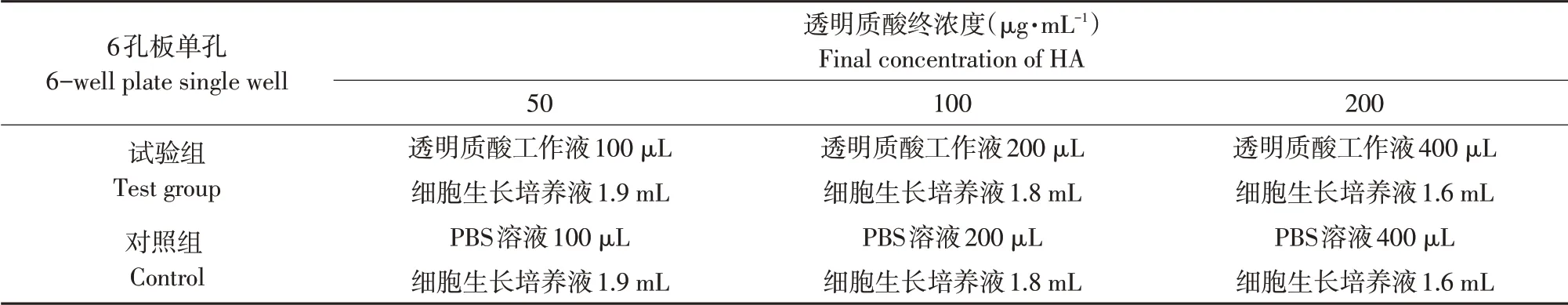
表1 高分子量透明质酸的细胞添加试验Table 1 Cell addition test of HMW-HA
1.3.3 实时荧光定量PCR检测
本研究采用SYBGreen实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-PCR)法检测高分子量透明质酸对RD细胞中不同透明质酸受体mRNA的表达情况。具体流程为RNA提取,反转录及荧光定量PCR检测。①RNA提取:采用TRIZOL试剂(Invitrogen)提取RD细胞总RNA。②反转录:采用HiScript II 1st Strand cDNA Synthesis Kit试剂盒(R211-01,南京诺唯赞,中国)进行细胞总RNA反转录试验,用于双链cDNA合成。③荧光定量PCR:采用SYBR qPCR Master Mix试剂盒(Q111-02,南京诺唯赞,中国)说明配制RTPCR反应体系。
引物序列如表2所示。反应体系为:SYBR q PCR Master Mix 10 μL,上下游引物(10 μmol)各0.5 μL,cDNA模板2 μL,补水至20 μL。反应条件为:95℃预变性30 s,95℃变性10 s,60℃退火和延伸30 s,40个循环。每个样品进行3次平行试验。以GAPDH为内参。采用2-ΔΔCT法计算不同透明质酸受体mRNA相对表达量。

表2 不同HA受体荧光定量引物序列Table 2 Fluorescence quantitative primer sequences of different HA receptors
1.3.4 Western blot检测
采用标准试验流程进行Western blot检测,简述如下:以预冷PBS清洗细胞3次。弃去PBS,加入RIPA Buffer细胞裂解液对细胞进行蛋白质提取。采用SDS-PAGE蛋白上样缓冲液稀释收集的蛋白样品。随后,进行SDS-PAGE聚丙酰胺凝胶电泳试验,通过蛋白印记系统,将聚丙烯凝胶上分离的蛋白条带转移至PVDF膜上(200 mA,恒流2 h)。分别采用CD44、cdc42、Arp2/3、和GAPDH等一抗稀释液孵育PVDF膜(4℃,12 h),使用PBST(PBS+0.2% Tween 20)清洗PVDF膜3次,以HRP标记的山羊抗兔二抗孵育PVDF膜(37℃,1 h),PBST清洗3次后,采用化学发光成像仪对蛋白条带进行图像采集和分析。一抗和二抗稀释倍数分别采用说明书推荐的最佳比例。
1.3.5 细胞免疫荧光染色
采用PBS清洗贴壁的RD细胞铺片,随后以4%多聚甲醛于室温下固定细胞,20 min后,弃去固定液。用PBS清洗细胞3次后,加入5%BSA的PBST(PBS+0.1%Triton)进行透膜和封闭处理(37℃,1 h)。弃去5%BSA的PBST(PBS+0.1%Triton),以CD44一抗稀释液(以5%BSA的PBST稀释抗体)孵育细胞(4℃,12 h),采用PBST清洗细胞3次,弃去清洗液,加入Cy5标记的小鼠抗兔二抗稀释液避光孵育细胞(37℃,1 h),采用PBST清洗细胞3次并弃去清洗液。采用Actin-Tracker Green染料稀释液避光孵育细胞30 min,采用PBST清洗细胞3次并弃去清洗液,采用DAPI细胞核染料孵育细胞10 min,采用PBST清洗细胞3次,吸净清洗液后,将细胞铺片倒扣于预先滴加抗荧光猝灭封片剂的载玻片上,使用超高分辨显微镜对细胞中CD44表达和微丝分布进行观察和拍照。一抗和二抗稀释倍数分别采用说明书推荐的最佳比例。
1.4 数据统计与分析
采用Image J软件扫描Western blot图片灰度及分析细胞迁移率,所有试验数据利用GraphPad Prism软件统计。采用SPSS(SPSS Inc.Chicago IL,USA)分析数据差异显著性。相关数据使用t检验进行差异显著性分析。ns代表不同处理组之间无统计学差异;*代表不同处理之间差异显著(P<0.05),**代表不同处理组之间差异极显著(P<0.01)。
2 结果与分析
2.1 高分子量透明质酸细胞划痕试验
本研究采用不同浓度高分子量透明质酸处理RD细胞,分别于作用0和24 h记录RD细胞迁移情况(见图1A)。统计分析结果表明不同浓度的透明质酸(50、100和200 μg·mL-1)均可极显著抑制RD细胞迁移(P<0.01),其中200 μg·mL-1透明质酸抑制效果最明显(见图1B)。表明高分子量透明质酸可抑制RD细胞迁移,以200 μg·mL-1浓度透明质酸用于后续试验。
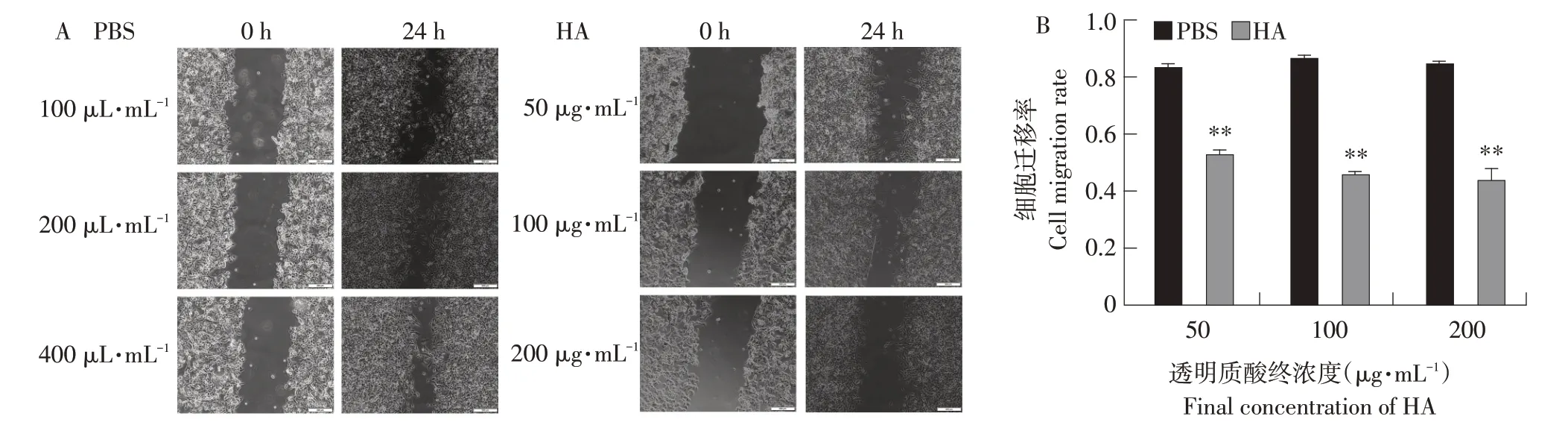
图1 高分子量透明质酸对RD细胞迁移的影响Fig.1 Effects of high molecular weight hyaluronic acid on RD cell migration
2.2 不同透明质酸受体mRNA表达的荧光定量PCR检测
采用200 μg·mL-1高分子量透明质酸处理RD细胞,48 h后收集细胞,提取总RNA,反转录为双链cDNA,并采用SYBRGreen荧光定量PCR法检测7种主要的透明质酸受体mRNA表达情况。检测结果表明不同透明质酸受体在RD细胞中呈现不同的表达量。其中CD44和HMMR具有较高的表达量,且在高分子量透明质酸处理后CD44和HMMR的mRNA表达量均显著下调。而其他几种透明质酸受体LAYN、HARE、Siglec9、TLR2和TLR4表达水平较低,高分子量透明质酸处理对上述几种受体的表达无显著影响(见图2)。CD44和HMMR在RD细胞中高表达,在透明质酸处理时表达量发生显著变化,表明CD44和HMMR可能作为高分子量透明质酸发挥作用的主要受体,在抑制RD细胞迁移过程中发挥重要作用。
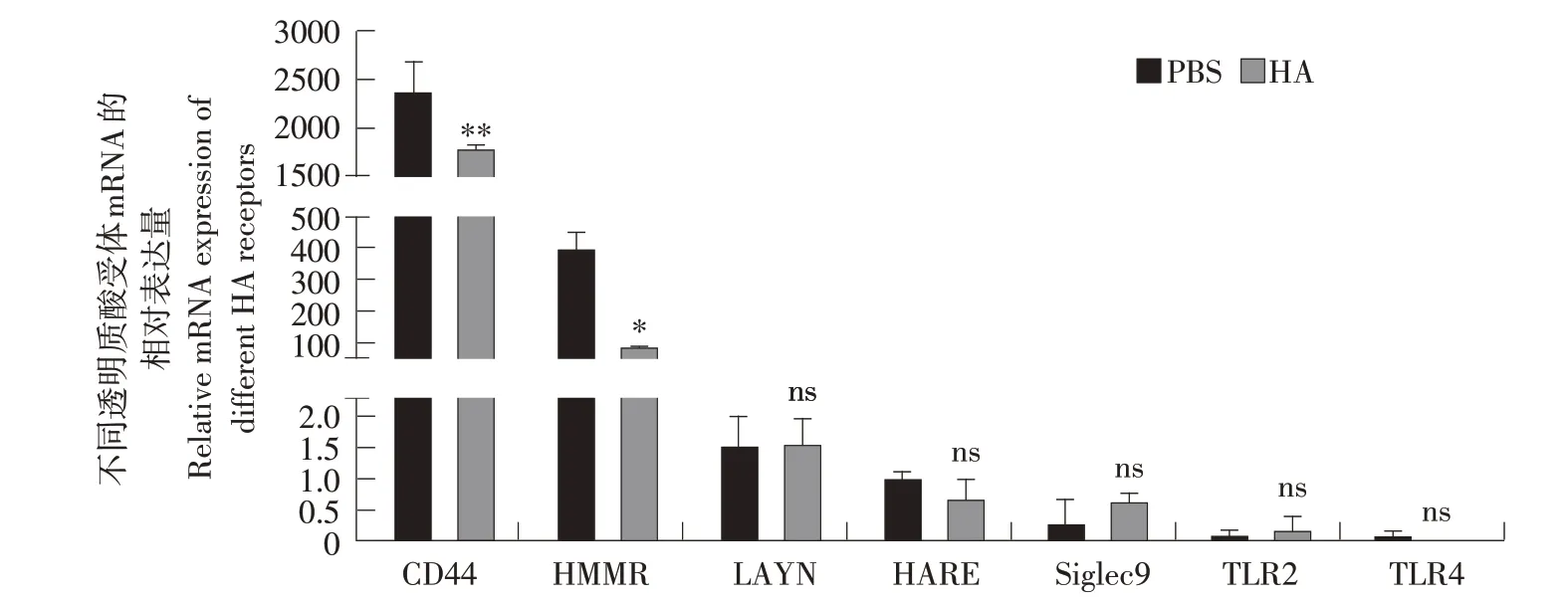
图2 不同透明质酸受体mRNA表达的荧光定量PCR检测Fig.2 Detection of the mRNA expression of hyaluronic acid receptors by real-time fluorescence quantitative PCR
2.3 高分子量透明质酸对RD细胞迁移相关蛋白表达的影响
为进一步阐明高分子量透明质酸抑制RD细胞迁移的机理。本研究采用Western blot检测CD44及细胞迁移相关蛋白表达情况。检测结果显示,与mRNA表达的荧光定量检测结果一致,200 μg·mL-1高分子量透明质酸处理RD细胞48 h后,CD44蛋白表达量与对照组相比显著下调(见图3A,B)。同时透明质酸处理组的细胞迁移相关蛋白cdc42和Arp2/3表达量亦显著下调(见图3A,C,D)。上述结果表明,高分子量透明质酸处理引起CD44表达量下调,通过下调cdc42和Arp2/3表达而影响微丝聚合,阻碍RD细胞迁移。
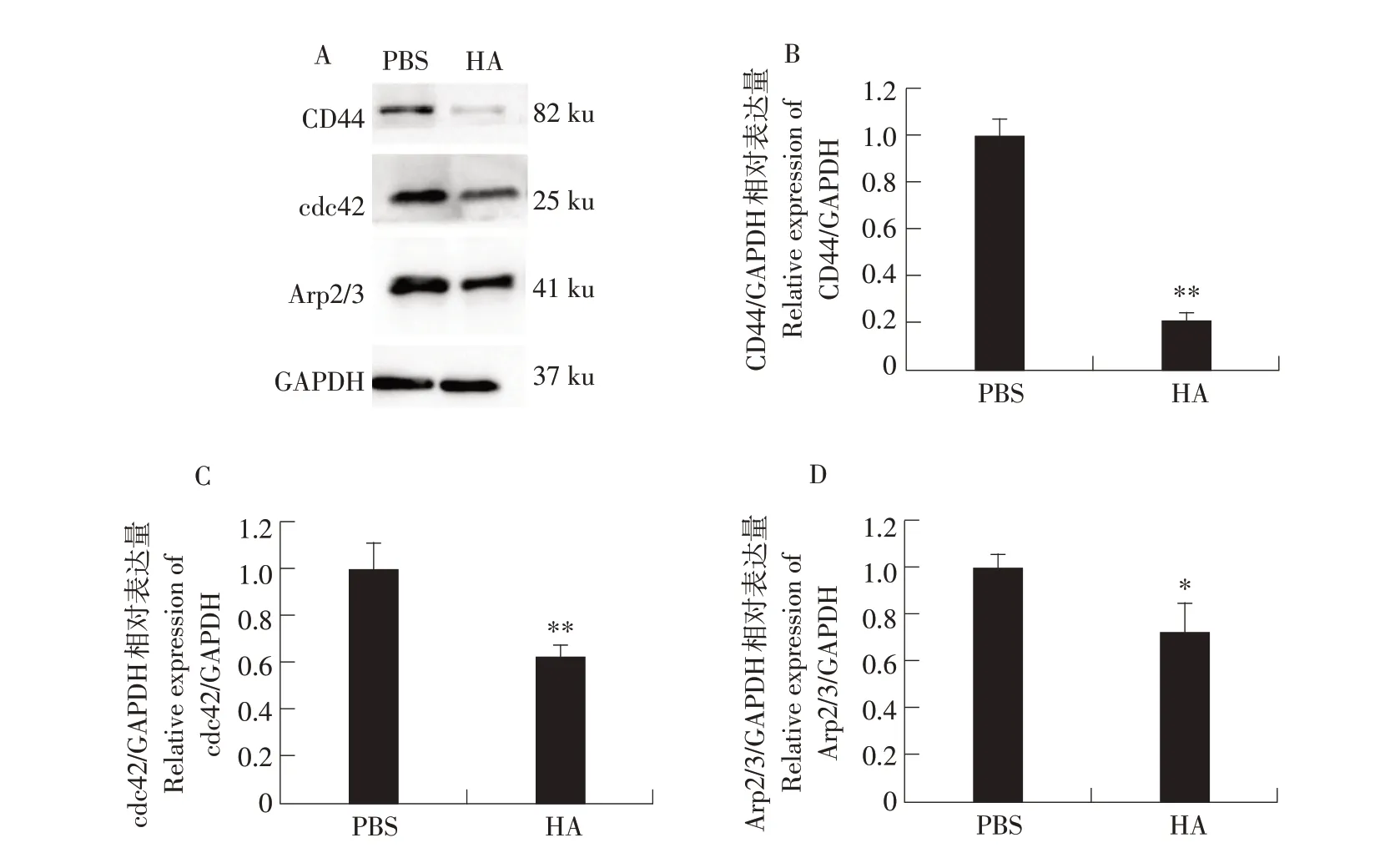
图3 高分子量透明质酸对RD细胞迁移相关蛋白表达的影响Fig.3 Protein expression related to cell migration impacted by high molecular weight hyaluronic acid in RD cells
2.4 高分子量透明质酸对RD细胞中CD44定位及微丝分布的影响
本研究采用细胞免疫荧光染色技术对RD细胞中CD44蛋白表达及微丝分布情况进行共定位染色。超高分辨显微镜观察结果显示CD44蛋白分布在RD细胞质膜区域,200 μg·mL-1高分子量透明质酸处理后,红色阳性荧光信号分布及强度显著减少和减弱(见图4)。微丝分布定位的荧光染色(绿色信号)结果显示,对照组细胞中,在CD44高表达的细胞质膜区域,微丝在局部聚集呈分枝状,提示此处微丝装配为细胞伪足并促进细胞迁移。高分子量透明质酸处理48 h后,细胞体积增大且伸展,同时CD44表达量降低,微丝呈现应力纤维的分布状态(见图4B)。此外,光学显微镜的观察结果显示200 μg·mL-1高分子量透明质酸处理RD细胞48 h后,并未影响RD细胞活性及状态(见图4A)。

图4 高分子量透明质酸对RD细胞中CD44定位及微丝分布的影响Fig.4 CD44 localization and microfilament distribution in RD cells impacted by high molecular weight hyaluronic acid
上述结果表明,CD44表达变化可能参与调节微丝动态装配过程,通过影响伪足形成而降低细胞迁移运动。
3 讨论
为明确高分子量透明质酸在RD细胞中可能的作用受体,本研究采用荧光定量RT-PCR法检测不同透明质酸的表达受体,HMMR、LAYN、HARE、Siglec9、TLR2和TLR4,结果表明CD44在RD细胞中表达水平最高,高分子量透明质酸处理显著下调CD44表达。Western blot蛋白表达的检测结果与荧光定量结果相符,即高分子量透明质酸可下调CD44蛋白表达水平,提示在RD细胞中,CD44可能作为高分子量透明质酸作用的靶点而影响细胞行为。
CD44属于单次跨膜的非激酶型糖蛋白,其在胚胎干细胞及多种细胞类型包括结缔组织和骨髓中表达[11]。CD44在多种癌细胞中表达上调并认为是肿瘤干细胞的标志分子[12]。透明质酸作为CD44配体,通过结合CD44胞外结构域,将细胞信号传递至CD44胞质结构域,激活细胞内一系列信号转导途径,引起细胞增殖、黏附、迁移及侵袭[13]。研究表明,肿瘤细胞发生上皮细胞-间充质转化(Epithelial mesenchymal transition,EMT)时,CD44表达上调[14]。临床病理学研究表明CD44可能是癌症治疗新靶点[15]。此外,CD44在维持肿瘤干细胞干性和治疗后肿瘤再生中发挥促进作用,提示其可能是一个重要肿瘤预后标志分子[16]。研究表明,横纹肌肉瘤组织中CD44表达与患者预后直接相关[17]。但CD44在横纹肌肉瘤进展中作用尚不明确。
细胞划痕试验结果表明,不同浓度高分子量透明质酸特别是200 μg·mL-1可显著抑制RD细胞迁移。免疫荧光染色的超高分辨观察结果表明,CD44高表达时,细胞内微丝主要集中在紧贴细胞质膜的细胞质区域,交联为丝状或分枝状的结构,表明其可能作为细胞丝状或片状伪足参与细胞迁移和运动。Rho家族小GTP酶作为分子开关,可调节细胞迁移和运动。Rho家族小GTP酶包括3个家族成员:Rac,Cdc42和Rho[18]。其中,Cdc42位于细胞运动前端,参与细胞迁移极性和方向。细胞外信号可在特定方向上激活细胞质膜附近的Cdc42,使细胞产生极性,发展为细胞运动前缘,同时可使微管骨架和内膜系统也产生极化。Cdc42通过WASP蛋白激活Arp2/3复合物,刺激分枝状微丝(片状伪足)的装配,而片状伪足是推动细胞前缘向前运动的关键结构[19]。研究表明Arp2/3复合物通过诱导肌动蛋白聚合为微丝,对促进细胞黏附、迁移和侵袭至关重要,增强肿瘤细胞转移和扩散能力[20]。
研究结果显示,CD44高表达时,微丝主要以丝状或分枝状形式存在于细胞质膜前端,推测其与RD细胞较强迁移能力有关。高分子量透明质酸处理后,CD44表达量极低,微丝改变其分布形式,贯穿于整个细胞,以应力纤维形式存在,使细胞形态更为铺展,提示其可能抑制细胞迁移,与蛋白表达检测结果相符,即CD44表达下调同时,Cdc42和Arp2/3表达量也显著降低,提示高分子量透明质酸处理可影响RD细胞伪足形成,抑制细胞迁移。但高分子量透明质酸为何下调CD44表达,是否通过转录水平抑制CD44表达,以及RD细胞中微丝分布变化与CD44表达关系的详细分子机制,仍待深入探索。高分子量透明质酸对于RD细胞迁移的抑制,可为研究肿瘤细胞转移和运动迁移提供新思路,具有重要应用价值。
4 结论
高分子量透明质酸可降低RD细胞中透明质酸受体CD44表达,通过抑制细胞伪足形成而抑制RD细胞迁移和运动,为横纹肌肉瘤疾病治疗提供新策略。
