不同水解方法对刺梨渣多酚含量及活性的影响
2022-02-07汪瑞敏刘丹丹李博岩
汪瑞敏,吴 箫,刘丹丹,周 玲,李博岩*
(1.贵州医科大学 公共卫生学院,贵州 贵阳 550025;2.贵州医科大学 环境污染与疾病监控省部共建教育部重点实验室,贵州 贵阳 550025)
刺梨(Rosa roxburghiiTratt.)又名茨梨、木梨子[1],多种于贵州、四川、云南等地区[2-3]。刺梨的营养价值极高[4],早在《本草纲目拾遗》中就有刺梨促进消化的记录[5],现代研究发现刺梨含有超氧化物歧化酶(superoxide dismutase,SOD)、多酚、三萜、黄酮、氨基酸、多糖、有机酸、矿物质等营养物质[6-8];这些营养物质在参与人体抗氧化反应、抗辐射、消炎和预防肿瘤等过程发挥重要作用[9]。作为刺梨种植大省,贵州的刺梨无论是品种还是产量均居全国首位。刺梨在贵州省的种植面积达15.3万hm2,2019年贵州省刺梨鲜果产量达6.6万t,贵州省内的刺梨加工企业每年用于榨汁加工的刺梨鲜果达4.4万t[10]。刺梨汁在加工过程会产生大量的果渣,这些果渣中含有较为丰富的多酚、黄酮、维生素C(vitamin C)、SOD和粗纤维[11],然而这些果渣通常在加工后被直接丢弃或者作为锅炉燃料[12],不仅污染环境,还造成资源浪费,因此刺梨果渣深加工的相关研究近年来相继出现,但是目前关于刺梨果渣的研究主要集中在刺梨果渣中膳食纤维利用[13]或果渣发酵饲料[12]等方面,而对于刺梨渣中多酚的再回收则鲜有报道。
植物中的多酚根据溶解性可分为可溶性多酚(游离酚)和不可溶多酚(结合酚);大约35%~65%的酚类化合物以结合酚形式存在于植物基质中。可溶性多酚可利用水溶液或水与有机溶剂混合后进行提取。而结合酚主要以酯键和醚键等形式与蛋白质等生物大分子物质结合,所以无法利用溶剂直接提取,一般经酸、碱或酶水解后再提取。王婧等[14]优化了酸水解提取紫甘薯结合酚的条件,并测其抗氧化能力,结果表明,水解时间28.15 h、水解温度60.5 ℃、液料比32∶1,结合酚提取量最高,其抗氧化能力显著提高。王振宇等[15]优化酸和碱水解提取鲜莲中结合酚的条件,其最佳提取工艺条件NaOH溶液浓度2.8 mol/L、料液比1∶25(g∶mL)、水解时间3.7 h。海玲等[16]利用纤维素酶提取赤霞珠葡萄皮渣中酚类物质,最终多酚提取率达到11.238%。
本实验以刺梨渣为原料,通过酸水解、碱水解、酶水解3种方式提取刺梨渣中的结合酚;并对刺梨渣中游离酚和结合酚的组成、含量、抗氧化活性进行了系统的研究。旨在为刺梨渣的综合利用提供理论依据和数据支撑。
1 材料与方法
1.1 材料与试剂
刺梨:市售;七水硫酸亚铁、六水三氯化铁、无水氯化铝(均为分析纯):上海国药化学试剂集团公司;2,2-联苯基-1-苦基肼基(2,2-diphenyl-1-picrylhydrazyl,DPPH)、三吡啶基三嗪(tri-2-pyridyl-s-triazine,TPTZ)、2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、福林酚、新铜试剂(2,9-二甲基-1,10-菲罗啉)、水溶性维生素E(Trolox)、没食子酸、表没食子儿茶素、儿茶素、绿原酸、表儿茶素、咖啡酸、对香豆酸、芦丁、异槲皮素、斛皮苷、杨梅素、根皮苷、木犀草素、槲皮素、山奈酚(纯度均≥98%):北京索莱宝生物科技有限公司。
1.2 仪器与设备
Scientz-50F真空冷冻干燥机:宁波新芝生物科技股份有限公司;YB-400粉碎机:永康市红太阳机电有限公司;HS-50恒温恒湿箱:南京泰特斯试验设备有限公司;GRQ-1200超声波清洗机:昆山市超声仪器有限公司;H1650R冷冻离心机:济南欧莱博科学仪器有限公司;RE-52A旋转蒸发仪:上海亚荣生化仪器厂;Agilent1260高效液相色谱(high performance liquid chromatography,HPLC)仪:安捷伦科技有限公司;Multiskan FC酶标仪:赛默飞世尔上海仪器有限公司。
1.3 方法
1.3.1 原料预处理
刺梨渣粉末:刺梨洗净去籽,切成小块,经压榨去汁,剩余的刺梨渣冷冻干燥研成粉末,过60目筛置于干燥器中备用。
1.3.2 游离酚的提取
参考朱昱琳等[17]的方法,稍作修改;取刺梨渣粉末1 g加入20 mL 80%甲醇溶液(含1%甲酸),超声提取30 min(室温,320 W),离心(4 500 r/min,10 min,4 ℃)去上清,取残留物加入40 mL甲醇溶液,重复上述步骤,离心后两次上清液合并,即获得游离酚(F)。残渣于55 ℃的烘箱中干燥至质量恒定,研成粉末,备用。
1.3.3 结合酚的提取
(1)酸水解提取结合酚
参考WANG L等[18]的方法,稍作修改。取1.3.2残渣粉末1 g加40 mL 2 mol/L HCl超声(70 ℃,60 min,300 W)后加10 mol/L NaOH 调节pH至2,然后离心(4 500 r/min,5 min),上清液用乙醚和乙酸乙酯等体积混合萃取两次,45 ℃旋转蒸干后再用50%乙醇复溶得到A1;离心后残渣继续加酸二次水解,重复上述步骤,得到A2;A1、A2均存放于-20 ℃,备用。
(2)碱水解提取结合酚
参考LI W 等[19]的方法,稍作修改。取1.3.2残渣粉末1 g加40 mL 2 mol/L NaOH,超声(70 ℃,60 min,300 W)后加6 mol/L HCl调节pH=2,然后离心(4 500 r/min,5 min),上清液用乙醚和乙酸乙酯等体积混合萃取两次,旋转蒸发仪45 ℃避光蒸干后再用50%乙醇溶解得到B1;离心后残渣加碱水解,重复上述步骤,得到B2;B1、B2均存放于-20 ℃,备用。
(3)酶水解提取结合酚
参考杨希娟等[20-21]的方法,稍作修改。取1.3.2残渣粉末1 g加入0.02 g半纤维素酶、0.01 g纤维素酶、0.01 g果胶酶和15 mL水,于85 ℃,320 W 超声30 min,4 500 r/min离心5 min,上清液用等体积的乙醚和乙酸乙酯混合液(1∶1,V/V)萃取两次,萃取液置于旋蒸瓶中,45 ℃蒸干后再用体积分数50%乙醇复溶得到C1;重复上述步骤,得到C2;C1、C2均存放于-20 ℃,备用。
(4)刺梨渣提取液中总多酚和总黄酮含量测定
采用Folin-Ciocalteu(福林酚比色法)测定总多酚含量[22],以没食子酸为标准品,制作标准曲线,所得回归方程为:Y=0.114X+0.006(R2=0.999 4)。所得结果用每克刺梨渣样品干质量中没食子酸当量(gallic acid equivalents,GAE)表示(mg GAE/g),以干质量计。
总黄酮含量的测定参照WANG L等[23]的方法并略作修改,具体步骤为:吸取25 μL适当稀释倍数的提取液于试管中,加入110 μL 0.066 mol/L亚硝酸钠,摇匀,反应5 min后加入15 μL 0.75 mol/L的氯化铝,摇匀,静置6 min,再加入100 μL 0.5 mol/L 氢氧化钠反应10 min,以水代替样品为空白调零,在波长510 nm处测定吸光度值。以芦丁为标准品,配制不同梯度的溶液,制作标准曲线,建立回归方程:Y=0.000 3X+0.001(R2=0.994 4),所得结果用每克刺梨渣样品(以干质量计)中芦丁当量(rutin equivalents,RE)表示(mg RE/g)。
1.3.4 刺梨渣提取液多酚高效液相色谱分析
刺梨渣提取液中多酚含量的测定采用HPLC法。色谱条件如下:色谱柱:Lichrospher C-18;流速:0.5 mL/min;进样量:10 μL;柱温:30 ℃;检测器:二极管阵列检测器(diode array detector,DAD);检测波长:全波长扫描,使用254nm、280 nm、320 nm、360 nm四个参比波长,以280 nm为主要观测波长;流动相0.2%磷酸(A)、乙腈(B);梯度洗脱程序:0~5 min,98% B;5~30 min,95% B;30~40 min,79%B;40~41 min,79%B;41~65 min,54%B;65~70 min,30%B;70~75 min,0%B;75~80 min,98%B;80~85 min,98%B。根据保留时间定性,峰面积定量。
1.3.5 刺梨渣多酚提取液抗氧化活性测定
(1)DPPH自由基清除率的测定
参照WANGL等[21]的方法,取50μL样品稀释液或Trolox标准液与100 μmol/L 400 μL DPPH-甲醇溶液在室温下避光反应30min,在波长517nm下测量吸光度值。以Trolox作为阳性对照并绘制标准曲线:Y=1.146 1X-2.175 7(R2=0.998 4),DPPH自由基清除率按式(1)计算。
其中:Ai为样品溶液加DPPH试剂混合液的吸光度值,Aj为样品溶液加甲醇的吸光度值,Ac为DPPH溶液加样品溶剂的吸光度值。
(2)ABTS+自由基清除率的测定
参考ZENGIN G等[24]的方法略作修改。取50 μL样品稀释液或Trolox标准液分别与400 μL ABTS+稀释液充分混合,室温下避光反应30 min,测定波长734 nm处的吸光度值。Trolox作为阳性对照并绘制标准曲线:Y=2.089 9X+0.536 2(R2=0.998 7),ABTS+自由基清除率按式(2)计算;
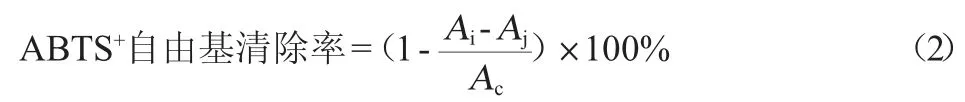
其中:Ac为ABTS+和样品溶剂混合液的吸光度值,Ai为ABTS+和样品混合液的吸光度值,Aj为80%甲醇和样品溶液的吸光度值。
(3)铁离子还原能力的测定
参考LIU L等[25]的铁离子还原法(ferric ion reducing antioxidant power,FRAP),30 μL样品稀释液或Trolox标准液与900 μL FRAP试剂[25]混合,在室温下避光孵育30 min,在波长593 nm处测定吸光度值。以Trolox作为阳性对照并绘制标准曲线:Y=0.010 1X+0.002(R2=0.999 8)。通过吸光度值计算还原力。
(4)铜离子还原能力的测定
参考UYSAL S等[26]的铜离子还原能力(cupric ion reducing antioxidant capacity,CUPRAC)方法略作修改,取10 μL样品稀释液或不同浓度的Trolox标准品,加入100 μL硫酸铜溶液(5 mmol/L)、100 μL新铜试剂(3.75 mmol/L)和100 μL乙酸铵(1 mol/L)缓冲液,再加入100 μL水,摇匀,避光反应30min,于波长450nm处测定吸光度值。Trolox作为阳性对照并绘制标准曲线:Y=0.000 9X+0.006 3(R2=0.995 5)。通过吸光度值计算还原力。
DPPH·清除率、ABTS+·清除率、FRAP、CUPRAC结果用每克样品(以干质量计)具有相同抗氧化能力所需μmol Trolox的当量表示(Trolox equivalents,TE)/g。
1.3.6 数据处理与分析
所有实验重复3次,数据以“平均值±标准差”(x¯±s)表示,采用SPSS 18.0进行方差分析和Pearson相关性分析,采用Origin8.0软件作图。
2 结果与分析
2.1 刺梨渣提取液中的多酚和黄酮含量
不同水解方法所得刺梨渣提取液中多酚、黄酮含量结果见图1。由图1可知,刺梨渣中游离酚(84.44 mg GAE/g)、黄酮(136.67 mg RE/g)含量最高,游离酚、游离黄酮与不同水解方式得到的提取液中多酚、黄酮的含量存在显著性差异(P<0.05)。采用碱水解得到的B1提取液中多酚(2.04 mg GAE/g)、黄酮(5.89 mg RE/g)含量最高;B1提取液中的多酚含量显著高于其他水解方式(P<0.05),但黄酮含量则与其他水解方式无明显差异;酶水解得到的C1和C2提取液中多酚分别为0.84 mg GAE/g、0.49 mg GAE/g和黄酮分别为2.27 mg RE/g、0.82 mg RE/g;酸水解得到A2提取液中的总多酚(0.30 mg GAE/g)、黄酮(0.45 mg RE/g)含量最低。LI W等[19]研究发现碱水解相较于酸水解能释放更多苹果渣中的结合酚,与本研究结果一致,说明碱水解在提取水果残渣中的结合酚方面具有更好的效果。以上研究结果表明刺梨渣中仍存在较高含量多酚,应加以利用,避免资源浪费。

图1 不同水解方式刺梨渣提取液中的多酚、黄酮含量Fig.1 Contents of polyphenols and flavonoids in extraction solutions of Rosa roxburghii Tratt pomace by different hydrolysis methods
2.2 刺梨渣提取液中游离酚、结合酚组成分析
对刺梨渣水解产物多酚构成进行了HPLC分析,通过对比15种标准品的保留时间和峰面积,确定刺梨渣水解产物中酚类化合物组成和含量。刺梨渣提取液中游离酚和结合酚的色谱图和含量如图2、表1所示。

图2 刺梨渣不同提取液中多酚类化合物色谱图Fig.2 Chromatograms of polyphenols in different extraction solutions of Rosa roxburghii Tratt pomace

表1 不同水解方式刺梨渣提取液的多酚类化合物含量Table 1 Contents of polyphenols in extraction solutions of Rosa roxburghii Tratt pomace by different hydrolysis methods
由图2和表1可知,F中酚类物质种类最丰富(15种),其次为C1(11种)、B1(10种),最少的为B2(5种);三种水解方式中共有的结合态酚类物质有没食子酸、儿茶素、绿原酸、芦丁等;酸水解中独有的结合态酚类物质为表没食子儿茶素(1.17 μg/g),碱水解中独有的结合态酚类物质为槲皮素(11.31 μg/g),酶水解中为杨梅素(8.10 μg/g)、根皮苷(305.48 μg/g)。此外,由于供试液相标准品有限,导致未能对一些含量较高的物质进行定性,如A1、A2中出现的未知峰(u)。
在游离酚提取液F中,含量较高的是绿原酸(14.83mg/g),儿茶素(2.28 mg/g),对香豆酸(1.81 mg/g),芦丁(0.58 mg/g),而含量最低的是表没食子儿茶素(6.01 μg/g)。酸水解提取液A中共检测到10种酚类物质,含量最高的是没食子酸(311.64 μg/g);碱水解提取液B中含量较高的酚类物质分别是没食子酸(576.87 μg/g)、芦丁(335.46 μg/g)、绿原酸(325.98 μg/g);酶水解提取液C中含量较高的酚类物质分别是绿原酸(3.02 mg/g)、没食子酸(542.25 μg/g)、根皮苷(305.48μg/g)。不同水解方式得到的结合酚中除了酸水解提取液A1中含有表没食子儿茶素,其他提取液中均未见检测到。
单体酚的含量整体变化规律为:游离酚>结合酚,但是没食子酸和根皮苷水解后的含量较游离酚均有不同程度的增加,说明在刺梨渣中这两种酚类物质多以结合态形式存在,经水解处理才能释放。
2.3 刺梨渣多酚提取液体外抗氧化活性
不同水解方式所得刺梨渣提取液的抗氧化能力如图3所示,结果表明,刺梨渣提取液中游离酚、结合酚的DPPH·清除率、FRAP变化趋势和多酚含量变化趋势相似,其中游离酚的DPPH·清除率、FRAP抗氧化活性最强,分别为854.87 μmol TE/g和336.24 μmol TE/g,与其他提取液的抗氧化活性存在显著性差异(P<0.05)。三种水解方式中,碱水解的提取液B1的DPPH·清除率、FRAP明显高于另外两种水解方式(P<0.05),分别为15.34 μmol TE/g和5.57 μmol TE/g;抗氧化能力最低的则为A2,其DPPH·清除率、FRAP分别为2.49 μmol TE/g和0.74 μmol TE/g。ABTS+·清除率和铜离子还原能力的变化趋势则与黄酮含量变化趋势相似,游离酚抗氧化活性最强,分别为995.35 μmol TE/g和1 212.08 μmol TE/g;另外三种水解方式刺梨渣提取液的ABTS+·清除率和铜离子还原能力无显著性差异(P>0.05)。

图3 不同水解方式刺梨渣提取液的抗氧化活性Fig.3 Antioxidant activity of extraction solutions of Rosa roxburghii Tratt pomace by different hydrolysis methods
刺梨渣提取液中总酚、总黄酮、单体酚含量与抗氧化能力的相关性分析结果见表2。结果表明多酚、黄酮含量与抗氧化能力之间存在极显著正相关(P<0.01)。与许泽文等[27-29]报道发现的多酚含量与抗氧化能力呈正相关的结果一致。单体酚中除了没食子酸和根皮苷与总酚、总黄酮含量和抗氧化活性之间无相关性之外(P>0.05),其余单体酚均与抗氧化活性存在极显著相关性(P<0.01)。没食子酸和根皮苷主要以结合酚形态存在,说明酚类物质的抗氧化活性可能与其存在的形态有关;且游离酚含量越高,抗氧化活性越强。这与白姗姗等[31-32]研究发现,样品原料的抗氧化能力与它的多酚、黄酮的含量、组成等相关的结果一致。

表2 刺梨渣提取液中总酚、总黄酮、单体酚含量与抗氧化能力的相关性Table 2 Correlation between contents of total phenols,total flavonoids,mono phenols in extraction solutions of Rosa roxburghii Tratt pomace and antioxidant ability
3 结论
水解方式对刺梨渣酚类含量和组成、抗氧化活性均具有一定的影响,其中碱水解相较于酸水解和酶水解,具有更高的提取效率,碱水解所得酚类含量、抗氧化活性均优于另外两种方式。刺梨渣中游离酚、黄酮含量最高,主要成分有绿原酸、儿茶素、对香豆酸等。碱水解得到的提取液中B1中结合多酚、结合黄酮含量最高;没食子酸和根皮苷这两种种酚类物质则主要以结合态的形式存在于刺梨渣中。由皮尔逊相关系数分析可知多酚、黄酮含量与抗氧化能力之间存在显著相关性,且相关性与酚类物质的形态有关,以结合态存在的酚类与抗氧化能力相关性弱。综上,刺梨渣富含酚类物质,具有较强的抗氧化活性,此研究为进一步研究刺梨渣中的酚类物质提供了一定的理论基础,对刺梨渣开发利用有一定的参考价值。
