枯草芽孢杆菌发酵豆渣制备多肽及其活性研究
2022-02-07尹乐斌李乐乐刘桠丽杨学为罗雪韵
尹乐斌,李乐乐,何 平,刘桠丽,杨学为,罗雪韵
(1.邵阳学院 食品与化学工程学院,湖南 邵阳 422000;2.豆制品加工与安全控制湖南省重点实验室,湖南 邵阳 422000)
豆渣是豆制品加工中常见的副产物之一,富含大豆异黄酮、膳食纤维、低聚糖、有机酸等营养物质[2-5],常被用作动物饲料或废弃物丢掉[1]。据统计,我国每年会产生约200万t湿豆渣,新鲜豆渣豆腥味重且容易腐败变质,处理成本较高[6-7]。大豆多肽是由大豆蛋白经过酶解或发酵形成的肽基蛋白水解物,其具有抗氧化、抗疲劳、降血压、降胆固醇等生物活性[8-13]。
枯草芽孢杆菌(Bacillus subtilis)作为一种益生菌,生长速度快,安全性较高,可分泌蛋白酶、淀粉酶等丰富的酶系[14-15],常用于食品和动物饲料工业生产中。枯草芽孢杆菌生长过程中会产生部分有显著的抑菌活性的次级代谢产物(如脂肽类、抗菌蛋白等)[16-17],曾国洪等[18]研究对枯草芽孢杆菌HS-A38进行诱变筛选出高产抗菌脂肽菌株,并得到抗菌脂肽,其具有较好耐酸碱和热稳定性。
以经纤维素酶酶解后的豆渣为原料,利用枯草芽孢杆菌液态发酵豆渣制备大豆多肽,通过单因素试验及响应面法优化大豆多肽制备工艺,并测定其对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzoth iazoline-6-sulfonic acid),ABTS)自由基清除能力与抑制金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)生长的性能。以期为豆渣高值化利用和活性多肽产品的研究提供理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
豆渣:豆制品加工与安全控制湖南省重点实验室提供。
枯草芽孢杆菌(Bacillus subtilis):北海群林生物工程有限公司;金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli):实验室保存菌种。
1.1.2 试剂
三氯乙酸(分析纯):天津市科密欧化学试剂有限公司;胰蛋白胨(生化试剂):北京陆桥技术股份有限公司;NaCl(分析纯):国药集团化学试剂有限公司;牛血清蛋白(生化试剂):北京鼎国昌盛生物技术有限公司;ABTS(分析纯):合肥巴斯夫生物科技有限公司;DPPH(分析纯):上海如吉生物科技有限公司;维生素C(vitamin C,VC)(分析纯):西陇科学股份有限公司;纤维素酶(8 000 U/g):山东和众康源生物科技有限公司。
1.2 仪器与设备
SCIENTZ-10N冷冻干燥机:宁波新芝生物科技股份有限公司;VELOCITY 14R台式冷冻离心机:美国Dynamica公司;IS-RDD3 恒温摇床:苏州捷美电子有限公司;D-7型紫外分光光度计:南京菲勒仪器有限公司。
1.3 方法
1.3.1 菌种活化与培养
枯草芽孢杆菌、金黄色葡萄球菌及大肠杆菌的活化培养参考文献[19-20]。
1.3.2 大豆多肽的制备
收集新鲜豆渣并利用精细磨湿法粉碎,调整豆渣干基为5.8%,纤维素酶水解(8 000 U/g,50 ℃水解6 h)豆渣得到豆渣酶解液,80 ℃灭酶10 min(调整pH 7.2)。将酶解液接种枯草芽孢杆菌液态发酵(接种量3%、发酵温度37 ℃,发酵时间60 h)。发酵液10 000 r/min冷冻离心15 min后取上清液,经冷冻干燥即得大豆多肽粗提物。多肽得率参考文献[21]。
1.3.3 发酵豆渣制备大豆多肽工艺优化
单因素试验:以50 mL豆渣酶解液为原料接种枯草芽孢杆菌进行发酵,探究接种量(1%、3%、5%、7%、9%)、发酵时间(24 h、36 h、48 h、60 h、72 h)、发酵温度(23 ℃、30 ℃、37℃、44℃、51℃)、摇床转速(120r/min、130r/min、140r/min、150 r/min、160 r/min)对大豆多肽得率的影响。
响应面试验:在单因素试验基础上,以大豆多肽得率(Y)为响应值,选择对多肽得率影响较大的接种量(A)、发酵温度(B)、发酵时间(C)进行响应面优化试验,确定最佳的发酵豆渣制备大豆多肽工艺,因素与水平见表1。
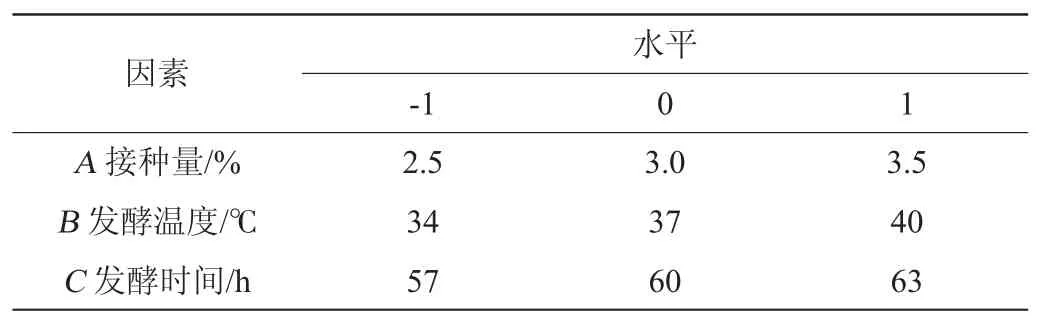
表1 发酵豆渣制备大豆多肽工艺优化因素与水平Table 1 Factors and levels for soybean polypeptide preparation process optimization of fermented soybean dregs
1.3.4 多肽的抗氧化性
在最佳发酵工艺下条件发酵豆渣,冷冻干燥得到大豆多肽。以VC为阳性对照,通过ABTS溶液和DPPH溶液[22]测定大豆多肽粗提物的抗氧化活性。
1.3.5 多肽的抑菌活性
利用平板计数法将两个指示菌(金黄色葡萄球菌、大肠杆菌)制备成107CFU/mL菌悬液,利用牛津杯法测抑菌圈直径大小[23]。
1.3.6 数据处理
运用SPSS22.0、Design-Expert8.0.6.1软件进行数据分析。
2 结果与分析
2.1 发酵豆渣制备大豆多肽工艺优化单因素试验结果
2.1.1 接种量的确定
由图1可知,随着接种量在1%~3%范围内的增加,大豆多肽的得率呈增加趋势。当接种量为3%,大豆多肽的得率达到最高,为84.79%,继续增加接种量至9%,大豆多肽的得率开始下降。其原因可能是,起初接种量较低,产生的蛋白酶量少,不足以分解豆渣中的蛋白质,故而使得多肽得率较低。随着接种量增加,产生的蛋白酶量较充足,多肽得率逐渐提高。接种量过高,而发酵体系中营养物质有限,会抑制菌体生长,进而降低其产酶能力[24],导致多肽得率下降。因此,选择最佳的菌种接种量为3%。
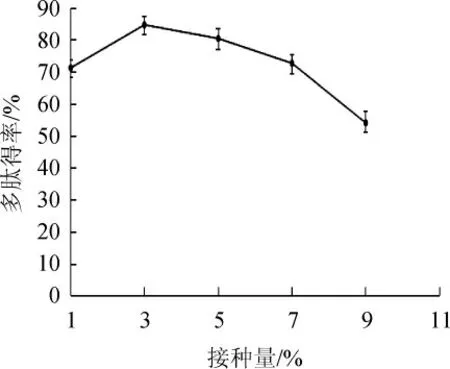
图1 接种量对多肽得率的影响Fig.1 Effect of inoculum on polypeptide yield
2.1.2 发酵时间的确定
由图2可知,随着发酵时间在24~60 h范围内的增加,大豆多肽得率呈增加趋势。当发酵时间为60 h时,大豆多肽得率达到85.02%。当发酵时间>60 h,大豆多肽得率下降。其原因可能是,发酵初期菌种处于适应期,菌种生长缓慢,产酶量不足,多肽得率处在较低水平,随着发酵时间延长,菌种生长逐渐平稳,产酶量饱和,蛋白酶水解豆渣大分子蛋白形成多肽[25]。然而继续延长发酵时间,体系中代谢废物较多,导致溶氧量不足而影响酶的合成。同时,蛋白酶会过度水解导致多肽得率降低,这与李景等[26]的研究结果相似。因此,选择最佳发酵时间为60 h。
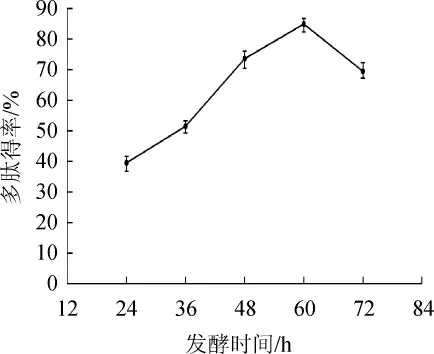
图2 发酵时间对多肽得率的影响Fig.2 Effect of fermentation time on polypeptide yield
2.1.3 发酵温度对多肽得率的影响
由图3可知,随着发酵温度在23~37 ℃范围内的升高,大豆多肽的得率呈增加趋势。当发酵温度为37 ℃时,大豆多肽的得率达到最高值,为86.22%。发酵温度高于37 ℃时,大豆多肽的得率下降。其原因可能是,温度较低时,枯草芽孢杆菌处于迟缓期的时间延长,菌种生长缓慢,产酶不足使得多肽得率较低,随着发酵温度升高,菌种生长加速,产生大量蛋白酶,多肽得率也随之提高,而过高的温度会抑制菌体生长,从而导致多肽得率下降,由此看出枯草芽孢杆菌生长需要适宜的温度。因此,选择最佳发酵温度为37 ℃。

图3 发酵温度对多肽得率的影响Fig.3 Effect of fermentation temperature on polypeptide yield
2.1.4 摇床转速对多肽得率的影响
由图4可知,随着摇床转速在120~150 r/min范围内的增加,大豆多肽得率呈增加趋势。当摇床转速为150 r/min时,大豆多肽得率达到85.75%。摇床转速>150 r/min时,大豆多肽得率下降。其原因可能是,枯草芽孢杆菌是一种好养型细菌,当摇床转速过低时,发酵体系中溶氧量不足,致使菌种生长缓慢[26],产酶量低,不足以分解豆渣中的蛋白质,使得多肽得率较低,而摇床转速过快时,其产生的高剪切力会破坏菌体细胞,抑制了菌体生长,进而导致多肽得率下降。因此,选择最佳摇床转速为150 r/min。
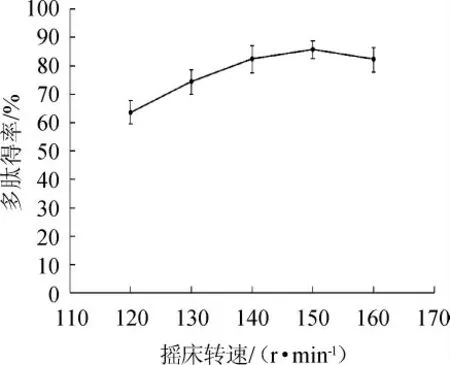
图4 摇床转速对多肽得率的影响Fig.4 Effect of shaking speed on polypeptide yield
2.2 大豆多肽制备工艺优化响应面试验
2.2.1 响应面设计及结果
在单因素试验基础上,以多肽得率(Y)为响应值,选择对多肽得率影响较大的菌种接种量(A)、发酵温度(B)发酵时间(C)进行3因素3水平的响应面优化试验,试验结果见表2,方差分析结果见表3。
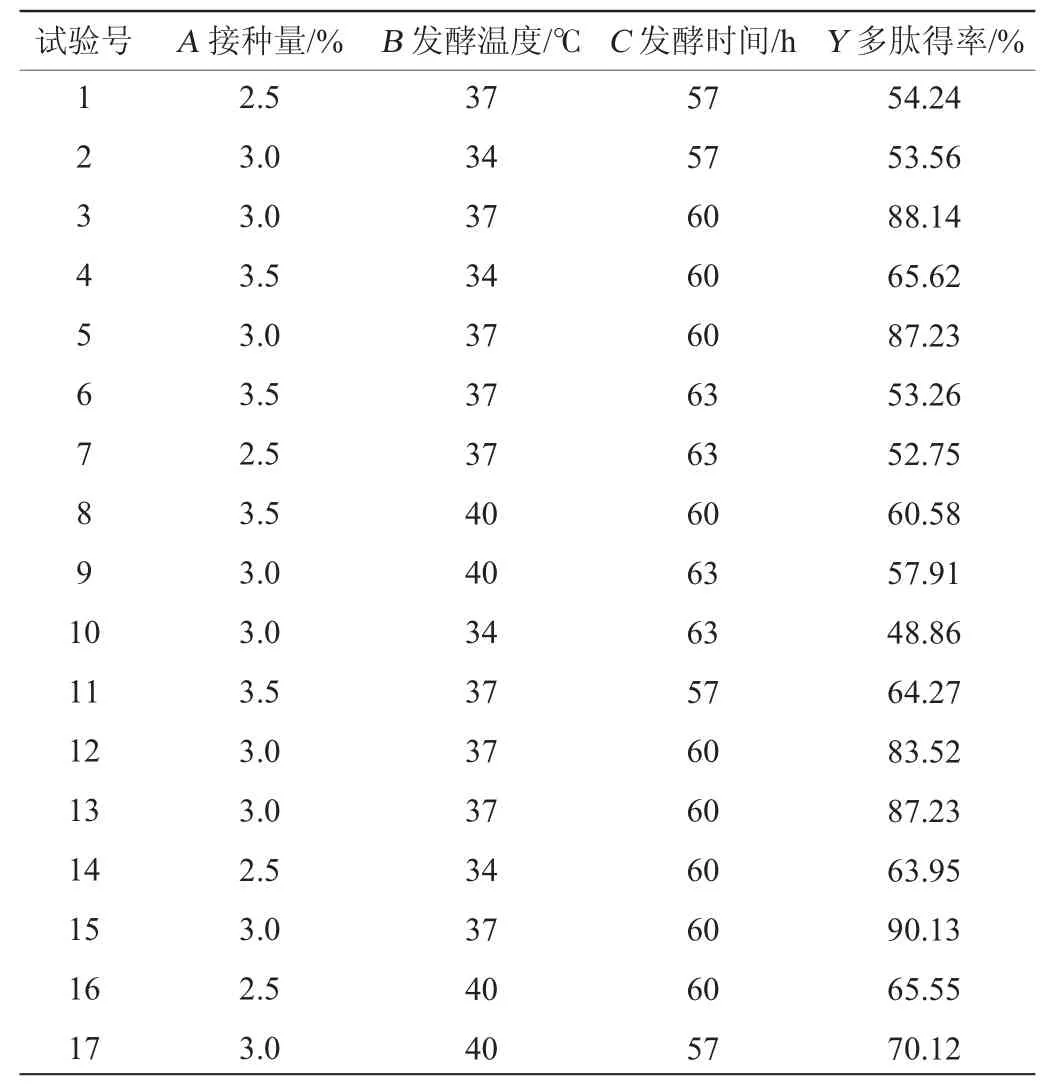
表2 大豆多肽制备工艺优化响应面试验设计及结果Table 2 Design and results of response surface tests for soybean polypeptide preparation process optimization
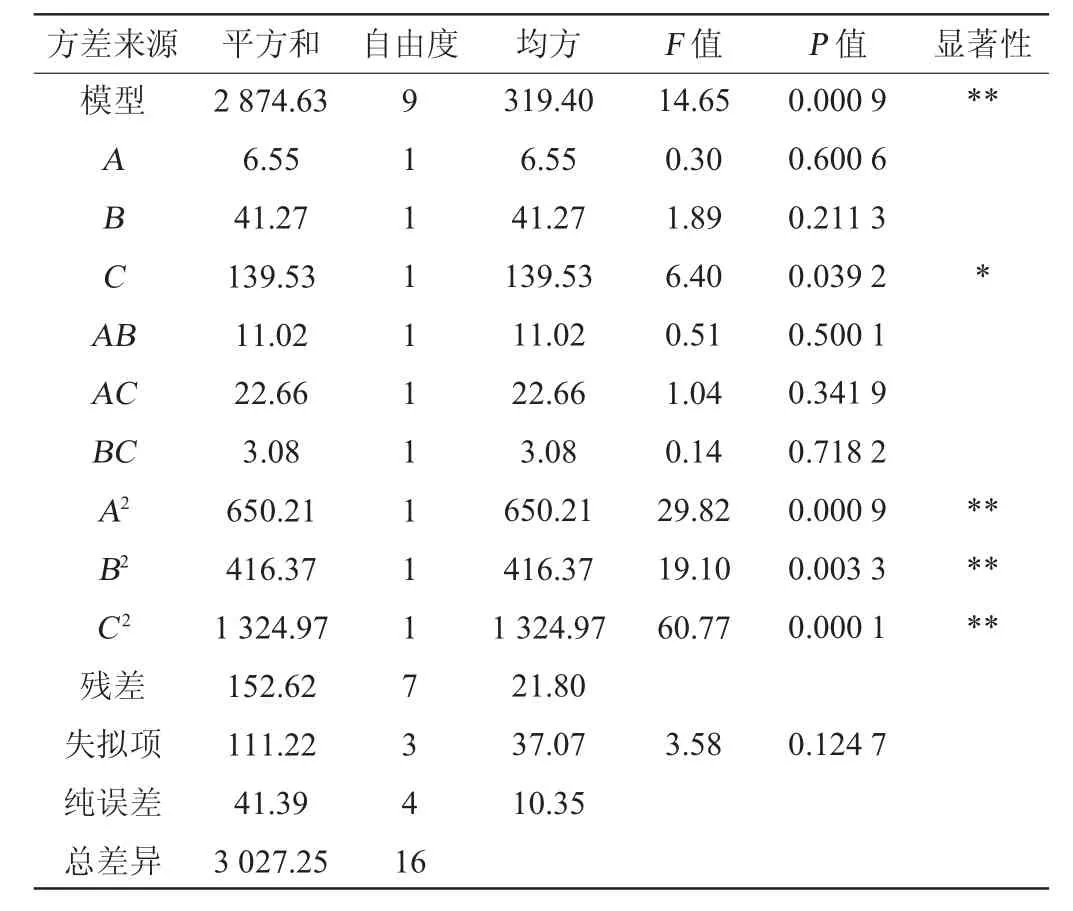
表3 回归模型的方差分析Table 3 Variance analysis of regression model
利用Design-Expert V 8.0.6.1软件对大豆多肽得率进行回归拟合后,得到大豆多肽的二次多项回归方程为:

对模型进行显著性分析,由表3可知,模型P=0.000 9<0.01,模型极显著;失拟项P=0.124 7>0.05,失拟不显著;决定系数R2=0.949 6,说明此模型拟合度较好,校正决定系数R2adj=0.884 8,可用该模型来预测发酵体系中多肽得率的实际情况。一次项C对大豆多肽得率的影响显著(P<0.05),二次项A2、B2、C2均对大豆多肽得率的影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。由F值得出影响多肽得率的3个因素的主次顺序为发酵时间>发酵温度>接种量。
2.2.2 响应面结果验证性试验
根据响应面试验模型结果计算可知,大豆多肽制备的最佳工艺条件为接种量3.02%,发酵温度37.35 ℃,发酵时间59.63 h。在此优化条件下,枯草芽孢杆菌发酵豆渣得到的多肽得率为86.70%。为实际操作考虑,3个因素修正为接种量3%,发酵温度37 ℃,发酵时间60 h,重复3次,多肽得率的平均值为88.12%,与预测值接近。说明该回归模型可以为实际操作提供指导。
2.3 大豆多肽的抗氧化能力
由图5(a)可知,VC质量浓度在0~0.008 mg/mL范围内增加,VC对DPPH自由基清除率显著上升,当VC质量浓度≥0.008 mg/mL时,DPPH自由基清除率趋于稳定,当VC质量浓度为0.016 mg/mL时,DPPH自由基清除率接近100%;当多肽样品质量浓度在0~6.250 mg/mL之间时,样品对DPPH自由基清除率显著上升,多肽样品质量浓度>6.250 mg/mL时,DPPH自由基清除率趋于稳定,并且在样品质量浓度为25mg/mL时,对DPPH自由基清除率达到91.71%。
由图5(b)可知,随着VC质量浓度在0~0.008 mg/mL范围内增加,对ABTS自由基清除率显著上升。当VC质量浓度≥0.008 mg/mL时,ABTS自由基清除率趋于稳定,对ABTS自由基清除率接近100%;当多肽样品质量浓度在0~6.250 mg/mL范围内增加时,多肽样品对ABTS自由基清除率显著上升,样品质量浓度≥6.250 mg/mL时,对ABTS自由基的清除率缓慢提高,在样品质量浓度为25 mg/mL时,对ABTS自由基清除率为89.68%。
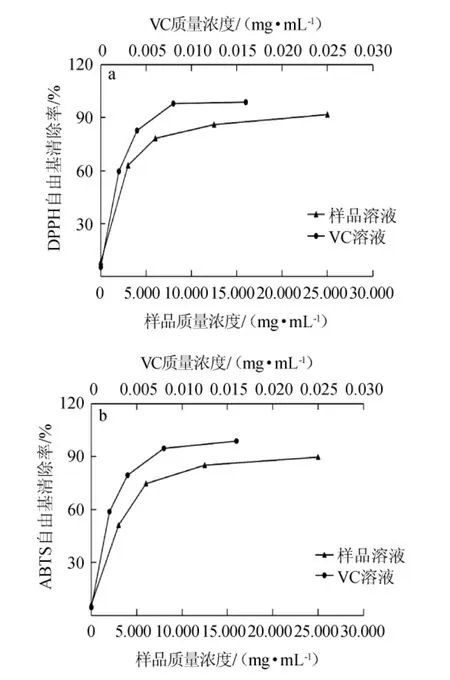
图5 VC及大豆多肽样品对DPPH自由基(a)和ABTS自由基(b)的清除率Fig.5 Scavenging rates of VC and soybean polypeptides samples on DPPH radical (a) and ABTS radical (b)
VC和样品对DPPH自由基清除能力的半效应浓度(median effect concentration,EC50)分别为0.001 5 mg/mL,(2.36±0.05)mg/mL时,VC和大豆多肽样品对ABTS自由基清除率EC50分别为0.001 7 mg/mL,(2.97±0.03)mg/mL,说明样品对DPPH自由基和ABTS自由基均具有一定清除能力,但与VC相比,其抗氧化能力较弱。
2.4 大豆多肽的抑菌活性
以无菌水作空白对照,发酵豆渣制备的多肽抑菌效果见图6。由图6可知,其对金黄色葡萄球菌和大肠杆菌没有抑制效果,大豆多肽作用两菌后出现明显的抑菌圈,当多肽质量浓度为25 mg/mL时,大肠杆菌和金黄色葡萄球菌抑菌圈直径分别为(27.65±0.32)mm、(23.18±0.14)mm,且大豆多肽对大肠杆菌的抑菌活性强度高于金黄色葡萄球菌。
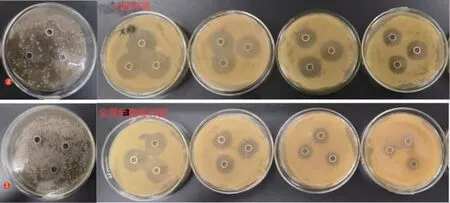
图6 大豆多肽样品的抑菌效果Fig.6 Antibacterial effect of soybean polypeptide samples
3 结论
枯草芽孢杆菌发酵豆渣制备大豆多肽的最佳工艺条件为:接种量3%,发酵温度37 ℃,发酵时间60 h。在此优化条件下,枯草芽孢杆菌发酵豆渣得到的多肽得率为88.12%。抗氧化实验结果表明,多肽样品对DPPH自由基和ABTS自由基清除能力的EC50分别为(2.36±0.05)mg/mL、(2.97±0.03)mg/mL,抑菌性能实验结果表明,大豆多肽质量浓度为25 mg/mL时,对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别为(27.65±0.32)mm、(23.18±0.14)mm。本研究对减少豆渣的浪费,降低环境污染,提高豆渣高值化利用提供了一定的理论基础。
