改良型富血小板纤维蛋白在面部皮肤癌术后软组织缺损修复中的应用
2022-02-05李相龙陈文斌谢永峰丁志龙李雪阳
李相龙, 陈文斌, 谢永峰, 丁志龙, 李雪阳
恶性非黑色素瘤皮肤癌(non-melanoma skin cancer,NMSC)是较常见的皮肤恶性肿瘤之一,其中基底细胞癌(basal cell carcinoma,BCC)和鳞状细胞癌(squamous cell carcinoma,SCC)占NMSC的99%[1]。头面部NMSC的治疗首选手术,手术的组织缺损易造成外观畸形影响患者的心理健康[2-3]。皮片移植是修复组织缺损的最佳选择,腹部皮片的制备较为简单,具有较高的成功率[4]。改良型富血小板纤维蛋白(advanced platelet-rich fibrin,A-PRF)可促进软组织中的胶原合成,有效减少瘢痕的形成,促进组织修复,且可通过自体静脉全血离心得到,安全性较高[5]。A-PRF联合腹部全厚皮片移植在面部皮肤癌术后软组织缺损修复中的应用,目前报道较少。本研究分析A-PRF联合腹部全厚皮片移植在面部皮肤癌术后软组织缺损修复中的应用效果,旨在为修复面部皮肤癌术后软组织缺损提供新的治疗方法。现报道如下。
1 资料与方法
1.1 一般资料 收集2020年1月至2022年6月徐州医科大学附属淮安医院收治的80例行面部皮肤癌术后需行全厚皮片移植的患者。纳入标准:①符合面部皮肤癌的相关诊断标准[6],并经过术后病理检查确诊;②18~65岁;③能够耐受全身麻醉;④患者及其家属均同意手术并签署知情同意书。排除标准:①非面部皮肤癌;②合并精神类疾病,无自理能力;③合并血液系统疾病或严重心血管疾病等。
根据随机数字表法将患者分为对照组(n=40)和研究组(n=40),对照组型皮片移植并外加多层无菌辅料,研究组将A-PRF凝胶覆盖创面后,重复对照组的操作。本研究两种方案均符合恶性非黑色素瘤皮肤癌治疗规范,经徐州医科大学附属淮安医院伦理委员会批准,所有患者均签署知情同意书。
对照组男22例,女18例,年龄50~59岁,平均(54.48±4.13)岁,病理类型:基底细胞癌24例,鳞状细胞癌16例;研究组男21例,女19例,年龄51~60岁,平均年龄(55.12±4.36)岁,病理类型:基底细胞癌25例,鳞状细胞癌15例。两组患者的性别(χ2=0.050,P>0.05)、年龄(t=0.674,P>0.05)、病理类型(χ2=0.053,P>0.05)比较,差异均无统计学意义,具有可比性。
1.2 手术方法 对照组:患者取仰卧位,气管插管全麻后,根据病变大小与位置设计手术切口并在距病损边缘0.5~2.0 mm 处画线。切开皮肤至皮下组织,完整切除病灶组织。肿瘤切缘(上、下、左、右和底部)取材并送检快速冰冻病理,确定切除边界,病理示全部切缘阴性后,选择下腹部合适部位取皮。供皮区画线取皮,形状与创面相同,面积比创面大10%。切取腹部全厚皮片,修整皮片,表面开若干引流孔备用。皮片移植后用温盐水纱布压迫,并外加多层无菌辅料包扎。术后常规换药,视创面恢复情况,术后10~12 d拆线。
研究组:术前依据患者创面大小抽取自体血液 10~20 ml加入不含任何添加剂的真空采血管中,立即将采血管放入离心机中以1 500 r/min 的速度,离心 14 min,血液样本静置 10 min后可分为 3 层,取中间层的淡黄色凝胶状物质,即为A-PRF凝胶。随即将 A-PRF 凝胶置于无菌纱布上吸附其血清,同时挤压成膜状物备用。术中行肿块扩大切除及全厚皮片移植时,将A-PRF凝胶覆盖创面后再行皮片移植。用温盐水纱布压迫,并外加多层无菌敷料包扎。治疗后第3天更换外层敷料,第7天更换全部伤口敷料,并拍摄1次伤口照片,之后每2天进行常规换药,并拍摄1次伤口照片;视创面恢复情况,术后10~12 d拆线。典型病例见图1~3。
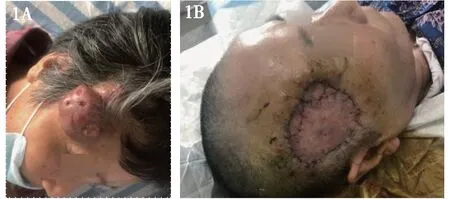
图1 典型病例1,行右颞部肿块扩大切除+全厚皮片移植术,术前(1 A)及术后(1 B)外观图

图2 典型病例2,行右面部肿块扩大切除+全厚皮片移植术,术前(2 A)及术后(2 B)外观图

图3 典型病例3,行右颞部肿块扩大切除+全厚皮片移植术,术前(3 A)及术后(3 B)外观图
1.3 观察指标 ①观察术后7 d的皮片生存率(皮片生存率=1-皮片未成活面积/植皮总面积×100%);记录两组患者术后15 d及术后21 d的创面愈合情况(愈合良好:手术后重建区缝合处、皮瓣或皮片均成活,无缺血坏死及感染等任何并发症的发生;愈合不良:手术后重建区缝合处、皮瓣或皮片部分或不成活,伴有缺血、坏死、感染等术区的任一并发症)。②创面完全愈合时间。③记录术后1个月及术后3个月时瘢痕评估量表得分(patient and observer scar assessment scale,POSAS),POSAS包括患者量表(patient scar assessment scale,PSAS)和观察者评估量表(observer scar assessment scale,OSAS)的指标有6项,PSAS分别为疼痛程度、瘙痒程度、颜色、硬度、厚度、平整度,每一项的分数均为1~10分,分数越高代表瘢痕情况越差。OSAS的评估指标有5个,分别为充血程度、色泽、厚度、柔软度、顺应度,每一项的分数均为1~10分,分数越高代表瘢痕情况越差。除此之外,还需要针对色泽进行的评估,有3个选项为低、混合和高[7-8]。③记录平均换药次数、住院时间、术后至出院前并发症发生率(包括水泡、疼痛、瘙痒、感染等)。
2 结果
2.1 两组患者术后创面愈合情况比较 两组患者的术后创面愈合情况结果示,研究组术后7 d的皮片存活率,术后15、21 d的创面愈合率均高于对照组,创面完全愈合时间短于对照组,差异均有统计学意义(P<0.05),见表1。

表1 对照组和研究组患者术后创面愈合情况比较例(%)]
2.2 两组患者手术后1个月及 3 个月患者的瘢痕评估量表得分对比 两组患者术后1个月、术后3个月的PSAS评分、OSAS评分,PSAS评分中,术后1个月、术后3个月研究组的疼痛或瘙痒程度、硬度、厚度以及平整度评分均低于对照组(P<0.05);OSAS评分中,术后1个月、术后3个月研究组的充血程度、色泽、厚度、柔软度评分均低于对照组(P<0.05)。见表2、表3。


2.3 两组患者住院期间的平均换药次数、住院时间以及术后至出院前并发症发生率比较 研究组的平均换药次数、住院时间以及术后至出院前并发症发生率均低于对照组,差异具有统计学意义(P<0.05),见表4。

表4 比较两组患者住院期间的平均换药次数、住院时间以及术后至出院前并发症发生率
3 讨论
面部恶性非黑色素瘤皮肤癌的治疗方法主要是手术切除、电灼、冷冻疗法以及放射线,其中手术是首选,因肿块位于头面部,手术不仅需要切除肿块,软组织缺损的修复同样重要[9-10]。自体富血小板纤维蛋白(platelet-rich fibrin,PRF)是自体全血经过离心分层后,在血浆层和红细胞碎片层之间的一层自体纤维蛋白凝胶[11]。PRF具有制作程序简单,无交叉感染,无免疫反应,安全性高,成本低等特点,目前已被广泛应用在口腔颌面部手术、肌腱损伤修复、骨骼再生、骨骼肌损伤修复、骨关节炎的治疗中[12-13]。而A-PRF在所有时间段分泌释放的生长因子量和总的释放量都较PRF更高而且持续释放的时间也更长,促进组织修复再生能力优于PRF[14]。A-PRP能够通过血小板的激活,释放出多种高浓度的生长因子进行协同作用,促进局部修复细胞的增殖分化及细胞外基质的合成,从而增强了组织再生和修复能力。
本研究将A-PRF应用于面部皮肤癌术后软组织缺损修复中,研究组术后7 d的腹部全厚皮片存活率,术后15、21 d的创面愈合率均高于对照组,创面完全愈合时间短于对照组。且研究组术后1个月、术后3个月患者自评疼痛或瘙痒程度、硬度、厚度以及平整度评分均低于对照组。这可能与A-PRF是由自体得到的,故无交叉感染以及免疫反应有关[15]。此外,本研究还显示研究组术后至出院的并发症发生率低于对照组,提示A-PRF的还具有抗感的优点[16]。
综上,A-PRF联合腹部全厚皮片移植在修复面部恶性非黑色素瘤皮肤癌术后软组织缺损中具有较高的应用价值,能够较好地恢复患者的面部形态,且并发症较少,值得临床推广和使用。
