基于甘草酸的水凝胶形成与应用研究进展
2022-02-04张丽蓉董志杨月蕊任智先闫鸿丽刘晨王文苹
张丽蓉,董志,杨月蕊,任智先,闫鸿丽,刘晨,王文苹,3*
(1.云南中医药大学中药学院,云南 昆明 650500;2.宁夏医科大学总医院,宁夏 银川 750004;3.云南省南药可持续利用重点实验室,云南 昆明 650500)
甘草酸(glycyrrhizin,GL,见图1a)是我国传统常用中药甘草的代表性有效成分之一。其具有抗炎、抗肿瘤、抗病毒、肝保护、抗氧化、免疫调节和稳定细胞膜等多种药理活性,临床常用于治疗支气管炎、艾滋病及肝炎、肝硬化等疾病[1]。GL现已被广泛应用于食品、化妆品和医药等领域,可作为甜味剂[2]、发泡剂[2]、乳化剂[3]、稳定剂[4-5]和增溶剂[6-8];用作护肤品添加剂可增白并减轻晒后皮肤炎症[9];生物医药领域中亦常利用GL对纳米粒进行表面修饰,以增强制剂靶向递药性能[10-13]。
如图1所示,GL属于三萜皂苷,由一分子甘草次酸(glycyrrhetinic acid,GA)和两分子葡萄糖醛酸组成,具有两亲性,为天然表面活性剂。更为有趣的是,GL及其盐类、活性代谢产物GA均能在一定条件下自发形成凝胶,亦为极少数的天然小分子凝胶剂。其中GL水溶液在极低浓度(0.3%,W/W)下即能形成透明水凝胶,其微观形态呈宽2.5 nm、长数十微米的右旋扭曲状长纤维[14]。
鉴于天然小分子凝胶剂优良的生物活性和生物相容性,相关研究不断深入,GL类凝胶的新用途亦在持续开发之中。因此本文概述了近年来GL凝胶的组装机制及其相关应用研究进展,为今后研发相关新材料和相应新产品提供参考。
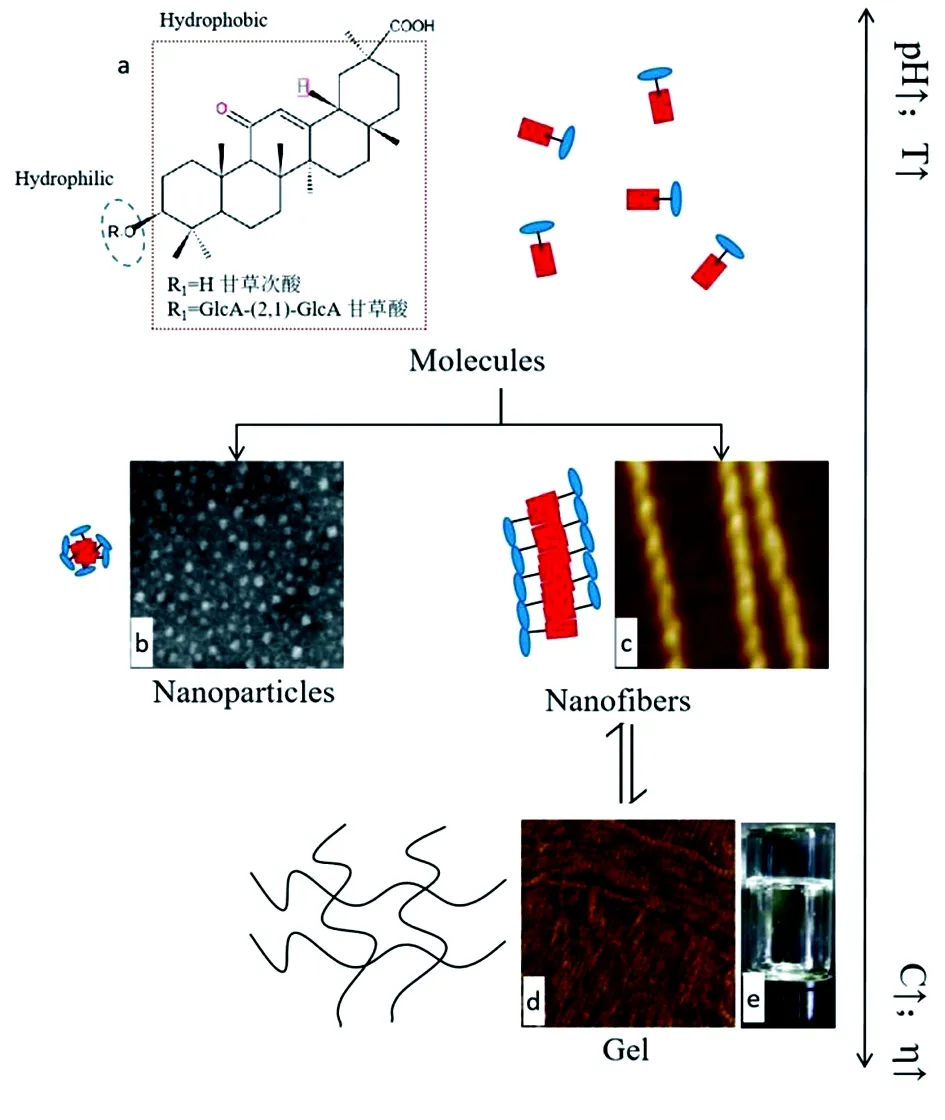
b.0.8wt%GL胶束TEM图[26];c.0.1 wt%GL纤维AFM图[14,17];d.2 wt%GL水凝胶AFM图[14];e.4wt%GL水凝胶外观图[15]图1 甘草酸分子自组装形成纳米胶束、纳米纤维及凝胶的示意图
1 甘草酸自组装的分子机制
如图1所示,GL在水溶液中能发生分子自组装形成胶束(1a)或纳米纤维(1b),后者进一步缠绕交织并形成三维凝胶网络(1c、1d)。通常超分子自组装是基于分子间的一种或多种非共价键相互作用,现已证实GL结构中的三萜骨架、羧基、葡萄糖醛酸是通过氢键、疏水及π-π堆积等相互作用参与自组装过程,其中羧基对于氢键形成至关重要。通过核磁共振波谱(NMR)技术监测GL纤维形成过程中质子的化学位移,发现三萜片段未解离的COOH基团是胶束形成的关键,而葡萄糖醛酸片段未解离COOH基团的氢键作用则是凝胶三维网络形成的主要驱动力[16]。此外,不同报道均认为疏水作用和π-π堆积共同促进了GL纳米纤维的成型。利用粉末X射线衍射(XRD)从晶体学角度进行分析,显示GL纤维呈横向排列,疏水的三萜骨架以头对头的方式倾斜,使得亲水的葡萄糖醛基排列在外,三萜骨架在内,通过疏水作用和π-π堆积自组装形成纤维[14]。Gao等[17]利用变温圆二色谱、变温紫外吸收光谱(UV-Vis)、XRD从分子热力学和晶体学角度发现三萜骨架的组装路径遵循成核-伸长模型(nucleation-elongation model),卷曲形成有序的P型螺旋结构(见图1c),即单个分子通过疏水作用将疏水三萜骨架隔离在内部,亲水基团在外部,聚集成原子核,在延伸过程中通过π-π堆积作用堆叠形成纳米带。
2 影响甘草酸自组装过程的主要因素
超分子自组装过程中,由于分子间相互作用力较弱,易受pH、温度(T)、浓度、溶剂等多重因素的影响,导致聚集体的结构和性质发生相应变化。GL分子自组装过程中存在类似现象,因此其凝胶过程可逆、具有一定的环境响应性。一般而言,随着浓度(C)升高GL形成纳米纤维及凝胶,黏度(η)也随之增加。
此外,GL组装体的形态随溶剂pH变化而改变, pH<7时先形成棒状胶束,进而形成凝胶;pH>7时,则以单体形式存在,无法形成凝胶。其原因在于GL的羧酸基团具有pH响应性,氢离子随着pH值增加而解离,导致亲水性增加,从而抑制了凝胶形成[16,18-19,20]。
GL溶液在不同温度条件下可发生反复的凝胶-溶胶转变,冷却时形成凝胶, 55~60 ℃时则转为溶胶态[16]。所得水凝胶的黏度随GL浓度增大或温度降低而升高[18],此时完成凝胶化过程所需的时间亦逐渐减短[21]。
GL类成分在不同溶剂体系中的自组装行为差异显著。GA在扫描电子显微镜(scanning electron micro-scope,SEM)下可观察到纳米到微米级的球形和花状纤维的自组装体[22]。甘草酸二乙酯在甘油-水(85∶15,V/V)体系中自组装形成长119 nm、宽65 nm的椭圆形球体[23]。GL在不同乙醇-水体系中的最小胶束浓度(critical micelle concentration,CMC),发现随着乙醇含量的增加、CMC逐渐降低,从1.2 mmol·L-1(100%水)降至0.06 mmol·L-1(55%乙醇)[24]。在50 mg·mL-1的GL溶液中,当有机相比例达到9.1%及以上时无法形成凝胶[21]。Fang等[25]将偶氮苯和GA合成三嵌段共聚物(GAG),其最小凝胶浓度(minimum gel concentration,MGC)随着甲醇含量增加从13.9 mg·mL-1增长至28.2 mg·mL-1,且仅在甲醇和水体积比3∶7~5∶5的范围内形成凝胶。
3 甘草酸水凝胶的应用研究概况
3.1 作为缓控释载体材料 GL独特的自组装行为赋予其多功能载体的潜力。表1总结了近年来以GL作为载体材料的研究报道。
由表1可知,以GL作为载体时体系的载药量(drug loading,DL)和包封率(encapsulation efficiency,EE)均较高,且具有明显的缓释特性。当通过胶束或凝胶方式包载药物时,载药机制表现为增溶、物理包裹或二者兼具,一般以物理包裹为主[18]。胶束中药物的释放速率通常较凝胶更为缓慢,可能是由于凝胶中的药物主要以扩散方式释放,而胶束解聚后方能迅速释放药物。由于GL带负电荷,其水凝胶还可通过静电作用选择性吸附阳离子、并通过离子交换释药。此外GL还能提高难溶性药物在水中的溶解度[18],且随着GL浓度增加、改善愈加显著。因此, GL水凝胶目前主要用于装载水难溶性和离子型药物。
3.2 制备乳液凝胶 GL作为典型的两亲性分子,能显著降低油-水界面张力、促使乳滴形成;同时GL的特性使其在乳滴表面多层吸附,形成纤维网络结构、黏度显著增加,可进一步提高乳滴界面的稳定性[15]。因此,GL用于制备乳液凝胶兼具乳化剂和稳定剂功能。表2归纳了GL在乳液凝胶中的应用情况。
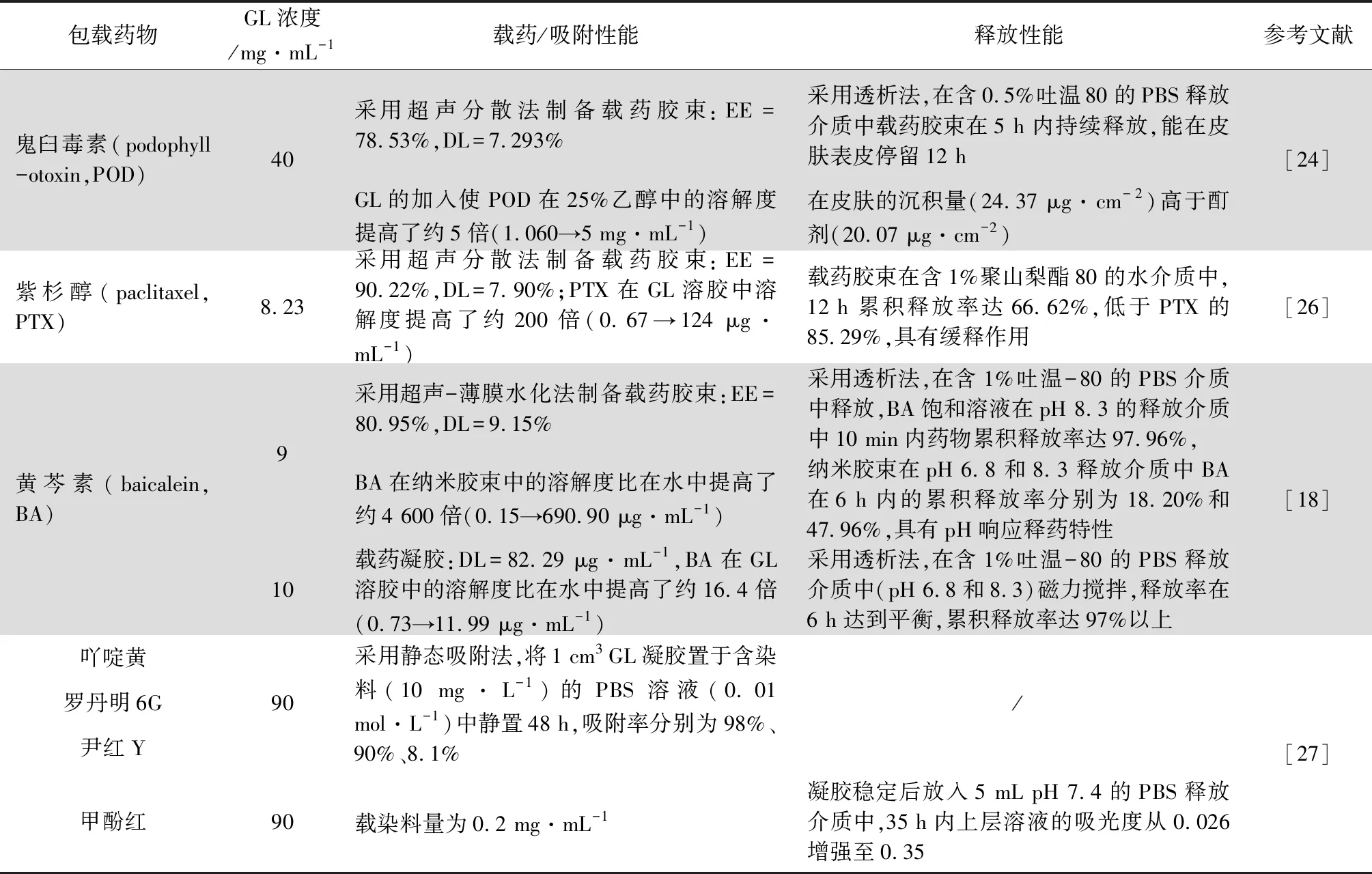
表1 甘草酸水凝胶作为缓控释载体材料的相关研究
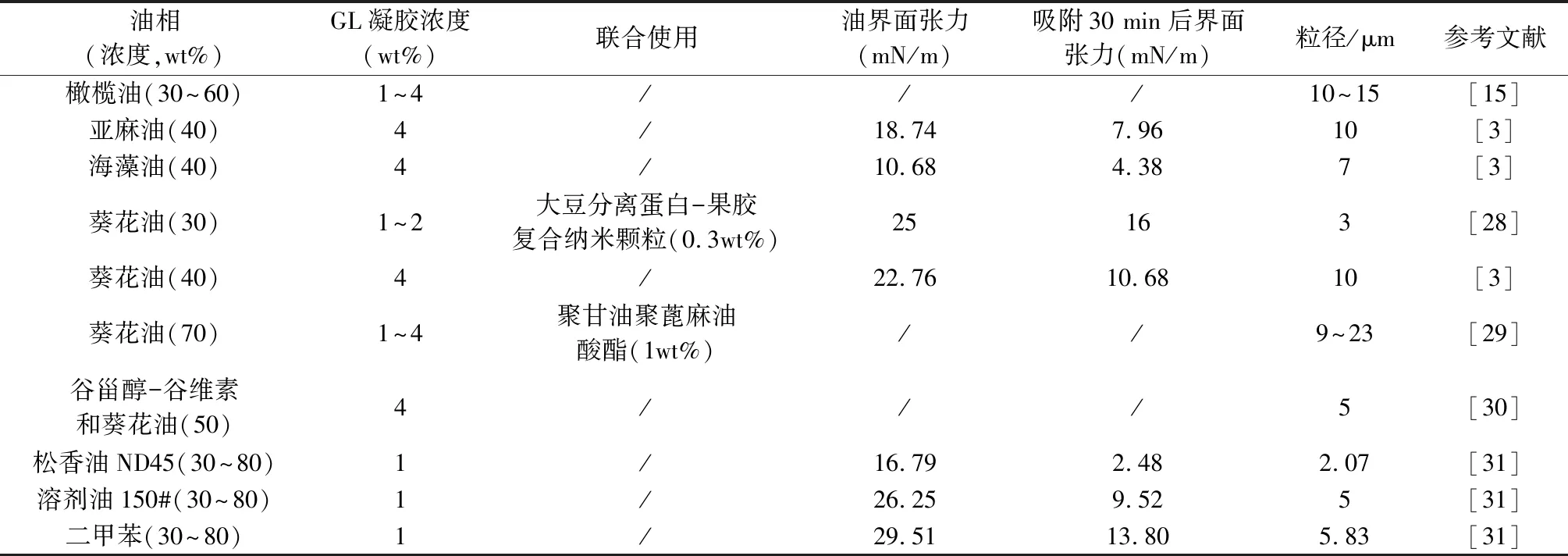
表2 甘草酸在乳液凝胶中的相关研究
由表2可知,GL在较低浓度范围内(1%~4%)即能与食用油或工业油形成乳液凝胶,且油相容纳比高(30%~80%),显示出优良的乳化和稳定作用。随着GL浓度提高,网络孔径减小、网络结构中的油滴粒径随之减小[15]。
当固定体系中油相和GL浓度时,GL凝胶对不同油相的界面张力降低程度存在差异,对极性较大的油相的亲和力更高[31]。当与其他乳化剂联用时,二者协同发挥减低界面张力功能,乳化能力优于单一乳化剂。此外,GL与其他乳化剂配合制成W1/O/W2复乳凝胶,能用于包载亲水性、环境敏感型药物[29]。
3.3 研发智能水凝胶 智能水凝胶含水量高、对外界环境刺激敏感、生物相容性优良,已在生物医学领域受到广泛认同,可作为组织工程材料、伤口敷料、肿瘤化疗药物载体等。天然小分子凝胶剂是制备智能水凝胶的理想材料,GL作为功能性活性凝胶因子也引起了广泛关注。
Zhao等[32]利用1.5 mmol·L-1GL制备具有抗菌性能的可注射、可模塑的低分子水凝胶,在低(1%)-高(30%)-低的应变扫描循环下,体系呈现出凝胶-溶胶-凝胶的可逆转变,具有良好的触变性。该凝胶能抑制金黄色葡萄球菌的生长,最小抑菌浓度为0.13wt%。经GL凝胶处理后的细胞活性未改变,且浓度高达0.17wt%时未出现溶血现象,显示出较低的细胞毒性和良好的血液相容性,可用于组织工程细胞培养。
Fang等[25]通过酰胺键连接偶氮苯基团和两个GA分子设计合成了A-B-A型三嵌段共聚物(GAG)。偶氮苯基团参与顺/反异构化,反式-GAG在DMSO/H2O(2∶8,V/V)中形成了超分子凝胶,具有光响应性,即在紫外光和可见光的交替照射下发生可逆的顺-反-GAG异构化,导致凝胶-溶胶转变。该反式-GAG凝胶显示出优异的自修复特性,可作为注射材料。
Wan等[33]以4 wt%甘草酸单铵盐和20 wt%葵花籽油在80 ℃下均质并充气,通过加入炭黑粒子制备凝胶化乳液泡沫。由于炭黑粒子可吸收紫外光并将吸收的光能转化成热能,在紫外照射下体系温度升高,当超过GL的凝胶-溶胶转化温度(55~60 ℃)时,GL凝胶网络融化致使泡沫失稳,从而显示出独特的光/热双重响应性能。
3.4 作为催化剂载体 以天然凝胶为载体,既可稳定金属催化剂的活性,又能为金属配体提供手性、还原性等,为研发新型天然分子凝胶基底的金属催化剂提供了新思路。
孙仪萌[34]以GL自组装的手性螺旋纳米结构水凝胶为骨架,无手性金属为配体构建了超分子手性催化剂。GL可以将手性传递给无手性配体,进而影响对映体的对映选择性,最高获得61%的对映体过量值,催化反应产率达99%。证实GL水凝胶适宜作为不对称催化Diels-Alder反应支架。
Saha等[14]在GL水凝胶中引入氧化石墨烯和氯金酸,利用GL中二糖葡萄糖醛酸的还原性将氯金酸原位还原为金纳米粒,开发了一种三重催化剂体系。用于将对硝基苯酚多相催化还原为对氨基苯酚,催化效率提高了2.5倍。
Hao等[35]以甘草酸单胺盐水凝胶作为辅助材料,与聚丙烯酰胺(PAAm)合成具有高机械性能的双网络(double network,DN)水凝胶GL/PAAm DN,具备快速自恢复和优良的抗疲劳性能。其利用GL中二糖醛酸基团的还原性,在不添加外部还原剂的情况下使Au(III)离子自发地原位还原,可作为金属纳米粒的支持剂用于4-硝基苯酚还原反应。通过冰模板技术(ice-templating technique)重铸凝胶增加孔隙率后,将4-硝基苯酚转化率提高至100%;且流动催化反应连续重复20个循环后催化活性无明显下降,转化率维持在99%以上,显示出优异的催化效率。
3.5 其他应用 GL作为修饰剂和稳定剂,能增强海藻酸盐与Ca2+生成的可生物降解原位注射水凝胶的靶向性[36];基于该凝胶体系培养的人肝癌HepG2细胞能长时间保持细胞活性和增殖, P450 mRNA的表达增强,提示该凝胶在肝组织工程3D细胞培养方面的潜在应用前景[36]。鉴于肿瘤细胞自身特性,以其研究增殖性或安全性说服力尚显不足,有必要选用其他细胞系进一步验证。
天然小分子凝胶剂还是制备超分子聚合物的理想材料,可基于主客体作用构建自修复水凝胶。许格[37]在GA两端修饰不饱和双键作为客体分子,以β-环糊精和环氧氯丙烷聚合制备亲水性聚合物作为主体骨架,利用紫外光固化技术制备了超分子聚合物水凝胶,在pH4~14的溶液环境中均稳定并在振荡和加热后会发生凝胶-溶胶转变。Li等[38]将GL作为客体、β-环糊精为主体,分别与N-N’-二甲基丙烯酰胺共聚后形成自愈合水凝胶,与3T3L1细胞共孵育24 h后细胞仍保持较好的形态和活性,生物相容性良好,有望开发成为性能优异的组织工程和伤口敷料。
4 结语与展望
虽然GL水凝胶的研究已取得一定的进展,但目前对GL凝胶的性能开发尚显不足。未来研究预期可从以下几方面展开探索:①深入研究GL自组装机制,明确其分子自组装路径与产物形态性能之间的关系,掌握关键调控因子,进而实现组装过程的精确控制;②目前GL凝胶的应用领域局限、方式较为单一,如何发挥其作为天然产物兼具的优良生物相容性和多种活性,尤其是扩大在生物组织工程、靶向制剂等生命科学领域的应用,仍值得进一步探索;③通过引入功能性基团使GL凝胶具有刺激响应性研发智能药物载体,或与其他智能凝胶结合获得具有更高性能的复合网络凝胶,扩大其适用范围;④GL作为天然小分子凝胶具有典型的“药辅合一”特性,但当前研究更侧重于载体、基质、添加剂等作为“辅“的作用,而其“药”的功能则在研究中关注不足,今后的研究可基于GL自身药理作用开发功能化新剂型或新技术。
综上,GL水凝胶作为一种新型的天然小分子功能材料,在药物载体、乳液凝胶和智能水凝胶等多方面潜在极大的应用价值。期待不同领域研究者给予关注,持续开拓GL水凝胶的新功能、研发新产品,共同推进天然小分子水凝胶的快速发展。
