伴淋巴结转移的乳腺分泌性癌1例
2022-02-04寿乐意杨俊杰陈晓丹
寿乐意 杨俊杰 陈晓丹
乳腺分泌性癌是一种罕见的、低级别、染色体易位相关性浸润性癌。此类肿瘤最早发现于儿童和青年人,曾称为“幼年性乳腺癌”,后来发现其也可见于中老年女性,偶见于男性[1-2]。乳腺分泌性癌具有特殊的组织学形态,低度恶性临床特征,特别是20岁左右的年轻患者预后好,但老年人则可呈侵袭性表现;远处转移罕见,部分可发生区域淋巴结转移,不过即使发生了淋巴结转移,预后也良好[3]。本文报道1例伴淋巴结转移的乳腺分泌性癌,并分析乳腺分泌性癌病理诊断、免疫组化和临床治疗等特征。
患者女,53岁。因“发现左乳可疑结节5年”,于2021年5月27日来杭州市萧山区第一人民医院就诊。患者5年前在杭州市萧山区第一人民医院CT检查发现左乳可疑结节,因当时无明显不适而未进一步诊治。5年来患者自觉肿物逐渐增大,近1年起偶有压痛。本院左乳B超检查示左乳12点钟方向不均低回声结节,乳腺影像报告和数据系统(BI-RADS)4a类,大小约5.5 cm×2.0 cm,建议细针穿刺活检。左乳钼靶检查示左乳上方有块状密度增高影,大小约5.3 cm×4.8 cm,边界不清晰;双乳见数粒钙化影;两腋下见淋巴结影。患者于2021年6月2日在本院行左乳肿块细针穿刺活检,穿刺活检病理诊断:(左乳)浸润性癌,考虑为分泌性癌。病理诊断明确后,6月8日患者于局麻下行前哨淋巴结及前哨旁淋巴结活检,病理诊断:(左乳前哨淋巴结)淋巴结转移性癌(2/4枚阳性);(左乳前哨旁淋巴结)淋巴结1枚阴性。6月8日患者于全麻下行乳腺癌根治术。左乳癌组织标本大体检查显示肿块位于12点钟方向,最大径约5.0 cm,与周围乳腺组织边界清楚,切面灰白到黄褐色、黏液状,质地偏硬;镜下检查形态以微囊结构为主,可见大量的细胞内、细胞外黏液,形态如同甲状腺滤泡,部分区可见管状和乳头状结构,局部间质伴胶原化(图1),同时伴有腋窝淋巴结转移(图2)。免疫组化、分子检测及特殊染色检查示S-100蛋白阳性(图3)、广谱原肌球蛋白受体激酶(pan tropomyosin kinase receptors,Pan-TRK)阳性(图4)、特殊染色阿利新蓝-过碘酸雪夫染色(alcian blue/periodic acid schiff stain,AB/PAS)阳性(图 5),ets变体基因6(ets variant gene 6,ETV6)荧光原位杂交法检测显示细胞内可见红绿分离信号。左乳癌组织标本病理诊断:(左乳12点钟方向)乳腺分泌性癌,大小5.0 cm×4.0 cm×2.5 cm,未累犯表面皮肤及乳头,未见确切脉管及神经累犯,周围见导管原位癌。腋窝淋巴结3/24枚见癌转移。免疫组化检查:S-100(阳性),Pan-TRK(阳性),4型黏蛋白(mucin4,MUC-4)(阳性),Ki-67(约10%阳性),雌激素受体(estrogen recepter,ER)(<1%阳性),孕激素受体(progesterone receptor,PR)(阴性),C-erbB-2(HER-2基因)(阳性),雄激素受体(androgen receptor,AR)(<1%阳性)。特殊染色:AB/PAS(阳性)。分子检测:采用荧光原位杂交法(flourescence in situ hybdridization,FISH)检测ETV6基因断裂探针,出现红绿分离信号,提示ETV6基因重排阳性。肿瘤病理分期T2N1M0。患者术后恢复可,于6月22日出院。患者之后多次入院以阿霉素类药物+环磷酰胺+紫杉醇方案化疗,随访30周,未见肿瘤复发与转移。
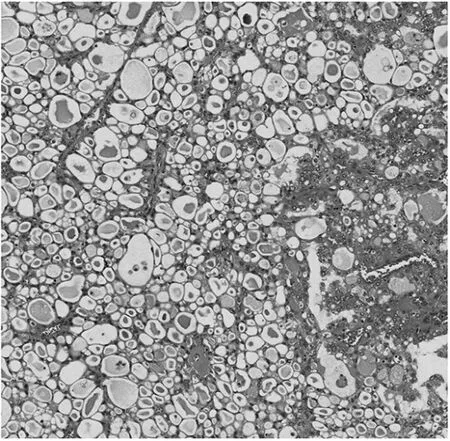
图1 左乳癌组织病理学检查镜下所见(HE染色,×100)
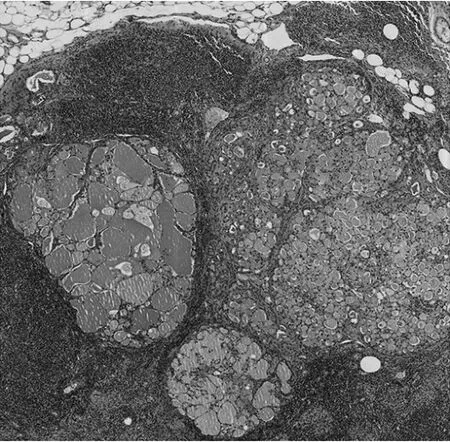
图2 腋窝转移性淋巴结病理学检查镜下所见(HE染色,×40)
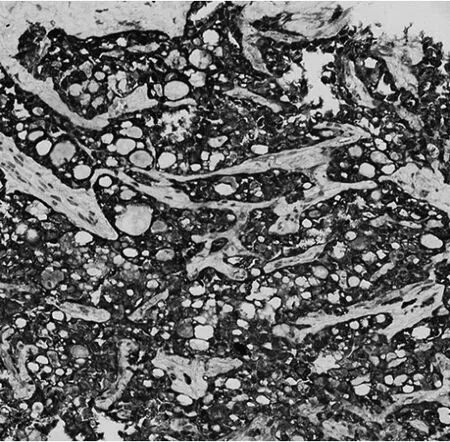
图3 左乳癌细胞质S-100免疫组化染色阳性(×200)
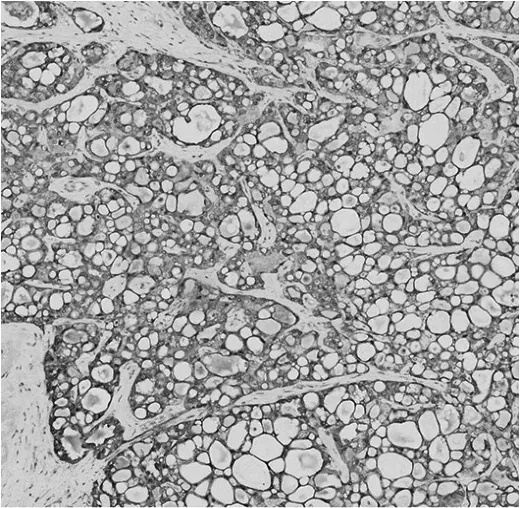
图4 左乳浸润性癌细胞质Pan-TRK免疫组化染色阳性(×200)
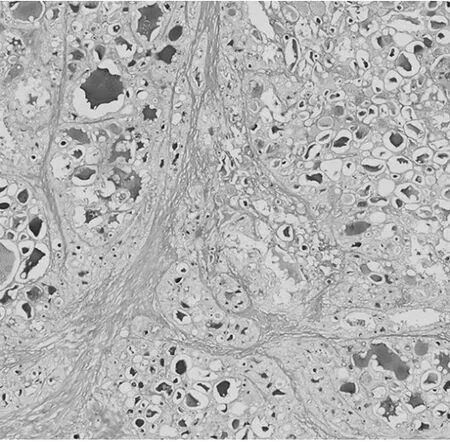
图5 左乳浸润性癌细胞内、外AB/PAS免疫组化染色阳性(×200)
讨论1966年,Mcdivit和Stewart首次报道的乳腺分泌性癌的病例均为青少年,故将其命名为“幼年性乳腺癌”。1980年,Tavassoli和Norris回顾既往文献发现这种肿瘤并不仅发生于青少年,患者的发病年龄为9~69岁,中位年龄25岁,因此他们依据其特征性的组织形态学特征将此类肿瘤命名为“分泌性癌”,WHO乳腺肿瘤分类一直延用至今。乳腺分泌性癌在临床上常常表现为单发或多发无痛性肿块,多位于乳晕周围,可发生于乳腺的各个象限,有些病例可出现血性乳头溢液。乳腺分泌性癌早期生长缓慢且无特殊的临床症状,因此有些患者在发病很久后才初次就诊。影像学上,早期乳腺分泌性癌与纤维腺瘤等良性病变相似,呈类圆形或分叶状低回声或等回声肿块,与周围界限清楚,故易误诊为良性;但随着肿块的增大,影像学检查可提示其为恶性。分泌性癌在儿童和青少年患者中很少发生淋巴结转移且预后较好;在成人患者中可发生淋巴结转移,但是预后也较好[4]。
乳腺分泌性癌的镜下形态显示肿瘤组织边界清楚,呈推挤性生长,部分区也可见到明确的浸润性生长,肿瘤细胞有3种排列方式:微囊性、实性和管状。微囊,由类似于甲状腺滤泡的小囊构成,并可以融合呈实性岛状结构;实性,呈片状排列;管状,含有分泌物的小管。肿瘤细胞有2种类型,一种为嗜酸性,体积较大,圆形或多边形,细胞质丰富,呈嗜酸性颗粒状,核大卵圆形,有小核仁;另一种为细胞质透明空泡状的细胞,肿瘤细胞内外可见较多的黏液,核较小,核仁不明显。乳腺分泌性癌常伴有原位癌的成分,呈筛状或实性,呈低-中核级。免疫组化特征性表达S-100、Pan-TRK、MUC-4,ER、PR、HER-2通常呈三阴性或ER/PR弱阳性,特殊染色AB-PAS阳性[5],同时运用FISH技术检测发现伴有ETV6-NTRK3基因融合[6-7]。
乳腺分泌性癌常常伴有大量的细胞内、细胞外黏液,需与其他富含黏液的乳腺病变如腺泡细胞癌、乳腺囊性过分泌增生、富于糖原的癌、富于脂质的癌相鉴别,鉴别诊断依据如下:(1)腺泡细胞癌:肿瘤细胞胞质通常浅染、颗粒状,无细胞内外黏液,免疫组化染色一般不表达S-100及Pan-TRK,无ETV6-NTRK3基因融合。(2)乳腺囊性过分泌增生:囊腔内虽然有丰富的、均质的嗜酸性分泌物,但是囊肿被覆上皮形态温和,立方状或扁平,腺管可见双层结构,外围肌上皮。(3)富于糖原的癌:肿瘤细胞体积较大,胞质透明,如肾脏的透明细胞肾细胞癌,周围可见透明细胞性导管内癌成分。(4)富于脂质的癌:胞质内富含脂质空泡,油红染色阳性,PAS染色阴性,瘤细胞具有多形性[3]。
Ets变体基因6-神经营养因子受体络氨酸激酶(ets variant gene 6-neuro trophin receptor kinase,ETV6-NTRK)基因融合见于多种其他类型的肿瘤中如唾腺分泌性癌、婴儿型纤维肉瘤、先天性中胚层肾瘤等[8]。神经营养因子受体酪氨酸激酶(neurotrophic receptor tyrosine kinase,NTRKS)基因融合在超过20种成人及儿童实体瘤中被检测到,NTRKS家族的NTRK1/2/3基因分别编码不同的原肌球蛋白激酶受体(tropomyosin kinase receptors,TRK)A、B、C,这些蛋白主要参与神经元的发育,包括神经元突触的生长功能以及记忆的发育;在胚胎发生后,TRK的表达主要限于神经系统。Pan-TRK抗体可以检测到TRKA、TRKB和TRKC抗原,主要用于检测NTRK基因融合的TRK蛋白。Beth等[9]研究了24例乳腺分泌性癌的Pan-TRK的表达,其中有19例完全定位在细胞核;3例主要定位在细胞核,胞质有弱染色;1例染色主要定位于细胞质,局灶细胞核染色。在203例其他类型乳腺癌中,有21例有局灶细胞核阳性(<5%肿瘤细胞);1例(0.5%)有局灶细胞膜阳性。该研究显示,Pan-TRK抗体在乳腺分泌性癌中的表达远远高于其他类型的乳腺癌,因此,使用免疫组化Pan-TRK抗体可以作为诊断乳腺分泌性癌的筛选工具,Pan-TRK阳性的患者可进一步行ETV6-NTRK3分子检测确认。Pan-TRK抗体检测是诊断乳腺分泌性癌的一种快速且经济的筛选方法。
乳腺分泌性癌为一种生长缓慢的惰性肿瘤,5年总体生存率94.4%,10年总体生存率91.4%。肿瘤直径<2 cm的病例约15%~30%可发生淋巴结转移,但是阳性淋巴结数目通常≤3枚,远处其他部位转移罕见。早期发现肿瘤并尽快进行手术切除是乳腺分泌性癌主要的治疗方式。Li等[4]建议对于肿瘤直径<2 cm的患者进行局部保乳切除术和前哨淋巴结活检,如果前哨淋巴结及切缘阴性,可行保乳根治术;如果肿瘤直径>2 cm或前哨淋巴结活检阳性,可采用全乳根治性切除加淋巴结清扫术,术后行辅助性化疗、放疗和激素治疗。研究显示,对于复发和转移的患者使用靶向药物Pan-TRK抑制剂治疗,可以取得显著疗效[10-11]。Landman等[12]报道了1例白人女性乳腺分泌性癌伴广泛的淋巴结累及、胸膜累犯、腹膜浸润及腹水形成,在使用拉罗替尼后有显著疗效。
本例患者病情发展缓慢,影像学表现无明显特异性,穿刺活检明确后行乳腺癌根治术,过程顺利。肿瘤界限清楚、质地偏硬,切面呈黏液状,提示其黏液分化。术后镜下形态、特殊染色和分子检测确诊为乳腺分泌性癌。患者术后予以化疗,随访期间未见复发与转移,预后较好。
