鲍曼不动杆菌外排泵表达与多黏菌素B耐药性的关系研究
2022-02-04赵玉杰吴巧萍龚梦帅秦玲
赵玉杰 吴巧萍 龚梦帅 秦玲
鲍曼不动杆菌是全球院内感染的重要致病菌,临床上可引起呼吸机相关性肺炎及神经系统感染等各种危重感染并迅速传播[1]。随着医疗水平和诊疗技术的发展,近年来,鲍曼不动杆菌耐药问题日益凸显,2020年中国细菌耐药监测网报告显示,鲍曼不动杆菌对亚胺培南和美罗培南的耐药率分别为68.1%和69.0%[2]。多黏菌素B(polymyxin B,PB)是治疗由多重耐药革兰阴性菌引起严重感染的最后一道防线,由于临床使用量增多,PB耐药鲍曼不动杆菌陆续被分离,其耐药机制成为当前关注的热点研究[3-4]。研究表明,细菌耐药性的形成与外排泵过度表达关系密切[5]。鲍曼不动杆菌中介导多药耐药的主要外排泵为耐药结节细胞分化(resistance-nodulation-cell division,RND)家族和多药及毒性化合物外排(multidrug and toxic compound extrusion,MATE)家族,RND家族包括Ade-ABC、AdeIJK、AdeFGH和AdeDE等4种外排泵及其相关调控系统,adeB、adeJ、adeG和adeE分别为相应的内膜蛋白,在外排泵系统中发挥主要的功能作用[6],其中,AdeABC是鲍曼不动杆菌最重要的外排泵。AbeM是MATE家族的主要外排泵,涉及细胞内稳态、毒力因子和有毒化合物的排出等,功能十分广泛[7]。目前,鲍曼不动杆菌RND和MATE家族外排泵系统与PB耐药性的关系尚不明确。本研究通过探究体外诱导PB耐药鲍曼不动杆菌外排泵表达与PB耐药的关系,为PB的耐药机制研究提供新的视角,为新型佐剂研发提供依据。
1 材料和方法
1.1 材料
1.1.1 菌株来源 宁波市医疗中心李惠利医院2020年1月—2021年12月共分离到多重耐药鲍曼不动杆菌300株,剔除相关重复菌株后,均经过VITEK 2 Copmpact全自动微生物鉴定系统鉴定。标准菌株鲍曼不动杆菌ATCC19606购自美国标准菌库,质控菌株大肠埃希菌ATCC25922由本院实验室保存。
1.1.2 主要试剂 PB(批号:2007CT1275)购自温州康泰生物技术有限公司;羰基氰氯苯腙(carbonyl cyanide mchlorophenylhydrazine,CCCP)(批号:27674)、总 RNA抽提试剂盒(Trizol)(批号:U8831)购自杭州天根科技有限公司;PrimeScriptTM逆转录试剂盒(批号:AJ60652A)和TB Green qRT-PCR试剂盒(批号:AM61527A)均购自大连宝生物工程有限公司;2×Taq PCR MasterMix(批号:AL14585A)购自美谷生物科技浙江有限公司。
1.2 方法
1.2.1 PB敏感性检测 采用微量肉汤稀释法检测菌株对PB的最低抑菌浓度(minimal inhibit concentration,MIC)。具体步骤如下:吸取100 μl PB药液(256 mg/L)加至灭菌96孔板的第1列,用阳离子校正的MH肉汤对倍稀释成系列浓度。用新鲜培养的细菌调0.5麦氏浊度的菌悬液,经0.9%氯化钠溶液稀释100倍后加入96 孔板,每孔100 μl,贴膜覆盖,37 ℃孵育16~18 h,以完全抑制细菌生长的最低药物浓度为MIC值,大肠埃希菌ATCC25922作为质控菌株。参考2019年CLSI标准,菌株对PB的MIC值≤2 mg/L为敏感,≥4 mg/L为耐药。
1.2.2 体外诱导PB耐药试验 在PB的MIC值为<0.030 0、0.030 0、0.062 5、0.125 0、0.250 0、0.500 0、1.000 0和2.000 0 mg/L的敏感菌株中各选取3株共24株敏感菌进行PB耐药诱导试验,以成功诱导耐药的菌株作为耐药组,未经诱导的相同菌株为敏感组。按文献[8]方法,将新鲜培养过夜的离株单菌落置于LB肉汤培养基中37℃震荡过夜,取菌悬液加入含有1/2×、1×、2×和4×MIC PB药物浓度的96孔板中,隔24 h后传代至新鲜的含更高梯度浓度PB药液的96孔板中,共诱导培养21 d。以不含抗菌药物正常培养的相同菌株为空白对照。每次转移前将该孔中菌悬液接种至血平板观察污染情况,将未受到污染的单菌落保存于30%甘油肉汤中用于后续检测。
1.2.3 外排泵表型检测 二甲基亚砜溶解CCCP粉末,配置成终浓度为10 mg/L的CCCP溶液[9]。制备0.5麦氏浊度的菌悬液,0.9%氯化钠溶液稀释100倍备用。按照1.2.2方法制备系列浓度的PB药液,每孔中分别加入CCCP溶液和菌悬液,37℃孵育16~18 h,以完全抑制细菌生长的最低药物浓度为MIC值,对比加入CCCP后PB的MIC值变化。若加入CCCP后菌株对PB的MIC值下降≥4倍,则判定为外排泵阳性菌株[10]。
1.2.4 外排泵基因扩增及测序 采用煮沸法提取耐药组和敏感组菌株的基因组DNA。挑取2~3个对数生长期单菌落置于EP管,加入无菌双蒸水,混合均匀后置100℃沸水中煮沸10 min,8 000 r/min离心30 s,吸取上清液,-20℃冰箱保存备用。采用PCR法扩增外排泵基因,包括操纵子基因adeB及其调控基因adeR和adeS、adeJ及其调控基因adeN、adeG及其调控基因adeL、操纵子基因adeE和abeM,各引物序列见表1[11]。PCR反应体系:2× Taq PCR MasterMix 12.5 μl,Primer F(10 μmol/L)0.5 μl,Primer R(10 μmol/L)0.5 μl,模板1.0 μl,双蒸水 10.5 μl。伯乐 C1000 型 PCR 仪扩增条件:94 ℃预变性5 min,94 ℃变性30 s,55~60 ℃退火45 s,72 ℃延伸1 min,共35个循环,72 ℃延伸10 min。使用1.0%琼脂糖凝胶电泳观察特异性扩增条带,调控基因阳性扩增产物送上海生工生物工程有限公司测序。将得到的序列通过国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库找到标准序列,利用SnapGene软件进行序列比对分析,找出基因突变位点。

表1 PCR引物序列
1.2.5 外排泵基因表达水平的检测 分别将耐药组和敏感组细菌接种于MH肉汤培养基,37℃培养过夜,采用Trizol法提取菌株的总RNA,PrimeScriptTM逆转录试剂盒逆转录出cDNA,参照TB Green qRT-PCR试剂盒进行qRT-PCR。反应条件为95℃预变性8 min,95℃变性30 s,55℃退火30 s,反应共40个循环,通过相对定量法(2-ΔΔCt)计算各基因相对表达量,以鲍曼不动杆菌ATCC19606为对照菌株,以rpoB为内参基因。引物序列见表2。

表2 qRT-PCR引物序列
1.3 统计学处理 使用GraphPad Prism 8.0统计软件。耐药组添加CCCP前后的MIC值比较采用Wilcoxon秩和检验。耐药组和敏感组间外排泵基因的相对表达量比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 PB敏感性分析 分离到的300株鲍曼不动杆菌均对PB敏感,未发现PB耐药株。其中MIC值<0.0300mg/L的菌株最多(84株,28.0%),其他依次为0.500 0 mg/L 59株(19.7%)、1.000 0 mg/L 52株(17.3%)、0.030 0 mg/L 36株(12.0%)、0.125 0 mg/L 20株(6.7%)、0.062 5 mg/L 18株(6.0%)、2.000 0 mg/L 17株(5.6%)和0.250 0 mg/L 14株(4.7%)。
2.2 诱导耐药试验结果 8个MIC值下随机选定的24个菌株中,共诱导耐药成功12株,其中<0.030 0和0.030 0 mg/L未诱导成功,0.062 5 mg/L诱导成功1株(菌株号:14244),0.125 0 mg/L诱导成功2株(菌株号:14491、14202),0.250 0 mg/L诱导成功3株(菌株号:14520、14600和14304),0.500 0 mg/L诱导成功3株(菌株号:14359、14267和14260),1.000 0 mg/L诱导成功2株(菌株号:14393、14297),2.000 0 mg/L诱导成功1株(菌株号:14433)。
2.3 外排泵表型检测结果 耐药组加入CCCP后,PB的MIC值与添加前相比明显下降,下降幅度8~256倍,判断为外排泵表型阳性株。耐药组经CCCP处理前后对PB MIC值的差异有统计学意义(P<0.01),见表3。
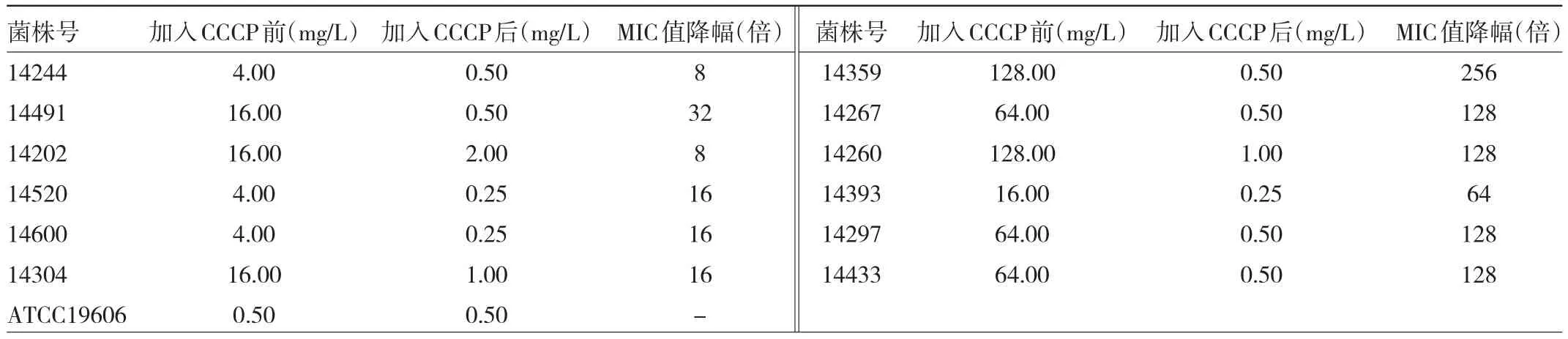
表3 耐药组加入CCCP前后MIC值的变化情况
2.4 外排泵基因携带情况及序列比对结果 12株耐药菌株中有11株携带adeB,携带率为91.67%,所有菌株均携带adeJ、adeG和abeM,未检出adeE携带株,见图2。序列比对结果显示,菌株14433不携带adeR和adeS操纵子基因;菌株14359不携带adeR基因,携带的adeS基因出现A153T、G186V等2个突变位点;菌株14267不携带adeS基因,携带的adeR基因出现V120I、A136V等突变位点;其他8个菌株均出现adeR基因的V120I、A136V突变和adeS基因的A153T、G186V突变,见表4。adeN和adeL未检出突变位点。

表4 耐药组adeR和adeS调控基因突变情况

图2 PB耐药株外排泵操纵子携带基因检测结果
2.5 外排泵基因相对表达量比较 耐药组和敏感组外排泵基因的表达水平均呈现不同程度的上调。与敏感组相比,耐药组adeB的相对表达量增加了2.2倍,差异有统计学意义(P<0.05),adeJ、adeG和abeM分别增加1.9倍、1.8倍和1.8倍(均P>0.05),见图3。
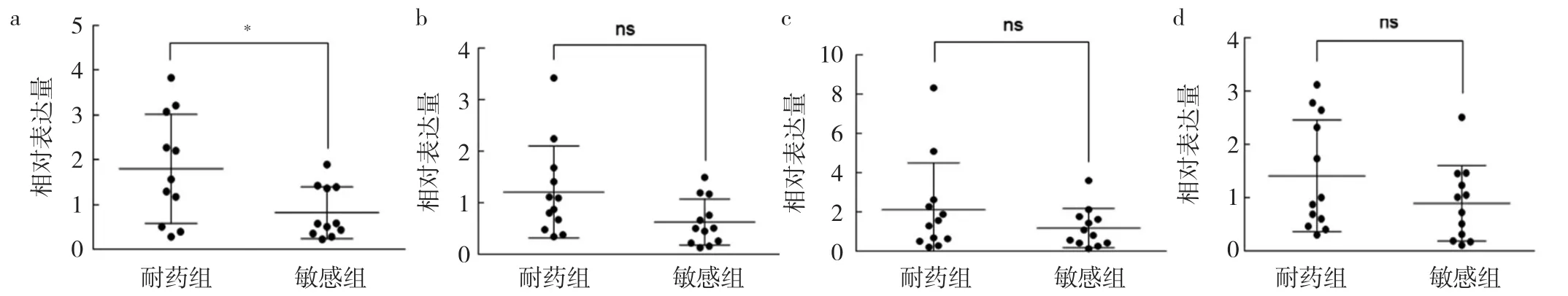
图3 耐药组和敏感组外排泵基因相对表达量比较(a:adeB,n=11;b:adeJ,n=12;c:adeG,n=12;d:abeM,n=12)
3 讨论
鲍曼不动杆菌是一种耐药性和生存能力都较强的革兰阴性杆菌,广泛分布在医疗环境中,随着各种抗菌药物在临床上大量不合理的使用,多重耐药鲍曼不动杆菌的检出率逐年增加,给临床治疗带来极大困扰。多重耐药菌通常选择PB、替加环素或联合用药进行治疗[12]。随着PB耐药鲍曼不动杆菌的增多,外排系统的活化成为鲍曼不动杆菌固有和获得性耐药的重要机制,其表达在PB耐药鲍曼不动杆菌中的作用研究亟待展开。
本研究检测了分离出的300株多重耐药鲍曼不动杆菌对PB的敏感性,未检测到耐药株,体外诱导获得12株PB耐药株。在诱导试验中发现,鲍曼不动杆菌长期暴露在亚抑制浓度的PB中,易转变为MIC值逐渐升高的耐药菌,升高的幅度存在个体差异性,推测与不同个体菌株适应性突变和进化的机制不同有关[13]。鉴于药动学-药效学效应和人体组织渗透性差异等机制的作用,人体组织内的细菌长期处于亚致死浓度范围,为确保生存,细菌会通过发生适应性突变来不断获得耐药[14]。提示临床应谨慎合理使用抗菌药物,防止病原菌发生适应性进化而耐药。
CCCP是常见的外排泵抑制剂,可阻断主动外排系统的能量来源,增加药物在细菌中的积累,恢复细菌对药物的敏感性[15]。本研究发现,添加CCCP后PB耐药株的MIC值下降8~256倍,与添加前相比,差异有统计学意义(P<0.01),提示PB耐药株的MIC值升高与外排泵作用机制有关。添加CCCP后菌株14202对PB的MIC值仍较高(2 mg/L),推测其可能合并其他耐药机制引发耐药。近年来研究发现,AdeABC和AdeIJK外排泵的表达量升高与黏菌素耐药有关[9]。本研究发现,PB耐药株中外排泵基因adeB、adeJ、adeG和abeM均有较高的携带率,未检测到adeE,与相关研究中认为AdeABC无法与其共存结果一致[16]。序列比对分析发现,携带调控基因adeR和adeS的PB耐药株均出现了2~4个突变位点,与敏感组相比,adeB的相对表达量增加了2.2倍(P<0.05)。研究表明,AdeABC外排泵系统过表达引发多种抗菌药物的耐药性增加,其机制是AdeRS双组分调控系统(two-component regulatory system,TCS)的点突变、缺失或插入序列导致[17]。Yilmaz等[18]研究证实,adeB携带株出现表达上调与AdeRS TCS发生点突变进而导致PB耐药显著相关,Sun等[19]通过基因敲除构建鲍曼不动杆菌的adeRS突变体缺失株,与亲本株的对比分析发现,adeRS缺失株对PB和洗必泰等抗菌药物更敏感,说明AdeRS TCS可能通过点突变的方式直接或间接影响细胞膜的结构及其通透性,进而阻碍PB进入外膜,导致耐药性升高,与本研究相符。另外,菌株14304未携带adeB,仍检出adeR和adeS的点突变,推测AdeRS TCS在调控外排泵基因表达时存在调控功能的多样性,菌株14433未检出突变,仍显现出外排泵阳性表型,可能和其他外排泵调控系统有关,值得进一步探索研究。
本研究还发现,与敏感组相比,PB耐药组adeJ、AadeG和abeM基因相对表达量亦有不同程度上调(P>0.05)。AdeIJK外排泵由位于AdeIJK上游的tetR型调控子adeN调控,adeN失活可导致adeJ的表达水平提高,并由此降低细菌对多种抗菌药物的敏感性[20]。有研究认为,AdeIJK通常介导细菌内源性耐药,表达过高对细菌本身是致死性的损害,与AdeABC外排泵具有协同增效作用,两种泵中任何一种表达上调均可导致抗菌药物敏感性下降[21]。AdeFGH通常受其上游调控基因adeL的调控,adeL基因的点突变、插入或缺失突变均会导致下游adeG高表达,增强AdeFGH的外排功能,介导多重耐药发生。本研究均未检测到adeL和adeN基因的突变,说明AdeFGH和AdeIJK的表达还受其他调控基因的调控。AbeM与鲍曼不动杆菌标准菌株ATCC19606的NorM同源性达70%,其通常以质子驱动力为主要能量将药物排出体外,据报道其主动外排的底物涉及多种抗菌药物[22],本研究中耐药组的abeM表达量出现一定程度的上调,推测与PB耐药具有一定相关性。
外排泵系统在细菌耐药方面发挥着独特的作用,其任何变化都可能影响抗生素耐药性。本研究中,细菌获得PB耐药后,RND和MATE家族不同的外排泵基因及部分调控基因均参与了PB耐药表型的发生,由于外排泵具有广泛底物外排特性及相互之间对耐药机制贡献的复杂性,推测多种外排泵系统的联合作用影响PB的抗菌效果。加强外排泵与PB耐药的相关机制研究,积极研发新型外排泵抑制剂,可有效控制外排泵系统活动变化导致的耐药现象,同时,严格控制抗菌药物的不合理使用、避免敏感菌发展为耐药菌仍是重中之重,临床医师应引起高度重视。
