有氧运动对APP/PS1小鼠脑血流量的影响及其机制
2022-02-04房国梁黎超洋崔凯茵
房国梁 黎超洋 崔凯茵
国家体育总局体育科学研究所(北京 100061)
阿尔茨海默症(Alzheimer’s disease,AD)是一种神经系统退行性疾病,其主要临床特征是记忆力逐渐衰退并伴有语言障碍和行为改变;其病理学改变为出现脑内老年斑(senile plaque,SP)[1]、形成神经纤维缠结(neurofbrillary tangles,NFTs)[2]、大脑皮质细胞数量减少[3]以及皮质动脉和小动脉血管淀粉样变性[4]等。该病不仅给患者带来巨大痛苦,而且给社会和家庭带来沉重负担。如何有效预防和延缓AD 已成为不容回避的社会公共健康问题之一,具有深远而重大的研究意义。
研究发现,AD 的病理过程与脑血流量关系密切。脑血管功能障碍常发生在AD 的早期[5,6],脑灰质内血流量减少可达40%以上[7]。因此,可将脑血流量(cerebral blood flow,CBF)减少作为AD 发生的早期标志[5]。现有研究表明,在AD的病理过程中β-淀粉样蛋白(amyloid β-protein,Aβ)与脑血流量关系密切,外源性Aβ能降低脑血流量(cerebral blood flow,CBF)[8],而CBF减少又能诱导Aβ的产生[9],但是其具体机制尚未完全明确。Nortley 等的研究揭示Aβ能够诱导脑微血管内皮细胞内的NADPH 氧化酶产生活性氧(reactive oxygen species,ROS),ROS 能够激活内皮素-1A(endothelin-1 type A,ETA)受体,释放内皮素1(endothelin 1,ET-1),从而引发脑微血管强烈收缩,减少CBF[10]。
大量研究表明,体育运动,尤其是有氧运动能够有效延缓大脑认知功能衰退,提高大脑学习和记忆功能[11-15],并且有氧运动能够降低AD模型动物脑内Aβ的水平,提高认知功能[16]。那么有氧运动在延缓和改善AD过程中,是否也能通过减少Aβ诱导产生的ROS,阻断ETA 受体激活,减少ET-1 释放,从而抑制脑微血管收缩,提高CBF?围绕该问题,本研究探讨了8 周有氧运动对AD 模型APP/PS1 小鼠大脑皮质和海马组织血流量的影响及其可能机制,为阐明有氧运动预防和延缓阿尔茨海默症提供一定的理论依据。
1 材料与方法
1.1 有氧运动小鼠模型的建立
8 月龄雄性APP/PS1 小鼠20 只和8 月龄雄性C57BL/6J 小鼠20 只,每笼2 只。所有小鼠均自由进食和饮水,每天昼夜间隔12 h,环境温度保持在20℃±2℃,相对湿度保持在40%~60%。经过1周的适应性饲养后,APP/PS1 小鼠和C57BL/6J 小鼠均随机分为安静对照组(CG 组)和运动组(EG 组)。其中APP/PS1 小鼠标注为T-CG 组(n=10)和T-EG 组(n=10),C57BL/6J小鼠标注为W-CG组(n=10)和W-EG组(n=10)。在适应性训练阶段,所有小鼠每天跑台训练10 min,速度9 m/min,周一至周五训练。然后,T-EG和W-EG组小鼠进行正式跑台训练,训练周期为8 周。通过动物气体代谢分析系统测定小鼠VO2max,使小鼠训练强度维持在70% VO2max,在8 周时间内跑台速度从12 m/min 增至15 m/min。训练时间从30 min增至60 min,跑台坡度为0o。每周一至周五训练,周六、日休息。T-CG和WCG组小鼠则一直处于安静状态。在训练过程中,密切观察小鼠生活和训练情况。
1.2 Morris水迷宫实验
在第9 周采用Morris 水迷宫实验检测各组小鼠定位航行和空间探索行为能力,判断各组小鼠学习记忆和空间记忆能力。在最初的5 天时间里,小鼠面向池壁,每天从固定一个象限进入水中,记录从入水至找到平台的时间及逃避潜伏期。如果小鼠在2 min 内找不到平台,则由实验者将其引向平台,记录120 s 的潜伏期。每只小鼠每天测试4 次,间隔至少15 min。第6天,移除平台,将小鼠从面向池壁的同一象限放入水中。记录小鼠入水后60 s 内游泳通过平台的次数,评价小鼠的空间记忆能力[16]。
1.3 核磁共振成像
Morris 水迷宫实验结束12 h 内,所有小鼠禁食不禁水。然后采用Discovery MR750 3.0T 系统进行核磁共振成像。每只小鼠用10 %水合氯醛溶液(0.3 mL/ 100 g)腹腔麻醉,并置于俯卧位,然后扫描。系统配备小鼠脑专用线圈,扫描小鼠头部,对采集得到的原始数据利用Functool软件进行图像矫正等预处理,获得CBF参数图,在双侧皮质及海马设置4个感兴趣区,测得CBF平均值,记录数据[17]。
1.4 取材与指标检测
1.4.1 取材
核磁共振成像实验结束后,所有小鼠按照50 mg/kg体重以戊巴比妥钠腹腔麻醉,然后断头取脑,在冰上迅速分离左侧大脑皮质前额叶区和两侧海马组织,将样品保存在液氮中。
1.4.2 ROS检测
各组随机取5只小鼠大脑皮质或海马组织进行连续冷冻切片,厚度20 μm。新鲜切片直接浸入10 μmol /L的DCFH-DA溶液中,37℃孵育20 min,用PBS洗涤3次后封片。荧光显微镜下观察,每张切片选取4个相同位置视野,统计DCFH-DA阳性细胞数量。然后计算ROS相对含量。
1.4.3 Western blot实验
取各组5 只小鼠的大脑皮质或海马组织适量,放入研钵中,加液氮研磨。然后转入1.5 mL EP管中,迅速加入蛋白裂解液裂解。完全裂解后,在4℃离心机中以12000×g 离心10 min。将上清液转入一个新的EP管中,加入蛋白上样缓冲液,在100℃水浴中变性5 min。经SDS-PAGE电泳后,将蛋白转移至硝酸纤维素膜,室温下用5%脱脂奶粉(溶于TBST 溶液中)封闭1 h。然后用稀释的一抗(ET-1、Aβ42抗体购自Abcam 公司)4℃孵育过夜。第二天,用TBST溶液洗膜3次,每次5 min,去除残留的一抗。然后用稀释的二抗(HRP 标记山羊抗兔IgG和HRP标记山羊抗小鼠IgG均从Beyotime 公司购买)室温孵育1 小时后,用TBST 溶液洗膜4次,每次5 min,去除残留的二抗。最后用ECL 化学发光试剂和X 光片对蛋白质信号进行检测。用Image J专业软件分析不同靶蛋白的灰度值。
1.5 统计学方法
应用SPSS 25.0软件进行数理统计分析。Morris水迷宫实验所得到的潜伏期数据采用三因素重复测量方差分析(时点×小鼠品系×运动方式),其不满足球形度检验,使用Greenhouse Geisser(G-G)对潜伏期结果的自由度进行校正,采用最小显著性差异法(LSD)进行单独效应检验;而小鼠穿越站台次数的统计学方法则采用广义线性模型(GLM),并选择泊松分布簇和对数连接函数进行分析。小鼠CBF、ROS、Aβ42以及ET-1数据则采用双因素方差分析,将运动方式和小鼠品系作为组间主效应,分析二者交互效应。若存在交互作用,则进一步采用LSD法进行单独效应检验;若无交互作用,则进行主效应检验。符合正态分布数据采用平均值± 标准差进行描述统计,其他分布数据则采用中位数和四分位间距进行描述统计。运用Prism GraphPad 8.0软件绘图,界定P<0.05为差异具有统计学意义。
2 结果
2.1 有氧运动对APP/PS1 和C57BL/6J 小鼠认知功能的影响
本研究首先通过Morris 水迷宫实验判断有氧运动对APP/PS1及C57BL/6J小鼠学习记忆和空间记忆的影响。表1 为Morris 水迷宫潜伏期数据的描述统计。对Morris 水迷宫潜伏期数据进行三因素重复测量方差分析,结果表明不存在二级交互效应(P=0.282),但小鼠潜伏期存在时点的主效应[F(2.89,104.16)=451.606,偏η2=0.926,P<0.001];此外,还存在时点×小鼠品系以及时点×运动方式之间的一级交互效应[时点×小鼠品系F(2.89,104.16)=8.153,偏η2=0.185,P<0.001;时点×运动方式F(2.89,104.16)=6.206,偏η2=0.147,P<0.001]。进一步的一级交互效应的单独效应检验结果表明:固定小鼠品系相比较,潜伏期均随着训练天数的递增而缩短(P<0.05)。另外,小鼠品系之间5天的潜伏期差异都具有统计学意义(P<0.001),APP/PS1 小鼠的潜伏期均高于C57BL/6J 小鼠;同时,固定运动方式相比较,潜伏期也均随着训练天数的递增而缩短(P<0.05),并且除第1 天外(P=0.275),其余时间点运动方式之间潜伏期的差异都具有统计学意义(P<0.01),安静对照组小鼠的潜伏期均高于运动组小鼠。具体的4组间的两两比较见表1:与W-CG组相比,W-EG组潜伏期在第2天开始出现统计学意义上的减少(P<0.05);与W-CG 组相比,T-CG 组潜伏期在第1天开始出现统计学意义上的增加(P<0.05);与T-CG 组相比,T-EG 组潜伏期在第3天开始出现统计学意义上的减少(P<0.01);与W-EG组相比,T-EG 组潜伏期在第1天开始出现统计学意义上的增加(P<0.01)。以上结果表明,C57BL/6J小鼠学习记忆能力总体高于APP/PS1 小鼠,且无论小鼠是否存在品系差异,8 周有氧运动可提高小鼠学习记忆能力,从而缩短Morris水迷宫的潜伏期。
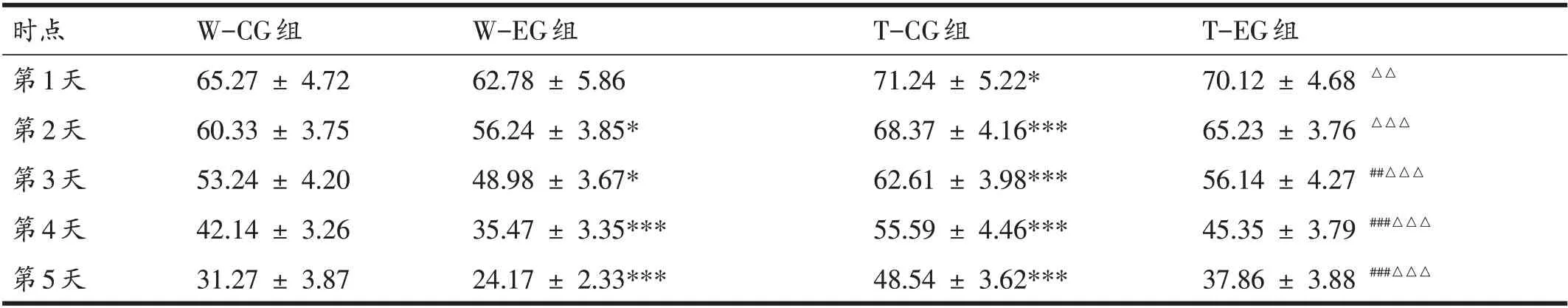
表1 Morris水迷宫实验各组小鼠潜伏期变化(s)
第6 天进行空间探索实验,各组小鼠运动轨迹图如图1A 所示。表2 是小鼠穿越站台次数的描述统计。广义线性模型—泊松对数线性分析结果表明:小鼠穿越站台次数不存在小鼠品系×运动方式之间的交互效应(交互效应P=0.879),但存在小鼠品系和运动方式的主效应(图1B,小鼠品系P<0.01;运动方式的主效应P<0.05)。上述结果说明,无论是否进行了运动干预,APP/PS1 小鼠的空间记忆能力均低于C57BL/6J 小鼠;同时,无论小鼠品系是否有差异,8 周有氧运动均能够改善这两种品系小鼠的空间记忆能力。
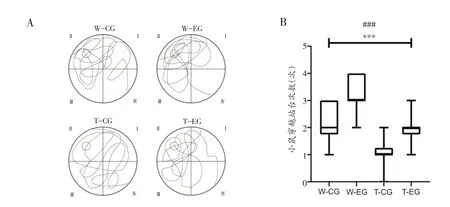
图1 各组小鼠穿越站台次数

表2 Morris水迷宫实验各组小鼠穿越站台次数
上述结果说明8 周有氧运动能够提高APP/PS1 及C57BL/6J小鼠学习记忆和空间记忆能力。
2.2 有氧运动对APP/PS1 和C57BL/6J 小鼠脑血流量的影响
本研究通过小动物核磁共振成像系统检测了有氧运动后APP/PS1及C57BL/6J小鼠脑部双侧皮质及海马区血流量(图2A)。如图所示,4 组小鼠大脑皮质CBF(图2B)分别为:W-CG 组1.07 ± 0.08 mL/g/min、WEG组1.28 ± 0.12 mL/g/min、T-CG组0.90 ± 0.06 mL/g/min、T-EG 组1.06 ± 0.08 mL/g/min;海马组织CBF(图2C)分别为:W-CG 组1.28 ± 0.08 mL/g/min、WEG组1.45 ± 0.15 mL/g/min、T-CG组1.09 ± 0.07 mL/g/min、T-EG 组1.23 ± 0.05 mL/g/min。从图2 可以发现,在大脑皮质和海马组织中CBF 均存在小鼠品系的主效应[大脑皮质F(1,36)=49.01,偏η2=0.577,P<0.001;海马F(1,36)=45.84,偏η2=0.560,P<0.001];同时,也存在运动方式的主效应[大脑皮质F(1,36)=45.25,偏η2=0.557,P<0.001;海马F(1,36)=26.16,偏η2=0.421,P<0.001]。上述结果表明,APP/PS1 小鼠与野生型C57BL/6J 小鼠相比,其大脑皮质和海马组织中的血流量较低;而无论小鼠品系如何,经过8 周有氧运动,均能够提高APP/PS1以及C57BL/6J小鼠大脑皮质和海马组织的血流量。
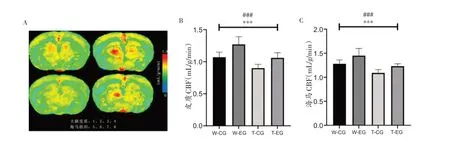
图2 大脑皮质和海马组织CBF
2.3 有氧运动对APP/PS1 和C57BL/6J 小鼠大脑皮质和海马组织ET-1含量的影响
有氧运动后APP/PS1和C57BL/6J小鼠大脑皮质和海马组织ET-1 含量见图3A。4 组小鼠大脑皮质ET-1相对含量(图3B)分别为:W-CG 组100.00% ±14.65%、W-EG组63.07% ± 15.96%、T-CG组151.40%± 10.00%、T-EG 组104.35% ± 14.05%;海马组织ET-1 相对含量(图3C)分别为:W-CG 组100% ± 10.49%、W-EG 组53.40% ± 16.41%、T-CG 组176.20% ±11.35%、T-EG 组98.19% ± 13.73%。实验发现,小鼠大脑皮质中的ET-1 相对含量存在小鼠品系和运动方式的主效应[图3B,小鼠品系主效应F(1,16)=56.44,偏η2=0.779,P<0.001;运动方式主效应F(1,16)=46.33,偏η2=0.743,P<0.001],而海马组织中则存在小鼠品系×运动方式之间的交互效应[图3C,交互效应F(1,16)=6.421,偏η2=0.286,P=0.022]。在大脑皮质中(图3B),APP/PS1 小鼠与野生型C57BL/6J 小鼠的ET-1 相对含量差异具有统计学意义,且APP/PS1 小鼠高于C57BL/6J 小鼠;同时,8 周的有氧运动均能够使两种品系小鼠大脑皮质中的ET-1相对含量下降。而海马组织中(图3C),8周有氧运动后,小鼠ET-1相对含量存在运动方式的单独效应(P<0.001),分别比较W-CG 与W-EG组以及T-CG 与T-EG 组,W-EG 和T-EG 组的ET-1 相对含量下降;同时小鼠ET-1相对含量也存在小鼠品系的单独效应(P<0.001),W-CG和W-EG组的ET-1相对含量都分别低于T-CG 和T-EG 组。上述结果说明,在大脑皮质和海马组织中,APP/PS1 小鼠的ET-1 比C57BL/6J 野生型小鼠高。而8 周有氧运动能够降低APP/PS1 及C57BL/6J 小鼠大脑皮质和海马组织ET-1含量。
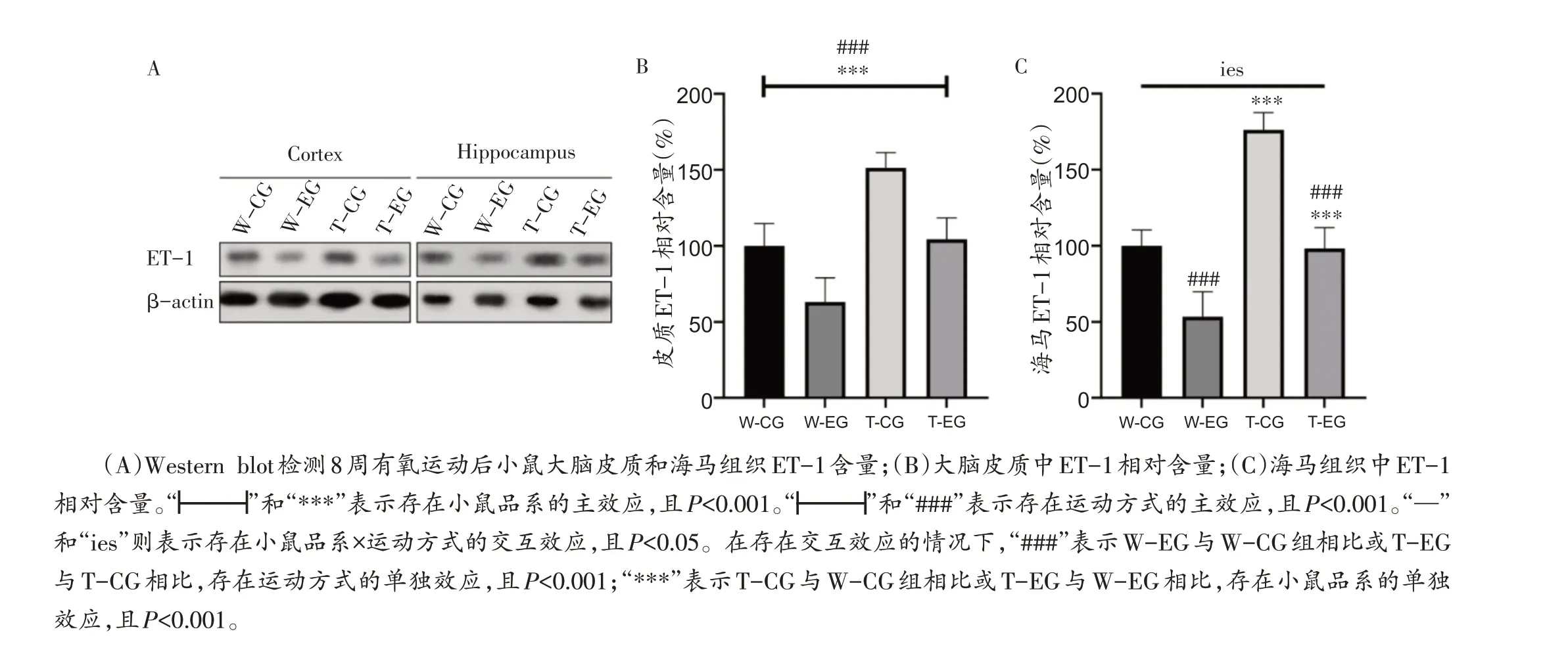
图3 大脑皮质和海马组织ET-1相对含量
2.4 有氧运动对APP/PS1 和C57BL/6J 小鼠大脑皮质和海马组织ROS水平的影响
本研究检测了有氧运动后APP/PS1和C57BL/6J小鼠大脑皮质和海马组织ROS 相对含量。4 组小鼠大脑皮质ROS 相对含量(图4A)分别为:W-CG 组100.00%± 13.40%、W-EG 组62.13% ± 15.20%、T-CG 组159.11% ± 10.96%、T-EG 组96.70% ± 13.13%;海马组织ROS 相对含量(图4B)分别为:W-CG 组100.00%± 9.92%、W-EG 组51.82% ± 20.57%、T-CG 组178.29% ± 12.88%、T-EG 组94.65% ± 15.43%。ROS检测结果表明,小鼠大脑皮质中的ROS 存在运动方式和小鼠品系的主效应[图4A,运动方式主效应F(1,16)=68.49,偏η2=0.811,P<0.001;小鼠品系主效应F(1,16)=59.77,偏η2=0.789,P<0.001];而小鼠海马组织中,则存在小鼠品系×运动方式之间的交互效应[图4B,交互效应F(1,16)=6.61,偏η2=0.292,P=0.021]。无论是否进行运动干预,APP/PS1 小鼠的大脑皮质ROS 相对含量均高于C57BL/6J 小鼠;同时,无论小鼠品系如何,运动均可以降低大脑皮质中ROS相对含量。而在小鼠海马组织的ROS 检验结果中我们可以发现,分别比较W-CG 组与W-EG 以及T-CG 与T-EG 组,W-EG 和TEG组的ROS相对含量均下降,提示存在运动方式的单独效应(P<0.001);同时,在海马组织中,W-CG 和WEG 组的ROS 相对含量都分别低于T-CG 和T-EG 组,提示存在小鼠品系的单独效应(P<0.001)。上述结果表明,在大脑皮质和海马组织中,APP/PS1 小鼠的ROS相对含量比C57BL/6J 野生型小鼠高,但8 周有氧运动可以降低两种小鼠大脑皮质和海马中ROS相对含量。
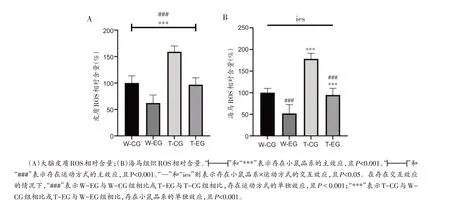
图4 大脑皮质和海马组织ROS相对含量
2.5 有氧运动对APP/PS1 和C57BL/6J 小鼠大脑皮质和海马组织Aβ水平的影响
有氧运动后APP/PS1和C57BL/6J小鼠大脑皮质和海马组织Aβ42的含量见图5A。经过8周跑台训练后,4组小鼠大脑皮质Aβ42相对含量(图5B)分别为:W-CG组100.00% ± 11.58%、W-EG组52.65% ± 18.88%、TCG 组237.91.11% ± 9.33%、T-EG 组150.38% ±13.72%;海马组织Aβ42相对含量(图5C)分别为:W-CG组100.00% ± 9.93%、W-EG 组51.82% ± 14.76%、TCG 组315.60% ± 8.90% 、T- EG 组198.84% ±12.14%。分析结果表明,小鼠大脑皮质和海马组织中的Aβ42相对含量均存在小鼠品系×运动方式之间的交互效应[图5B、图5C,皮质交互效应F(1,16)=7.00,偏η2=0.305,P=0.018;海马交互效应F(1,16)=20.34,偏η2=0.560,P<0.001]。随后对皮质和海马中Aβ42进行单独效应检验发现,在两种不同的组织中,都存在运动方式和小鼠品系的单独效应。固定运动方式,分别比较WCG 与T-CG,以及W-EG 与T-EG,发现在大脑皮质和海马组织中T-CG和T-EG组Aβ42的相对含量分别高于W-CG 和W-EG(P<0.001);同时,固定小鼠品系,分别比较W-EG 与W-CG 组以及T-EG 与T-CG 组,发现在大脑皮质和海马组织中W-EG 和T-EG 组的Aβ42的相对含量分别低于W-CG和T-CG组(P<0.001)。上述结果说明,在大脑皮质和海马组织中,APP/PS1小鼠的Aβ42相对含量要比C57BL/6J 野生型小鼠高,而8 周有氧运动能够降低APP/PS1及C57BL/6J小鼠大脑皮质和海马组织Aβ42水平。
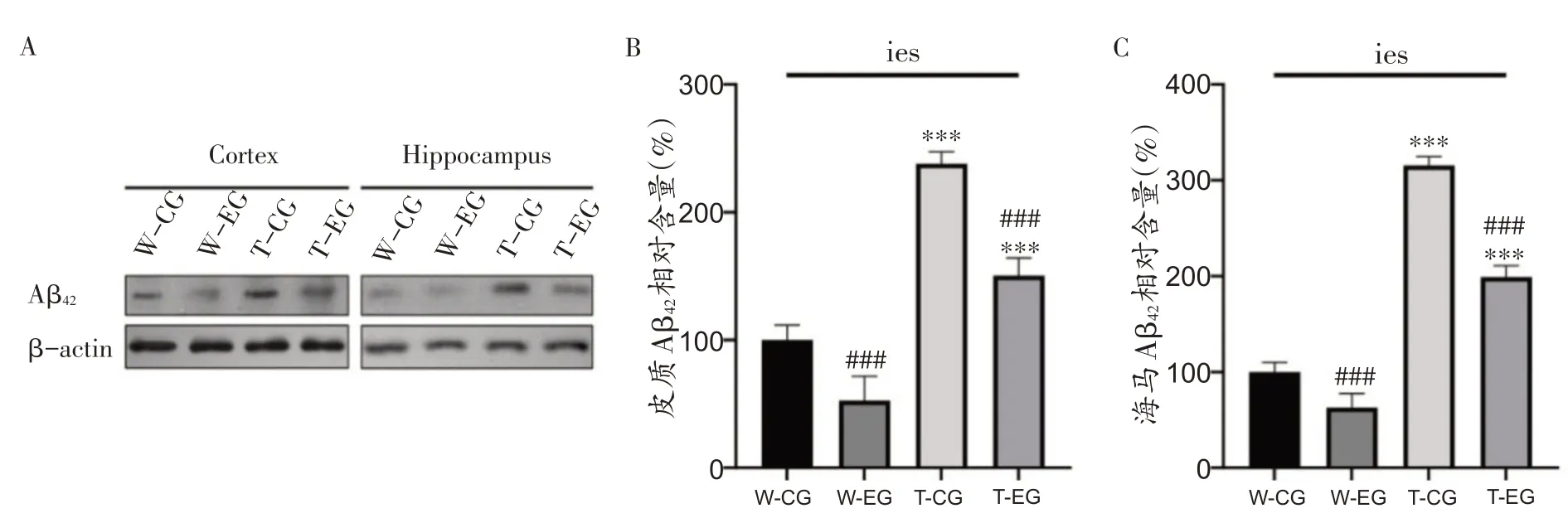
图5 大脑皮质和海马组织Aβ42相对含量
3 讨论
大脑是人体最高级神经中枢,新陈代谢十分旺盛。尽管重量仅占体重的2%~3%,却是人体消耗氧气和能量最高的器官,占人体总氧气消耗量的20%以上。因大脑本身不具备储存氧气及能量的功能,需要血液通过高度复杂的脑血管组织向大脑运输氧气、葡萄糖和营养物质,同时在小动脉和微血管处进行物质交换,带走代谢产生的废物。因此,稳定充裕的CBF供应对于维持大脑正常生理功能具有重要作用。近些年来研究发现,AD 的病理过程与CBF 关系密切。AD 最早期的症状就是CBF减少[5,6],脑灰质内血流量减少可达40%以上[7]。因此可将CBF减少作为AD发生的早期标志[5]。我们在实验中发现,与野生型C57BL/6J小鼠相比,AD模型APP/PS1小鼠大脑皮质和海马组织CBF较低,分别仅为C57BL/6J小鼠CBF的84%和85%。
Aβ的产生是AD最为显著的特征。先前的研究表明,Aβ对血管内皮细胞具有明显的毒性作用,可以影响一氧化氮合酶的活性,减少NO 的生成[18]。而NO 具有扩张血管的作用,因此Aβ能够造成脑血管收缩,降低CBF。CBF 的减少又会促进β-淀粉样蛋白前体蛋白APP 转变为具有毒性作用的Aβ[9]。目前对外源性Aβ的效应研究还主要集中在动脉和小动脉上[8],而脑内大多数血管阻力位于微血管[19]。Nortley 等的研究结果表明Aβ能够刺激微血管周细胞,引发AD患者及AD模型小鼠脑部微血管收缩,降低CBF,这可能是AD 早期CBF减少的主要原因[10]。微血管周细胞是具有伸缩性的平滑肌细胞样细胞,覆盖在微血管的基底面,其主要功能是参与中枢神经系统微血管收缩性、内皮细胞活性及巨噬细胞活性的调节。研究人员发现,Aβ聚集在AD 患者及AD 模型小鼠脑部微血管周围,诱导周细胞内的NADPH氧化酶产生ROS,ROS能够激活周细胞内皮素-1A(endothelin-1 type A,ETA)受体,释放具有强烈收缩血管功能的活性肽ET-1,从而引发周细胞和微血管的强烈收缩[10]。研究人员通过计算,发现这种收缩足以使CBF减半,这与受AD影响的CBF减少相当。而抑制周细胞引发的微血管收缩能够减少AD 的能量缺乏和神经退行性病变[10]。该项研究为早期预防和治疗AD 开辟了一个全新领域。我们在实验中同样发现,与野生型C57BL/6J小鼠相比,APP/PS1小鼠大脑皮质和海马组织Aβ含量、ROS 水平以及ET-1 的分泌量较高,这可能是造成大脑皮质和海马组织CBF 降低的主要原因。
长期的有氧训练能够改善AD 模型小鼠的空间记忆能力并延缓认知功能衰退进程[20]。经常参加体育运动的老年人AD的发病风险显著降低[21]。此外,参加体育运动的AD 患者脑内β-淀粉样蛋白(amyloid β-protein,Aβ)水平降低[22]。这为预防和改善AD提供了一种健康可行且有效的策略,但是相关的生物学机制尚不明确。
体育运动能够显著改善脑血管功能,提高CBF。在一项临床试验中,将30名轻度认知障碍患者随机分为两组,进行12个月的干预,一组进行有氧训练,另一组作为对照仅进行伸展训练,两组均进行25~30 分钟的训练,每周3次,12个月后有氧训练组受试者心肺功能和记忆功能得到改善,并且与拉伸组相比,其脑前扣带回皮质CBF增加;此外,个体间的记忆改善程度与前扣带回皮质和邻近前额叶皮质的CBF增加有关[23]。在一项对帕金森病患者的干预试验中发现,经过2 个月的上肢运动后,神经影像学分析显示,与训练前相比,左侧初级运动皮质区、辅助运动皮质区和小脑皮质的CBF明显增加,双侧苍白球与右侧中央盖、右侧后扣带回和左侧感觉运动皮质的功能连接增强[24]。Borror等[25]的研究发现,在急性有氧运动后,CBF 和氧化应激增加,并且促进了脑源性神经营养因子BDNF 的释放,从而解释了认知能力的提高。运动引起CBF增加并能介导血管生成生长因子的局部诱导和全身释放。长期有氧运动可以改变基因表达,增加动脉直径,并从原先存在的微血管处分支生成新的微血管,血管细胞基因表达的改变和微血管的生成增加了血流能力,从而改善血流控制[26]。我们在实验中发现,8 周有氧运动后,APP/PS1和C57BL/6J小鼠学习记忆和空间记忆能力提高,大脑皮质和海马组织血流量增加。分析其原因可能是8周有氧运动降低了Aβ水平,抑制了ROS的产生,从而能够有效抑制周细胞ETA受体的激活,减少ET-1的释放,抑制了毛细血管收缩,提高CBF 和认知水平,从而延缓和改善神经退行性特征。
4 结论
β-淀粉样蛋白能够诱导活性氧的产生,提升内皮素1 的含量,造成大脑皮质和海马组织血流量降低。而8 周有氧运动能够降低APP/PS1 小鼠大脑皮质和海马组织中β-淀粉样蛋白含量和活性氧水平,减少内皮素1的释放,提高脑血流量和认知水平,对延缓和改善阿尔茨海默症具有积极作用。
