幽门螺杆菌对左氧氟沙星、克拉霉素耐药性及基因突变分析*
2022-02-03邰萍尹思洁何帮顺张振玉林康蔺昕
邰萍,尹思洁,何帮顺,张振玉,林康,蔺昕
(南京医科大学附属南京医院a.医学检验科,b.消化内科,南京 210006)
幽门螺杆菌(Helicobacterpylori, Hp)是一种革兰阴性、微需氧的螺旋杆菌,能特异性地在胃上皮细胞表面黏液层定植,并成为多种胃部疾病(如慢性胃炎、胃溃疡、胃癌及胃黏膜相关淋巴样组织淋巴瘤等)的重要致病因素[1-4]。最新数据显示,Hp感染率高达50%~90%[5]。目前用于根治Hp的联合用药包括抑酸剂、抗菌药物以及铋剂[6]。然而,随着药物的广泛应用,Hp对抗菌药物的耐药性在逐年升高导致根除率不断下降。因此,探讨Hp对抗菌药物的耐药性、耐药机制显得尤为重要。
我国现阶段在推荐用于Hp根治的6种抗菌药物中,甲硝唑耐药率最高,已不推荐使用;对克拉霉素和左氧氟沙星的耐药亦处于较高水平;而阿莫西林、四环素和呋喃唑酮的耐药率尚较低,用药时无需先行药物敏感试验[7],但考虑到四环素和呋喃唑酮不良反应较大,提出个体化精准治疗,以期达到更好的根除率。Hp对喹诺酮类抗菌药物左氧氟沙星耐药主要与由gyrA基因编码的喹诺酮类药物耐药决定区(quinolone resistance-determining regions,QRDRs)突变引起的87Asn、91Asp氨基酸置换有关[8];而对克拉霉素的耐药多与23S rRNA V区上的点突变有关[9]。
本研究主要了解从门诊患者体内分离的Hp对左氧氟沙星和克拉霉素的耐药性,并探究其耐药基因型与耐药表型的相关性,为临床制定Hp个体化根除治疗方案提供实验依据。
1 材料与方法
1.1研究对象 选择在南京医科大学附属南京医院消化内科就诊,有上腹痛、上腹胀、早饱、嗳气、反酸、恶心等症状的疑似胃炎患者,经尿素呼气试验(urea breath test,UBT)或Hp病理组织学检测为阳性,且Hp培养阳性的感染病例。病例临床信息完整,且均在胃镜室采集过胃组织活检标本,收集诊疗完成后的胃黏膜组织。排除标准:(1)内镜检查证明有活动性出血者;(2)近2周内服用过质子泵抑制剂、H2受体拮抗剂以及近4周内服用过抗菌药物、铋剂者;(3)患者同时服用非甾体抗炎药或酗酒者;(4)妊娠或哺乳期;(5)存在影响本研究结果的严重疾病,如严重肝病、心脏病、呼吸系统疾病等;(6)采集、运输、保存不符合要求的组织样本;(7)耐药性研究中Hp培养不成功的病例。针对左氧氟沙星和克拉霉素耐药开展2个独立的研究,收集病例如下。(1)2021年6—12月纳入左氧氟沙星耐药性研究292例,其中男性151例,女性141例;年龄19~75岁,≤40岁98例(33.56%),>40岁194例(66.44%);临床诊断为食管炎、胃炎或十二指肠球炎,其中伴有溃疡68例(23.29%),伴有息肉11例(3.77%)。(2)2018年8月至2019年3月纳入克拉霉素耐药性研究350例,其中男性205例,女性145例;年龄18~80岁,≤40岁114例(32.57%),>40岁236例(67.43%);临床诊断也均为食管炎、胃炎或十二指肠球炎,其中伴有溃疡93例(26.57%),伴有息肉27例(7.71%)。本研究经医院伦理委员会批准(编号:QX20210419-01)。所有研究对象知情同意。
1.2样本保存和处理 将胃黏膜组织样本置入含有2 mL无菌生理盐水中制成菌悬液,3 h内送至实验室。所采集的新鲜样本可立即测试或存储待测,2~8 ℃不超过24 h,(-20±5) ℃不超过3个月,-70 ℃以下不超过24个月。
1.3主要仪器及试剂 A300 PCR仪(杭州朗基公司),PowerPac系列电泳仪(美国伯乐公司),3500dx Genetic Analyzer基因分析仪及配套测序反应试剂(美国ABI公司)。左氧氟沙星药敏条(郑州安图生物公司),克拉霉素药敏条(温州康泰公司),磁珠法核酸提取试剂(上海芯超公司)。
1.4方法 (1)培养成功后抗菌药物(左氧氟沙星、克拉霉素)药敏试验:用接种环将胃黏膜组织连同菌悬液接种在哥伦比亚血平板培养基上,放入三气培养箱(设置培养参数为O2:5%,CO2:10%,温度:37 ℃,下同)培养3~5 d,经二代培养后配制成1.0麦氏浓度(3×108CFU/mL)的菌悬液,涂布在哥伦比亚血平板培养基上,分别将左氧氟沙星药敏条(E试验法)和克拉霉素药敏条(E试验法)贴于平板,培养3 d后判读最低抑菌浓度(minimum inhibitory concentration, MIC)值。质控菌株为Hp标准株NCTC11637。依据欧盟药敏试验标准委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)耐药判定标准(Version8.0, 2018)进行药敏结果判断,左氧氟沙星MIC值>1 mg/L时为耐药,克拉霉素MIC值>0.5 mg/L时为耐药。(2)核酸测序试验:将入组的菌悬液经核酸提取(磁珠法)后送至上海吉凯医学检验所完成基因测序。核酸提取液经A300 PCR仪扩增,再经电泳、纯化后在3500dx Genetic Analyzer基因分析仪上完成双向测序。PCR与测序共用引物序列设计如下:23S rRNA-F:5′-AATGGCGTAACGAGATGGGAG-3′,23S rRNA-R:5′-TCCATAAGAGCCAAAGCCCTTAC-3′,产物190 bp;gyrA-F(278 bp):5′-ATTCCATGAGCGT
GATCATAGG-3′,gyrA-R:5′-GTTATCGCCATCAATA
GAGCCAAA-3′,产物278 bp。PCR扩增体系25 μL,包含缓冲液5 μL,dNTP 2 μL,双向引物各0.6 μL,Hs Taq DNA聚合酶0.4 μL,ddH2O 11.4 μL,DNA模板5 μL。PCR反应条件为:94 ℃预变性5 min;94 ℃变性10 s,55 ℃退火20 s,72 ℃延伸50 s,共40个循环;72 ℃最终延伸5 min。使用基因分析软件GeneMapper v4.1(美国ABI公司)对检测结果进行分析及解释。
1.5统计学分析 应用SPSS 26.0软件进行。计数资料以例数和百分数表示,组间率的比较采用卡方检验,耐药基因型和表型的一致性分析采用配对卡方检验(McNemar)和Kappa值来表示,以P<0.05为差异有统计学意义。
2 结果
2.1耐药率结果 入组左氧氟沙星耐药性研究的292例病例中,体外药敏试验(表型)结果中耐药120例(41.10%),敏感172例(58.90%);入组克拉霉素耐药性研究的350例病例中,体外药敏试验(表型)结果中耐药168例(48.00%),敏感182例(52.00%)。
2.2耐药率在不同人群中的分布情况 左氧氟沙星的耐药率在男性中为35.10%(53/151),女性中为47.52%(67/141),差异有统计学意义(χ2=4.645,P=0.031);耐药率在年龄≤40岁病例中为24.49%(24/98),>40岁病例中为49.48%(96/194),差异有统计学意义(χ2=16.803,P<0.01)。
克拉霉素耐药率在男性中为44.88%(92/205),在女性中为52.41%(76/145),差异无统计学意义(χ2=1.932,P=0.165);耐药率在年龄≤40岁的病例中为42.98%(49/114),>40岁病例中为50.42%(119/236),差异无统计学意义(χ2=1.705,P=0.192)。
2.3核酸测序试验(基因型)结果 入组左氧氟沙星耐药性研究的292例病例中,169例(57.88%)未发现突变,123例(42.12%)发现至少含有一种突变,其中117例(95.12%)检测有单个突变(第87位的突变73例,第91位的突变44例),gyrA突变率最高的为Asn87Lys(50.41%);5例检测出含有2个位点突变(4.07%);1例检出含有3个位点同时突变(0.81%),见表1。
克拉霉素耐药性研究的350例病例中,168例(48.00%)未检出突变,182例(52.00%)检出至少含有一种突变,其中173例(95.05%)含有单基因突变(A2143G突变171例,A2142C和A2142G各1例),9例(4.95%)检出含有2个位点突变(8例A2142G/A2143G,1例A2143G/A2142C)。
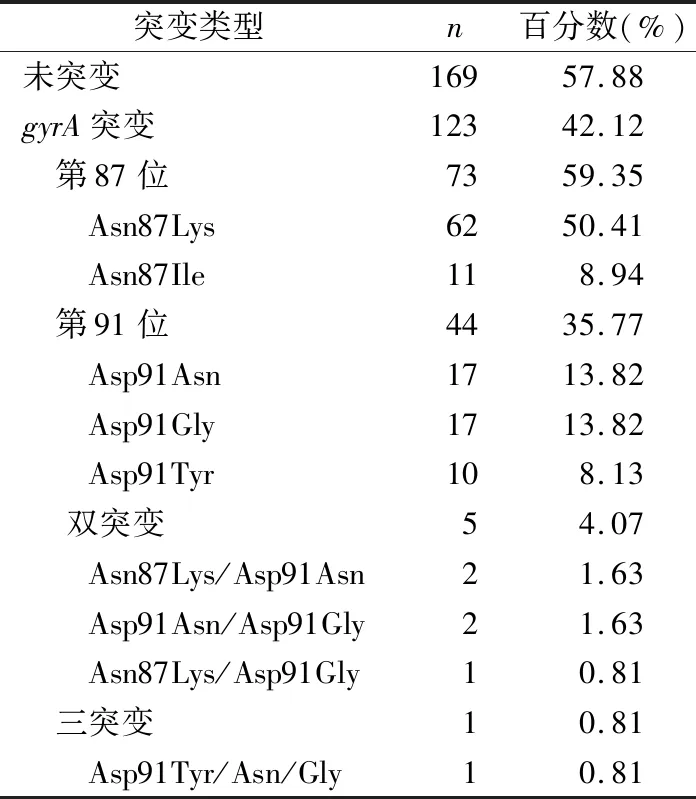
表1 左氧氟沙星核酸测序试验(基因型)结果
2.4耐药性在基因型和表型中的一致性结果 左氧氟沙星的耐药基因型与表型结果的符合率为97.60%,率的差异无统计学意义(McNemar检验P=0.453);一致性结果为Kappa=0.951(P<0.01)。
克拉霉素的耐药基因型与表型结果的符合率为89.71%,率的差异有统计学意义(McNemar检验P=0.029);但一致性检验显示二者具有显著的一致性(Kappa=0.795,P<0.01)。见表2。
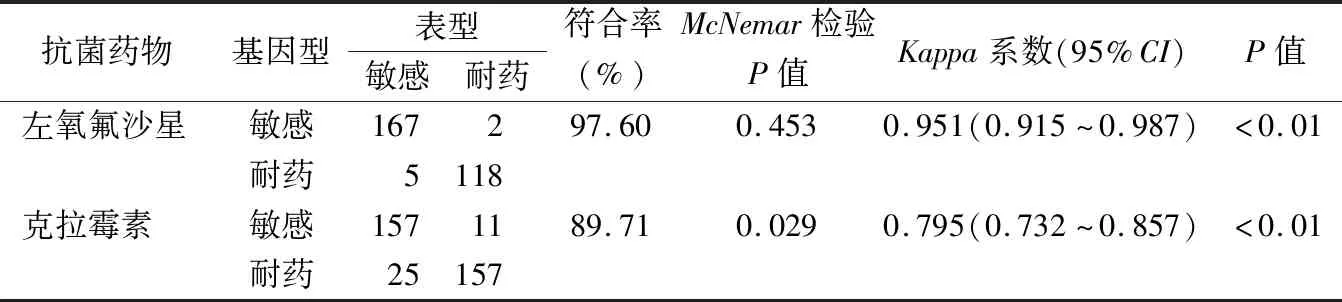
表2 耐药性在基因型和表型中的一致性分析
左氧氟沙星耐药性常见的突变点发生在gyrA基因的第87位和第91位密码子,比较这2个突变位点与耐药表型的一致性,结果显示一致性较好,且第87位突变(Kappa=0.951,P<0.01)的一致性略高于第91位(Kappa=0.943,P<0.01)。见表3。
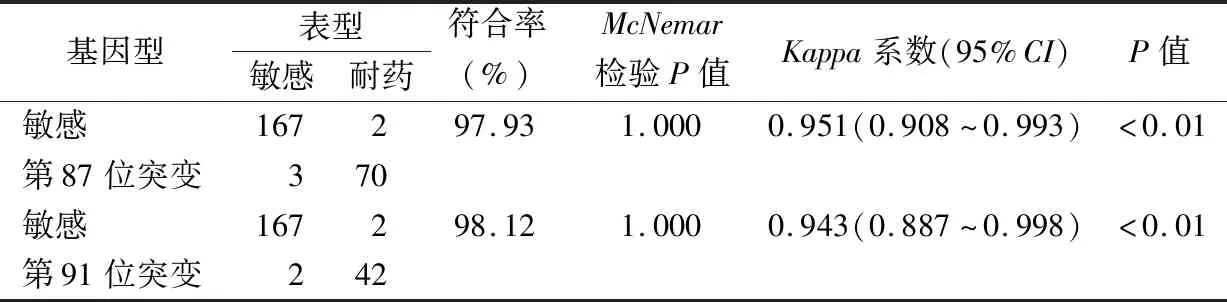
表3 左氧氟沙星2个突变位与耐药表型结果的一致性分析
3 讨论
本研究结果显示,左氧氟沙星耐药率为41.10%,且患者不同性别、年龄间差异均有统计学意义;基因型突变率42.12%,与表型有较好的一致性。克拉霉素耐药率为48.00%,患者不同性别、年龄间差异均无统计学意义;基因型突变率为52.00%,与表型一致性也较高。
有研究显示,我国Hp感染率为44.2%,存在地区差异性,西北地区感染率最高(51.8%),其次是东部(47.7%)、西南(46.6%),其他4个地区(华北、东北、华中、华南)的患病率约为40%[5],近10年来感染率有所下降,这可能与经济、环境的改变密切相关。与此同时,近年来由于抗菌药物的大量使用,Hp对抗菌药物的耐药性在全世界范围内快速上升,这对治疗效果有很大的影响,根除率大大降低[10]。由于地域耐药率的差异,还需要局部监测来为每个区域选择合适的治疗方案。在2018年4月至2019年4月期间,北京的一项研究中克拉霉素、左氧氟沙星的表型耐药率为52.3%、38.5%,基因型耐药率为50.9%、33.0%,其耐药性在基因型和表型水平上具有较强的一致性[11]。有一些在全国范围内的研究结果也显示了基因型和表型的一致性[12-13]。本研究中的一致性结果与其相符。
大量研究表明,Hp对克拉霉素的耐药机制与23S rRNA V区上的点突变有关,引起多肽转移酶环构象的局限性破坏,改变了二级结构,从而减少了克拉霉素与相应的核糖体亚基的结合,产生了耐药,主要由A2142C、A2142G、A2143G、A2143C、T2182C等几个点突变引起的,其中前3个是最常见的突变。而Hp对氟喹诺酮类药物的耐药性取决于形成gyrA基因的QRDRs在编码这些氨基酸的位置发生点突变,使其不能作用于细菌DNA旋转酶抑制DNA复制过程,最常见的突变发生在gyrA基因的第87位和第91位密码子。因此,如果能检测这些突变点就可以基本了解耐药基因型[14],进而推测其耐药表型指导临床用药。近年来,针对这一设想,有研究者采用更简单、更易普及临床的荧光定量PCR法检测相关的耐药基因,或者用等温扩增技术来降低检测门槛,更有用新型材料在保证特异性和敏感性的基础上来简化优化实验条件[15-17]。这都需要在全国范围内进行多中心的数据支持验证。
综上所述,现阶段 Hp对左氧氟沙星、克拉霉素的耐药率较高,且耐药相关基因型与表型的一致性也都较好,所以在培养条件不够、培养失败或者要求时效性的情况下,临床医生可以考虑用耐药相关基因型来预测表型,以制定Hp个体化根除的方案,增加治疗的有效性。
