乌司他丁联合右美托咪定对肝脏缺血再灌注损伤起保护作用:基于80例肝癌合并肝硬化行腹腔镜肝切除术患者
2022-02-03殷凤伟张方圆
欧 毅,刘 刚,殷凤伟,杨 杨,张方圆
蚌埠医学院第一附属医院麻醉科,安徽 蚌埠 233030
目前,肝癌是最常见的恶性肿瘤之一,在全球肿瘤死亡病例数中高居第3位[1]。腹腔镜肝切除术(LH)较开放性肝切除具有降低血液损失和术后并发症,以及较短的住院时间等优势,已广泛应用于肝癌的治疗[2]。而肝癌最常发生于肝硬化,术中出血风险极大,且腹腔镜技术对术野要求较高,常需实施肝脏血流阻断以获得更少的出血量和更清晰的操作术野,但容易加重肝脏缺血再灌注损伤(IRI)[3-6]。研究表明,手术创伤应激、术中出血、低灌注和肝脏血流阻断技术的实施等均可导致肝脏微循环障碍与IRI[7]。IRI是肝脏手术最危险的并发症之一,引起严重的氧化应激及炎症反应,进而加重肝损伤,甚至可能导致肝功能衰竭,严重影响患者预后[8]。因此,如何降低肝脏手术IRI与保护脏器功能,进而加速患者术后恢复和改善预后已成为研究重点[9]。
氧化应激的发生和促炎因子的释放可能与肝脏IRI有关,如过度活性氧产生破坏细胞氧化还原状态与Kupffer细胞和其他产生促进炎症细胞浸润到肝脏的炎症细胞因子,均可导致肝细胞死亡[8]。乌司他丁(UTI)是广谱丝氨酸蛋白酶抑制剂的一种,可通过降低自由基水平而具有抗氧化功能,改善微循环,减少炎症和缺血状态下组织器官的损伤,从而提高组织器官对缺血、缺氧的耐受性[10]。右美托咪定(DEX)是肾上腺激素受体激动剂的一种,可降低血液内的神经兴奋递质表达水平,从而降低组织缺血、缺氧性损伤,且能有效降低患者手术应激和炎症反应[11]。先前的研究证实,UTI与DEX可以通过减轻外科手术中氧化应激和炎症反应,对肝脏IRI具有一定保护作用[11,12]。但目前临床上对两种药物联合应用对肝脏IRI能否进一步发挥保护作用尚缺乏相关研究。因此,本研究旨在通过观察探讨UTI 联合DEX对肝癌合并肝硬化患者早期肝损伤、氧化应激和炎症因子指标以及术后肝肾功能、肝功能不全和并发症发生率及术后住院时间的影响,为肝脏IRI保护提供新的预防性治疗策略。
1 资料和方法
1.1 研究对象
选择2021年6月~2022年3月本院择期行LH的80例肝癌合并肝硬化患者作为研究对象。本研究是一项在蚌埠医学院第一附属医院进行的前瞻性、外科医生和患者盲法、平行组随机对照试验。当地医学伦理委员会提供了伦理审批(编号:2021KY068)。所有参与者在参与之前都被告知并给予书面同意。
纳入标准:患者年龄30~65岁;体质量指数(BMI)18.5~28 kg/m2;美国麻醉学家协会(ASA)身体状况评分为Ⅱ或Ⅲ级;肝癌合并肝硬化诊断依据为动态CT或MRI 和甲胎蛋白(AFP)水平升高(>400 ng/mL),且术后活组织检查确认肝细胞性癌合并肝硬化诊断,并能接受LH治疗的患者;有左或右肝损害;切除范围应≥1个肝段(非左外叶);Child~Pugh评分A或B级。
排除标准:已知对研究中使用的任何药物过敏;恶性肿瘤患者的肝外转移;有凝血功能障碍、严重心脏病(包括活动性冠心病、严重瓣膜狭窄和肥厚性梗阻性心肌病等)、肺高压、肾功能不全或脑梗病史等。肝切除合并胆囊切除不是排除标准。记录4组患者一般资料,且比较各组间差异性。
1.2 围术期处理与手术
所有患者均接受标准化气管插管全身麻醉。全麻诱导采用咪达唑仑0.05 mg/kg、依托咪酯0.3 mg/kg、舒芬太尼0.5 μg/kg、顺式阿曲库铵0.15 mg/kg。术中监测包括无创动脉压、心电图、有创动脉压、中心静脉压(CVP)、动脉血氧饱和度、呼气末二氧化碳和脑电双频指数(BIS)监测。麻醉维持时吸入1%~2%七氟醚,丙泊酚以2~4 mg/(kg·h),瑞芬太尼以0.1~0.3 μg/(kg·min)的速率持续输注,BIS维持在40~60,间断静推顺式阿曲库铵0.1 mg/kg维持肌松。所有患者实施控制性低中心静脉压(CLCVP)技术,通过调整体位、限制液体量及药物应用等,患者体位取反向仰卧体位15°,在肝切除完成前严格限制输入的液体量[1~2 mL/(kg·h)],并适当应用硝酸甘油与艾司洛尔控制CVP<5 cmH2O及合适的心率。在肝切除止血后停止使用硝酸甘油与艾司洛尔,且术中出血量用琥珀酸明胶按1∶1比例代替,提高CVP至5 cmH2O以上。当血气分析检测血红蛋白(Hb)<70 g/L者,进行输血。术中平均动脉压(MAP)维持在60 mmHg以上。当MAP<60 mmHg持续5 min及以上时开始静脉注射去甲肾上腺素,MAP>90 mmHg时停止静脉注射去甲肾上腺素。手术操作采取五孔法在气腹压力为12~14 mmHg下进行,常规进行间歇性全入肝血流阻断,阻断入肝血流10~15 min后松解5 min,可重复操作,总阻断时间不超过1 h。所有患者术后均实施静脉自控镇痛。此外,所有患者术后使用保肝降酶药物异甘草酸镁注射液0.2 g加入10%葡萄糖溶液250 mL中静脉滴注,1次/d。
1.3 分组及干预措施
研究对象随机分为U、D、UD和C 4组,每组20例。U组:乌司他丁(1.0×104U/kg加入0.9%氯化钠稀释至50 mL)于切肝开始时经颈内静脉以50 mL/h输注速度泵入;D组:右美托咪定(200 μg加入0.9%氯化钠稀释至50 mL)于麻醉诱导前经颈内静脉给予负荷量0.5 μg/kg,持续10 min,然后以0.5 μg/(kg·h)输注速度维持至术毕前30 min;UD组:以U组与D组的方法,予以乌司他丁联合右美托咪定处理;C组予以等容量0.9%氯化钠泵入。
1.4 观察指标
1.4.1 记录4组患者的手术指标(切除肝段数、阻断时间、失血量、输血率、手术时间和术后住院时间)。
1.4.2 于术前(T0)、术后30 min(T1)、术后24 h(T2)、术后3 d(T3)、术后5 d(T4)采集静脉血样 记录T0~T2时血清α-谷胱甘肽S-转移酶(α-GST)、丙二醛(MDA)、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)浓度与T0和T2~T4时血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、尿素氮(BUN)和肌酐(Cr)浓度。
1.4.3 记录4组患者术后肝功能不全和并发症发生率肝功能不全的诊断依据国际肝外科研究小组(ISGLS)定义按严重程度分为A、B和C级[13]。肝功能不全被定义为术后第5 d或之后国际标准化比率的增加和伴随的高胆红素血症(根据当地实验室的正常界限);A级不需要改变患者的临床管理;B级的临床处理偏离了常规疗程,但不需要侵入性治疗;需要侵入性治疗定义为C级。术后并发症根据Clavien-Dindo分级[14]:Ⅰ级包括切口感染、肺部感染(无抗生素治疗);Ⅱ级包括胸腔积液(未穿刺引流)、肺部感染(抗生素治疗),Ⅲ级包括胸腔积液(穿刺引流)、腹腔脓肿、胆瘘;Ⅳ级包括腹腔出血、肝衰竭、多器官功能不全;Ⅴ级为死亡。
1.5 统计分析
计量资料以均数±标准差表示;计数资料以n(%)表示。正态分布数据分析采用单因素方差分析(ANOVA),然后进行SNK事后检验,组内不同时间点比较采用重复测量方差分析;而计数资料数据分析采用χ2或Fisher精确检验;以P<0.05为差异有统计学意义。SPSS计算机软件(版本25.0,IBM)执行统计分析。
2 结果
2.1 4组患者的一般资料比较
4组患者性别、年龄、BMI、ASA分级、Child~Pugh分级、肿瘤位置及肿瘤最大直径组间比较差异无统计学意义(P>0.05,表1)。
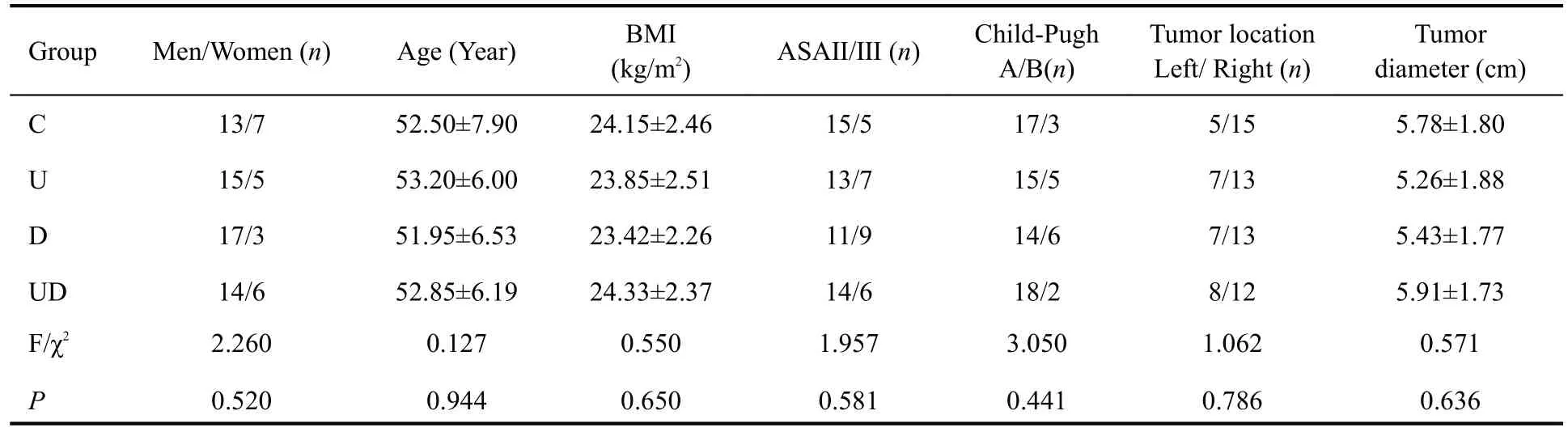
表1 4组患者的一般资料比较Table 1 Comparison of the demographic and general clinical data of the patients among the 4 groups
2.2 4组患者的相关手术指标比较
4组患者切除肝段数、阻断时间、失血量、输血率和手术时间组间比较差异无统计学意义(均P>0.05)。与C组比较,UD组术后住院时间明显缩短(P<0.05),而U组和D组术后住院时间差异无统计学意义(P>0.05,表2)。
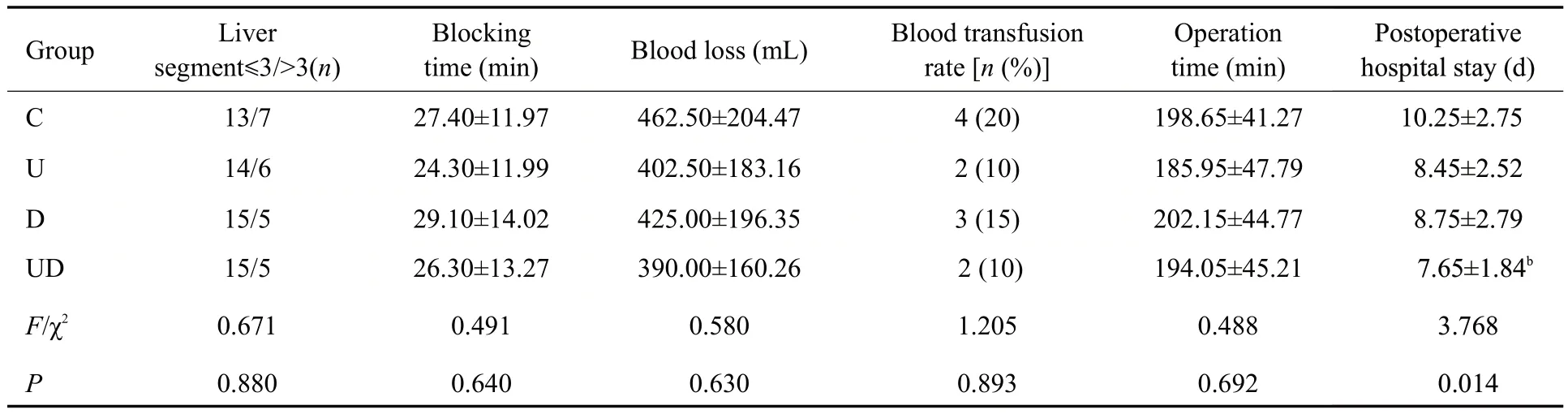
表2 4组患者的相关手术指标比较Table 2 Comparison of perioperative data of the patients in the 4 groups
2.3 4组患者α-GST、MDA、TNF-α和IL-6浓度比较
T0时,4组患者α-GST、MDA、TNF-α和IL-6浓度差异无统计学意义(P>0.05)。与T0时比较,T1时4组α-GST、MDA、TNF-α和IL-6浓度明显升高(P<0.05)。T1时,U组、D组和UD组α-GST、MDA、TNF-α和IL-6浓度明显低于C组(P<0.05)。T1时,U 组和D 组α-GST、MDA、TNF-α和IL-6浓度明显高于UD组(P<0.05)。T2时,U组、D组和UD组MDA、TNF-α和IL-6浓度明显低于C组(P<0.05),U组和D组MDA、TNF-α和IL-6浓度明显高于UD组(P<0.05),而4组患者α-GST浓度差异无统计学意义(P>0.05,表3)。
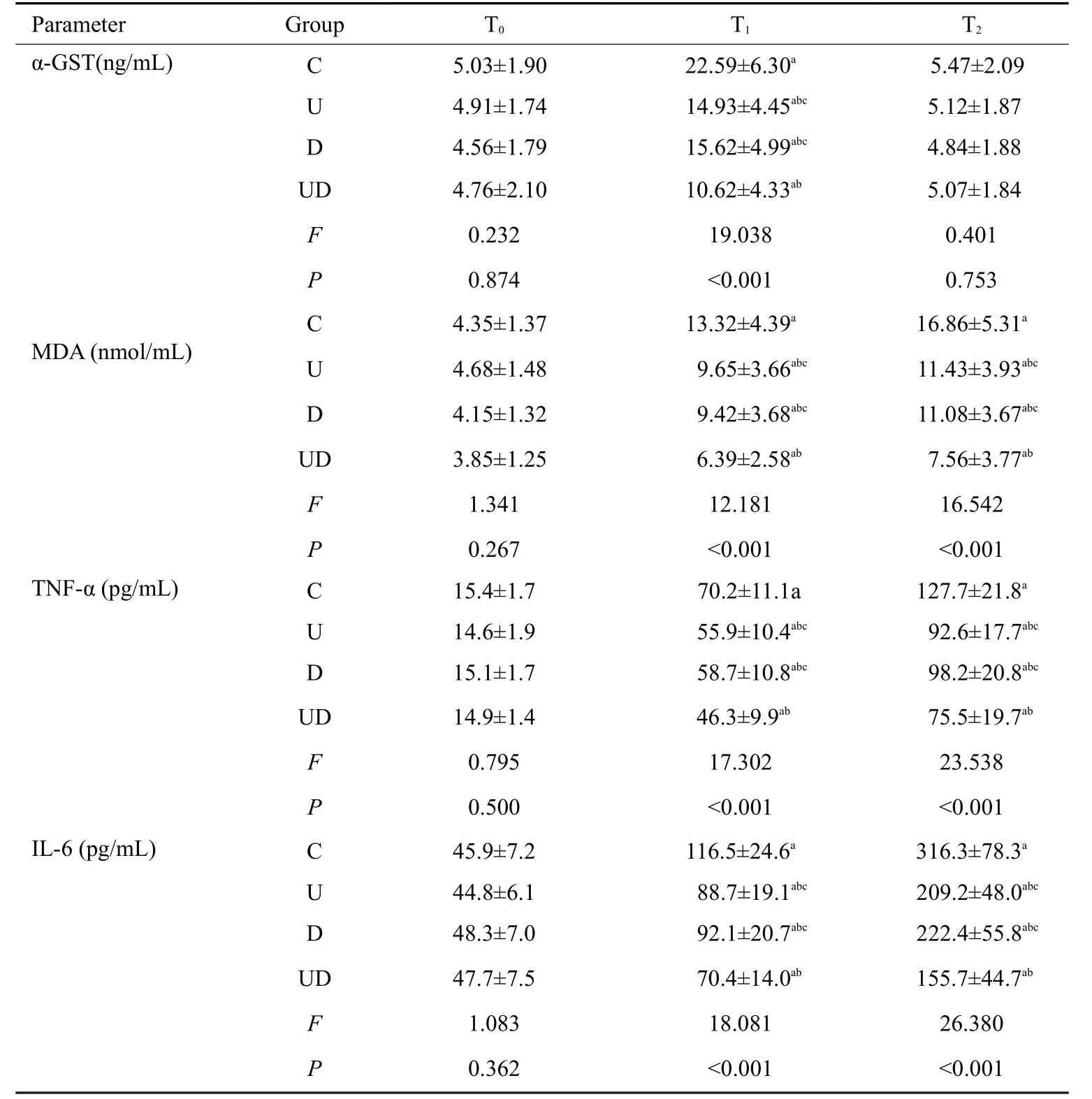
表3 4组患者α-GST、MDA、TNF-α和IL-6浓度比较Tab.3 Comparison of serum levels of α-GST,MDA,TNF-α and IL-6 in the 4 groups at different time points(Mean±SD)
2.4 4组患者的ALT,AST,Cr 和BUN浓度比较
T0时4组患者ALT、AST、Cr和BUN浓度差异无统计学意义(P>0.05)。与T0时比较,T2~T4时4组ALT和AST浓度明显升高(P<0.05)。T2~T4时U组、D组和UD组ALT和AST浓度明显低于C组(P<0.05)。T2~T4时U组和D组ALT和AST浓度明显高于UD组(P<0.05)。与T0时比较,T2~T4时4组Cr和BUN浓度差异无统计学意义(P>0.05,表4)。
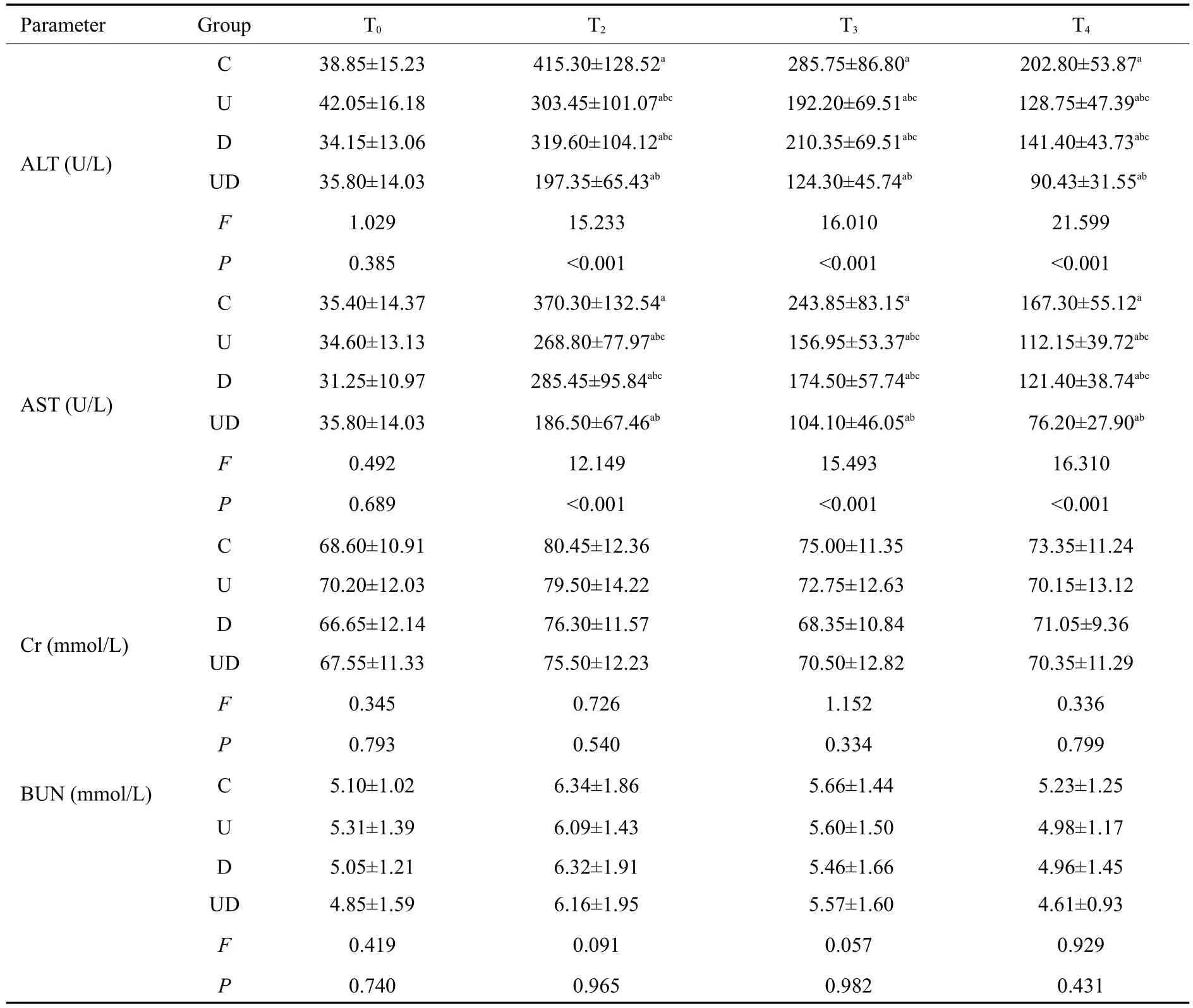
表4 4组患者的ALT,AST,Cr 和BUN浓度比较Table 4 Comparison of serumALT,AST,Cr and BUN levels in the 4 groups at different time points(Mean±SD)
2.5 4组患者的肝功能不全和并发症发生率比较
4组患者肝功能不全和并发症发生率差异无统计学意义(P>0.05,表5、6)。
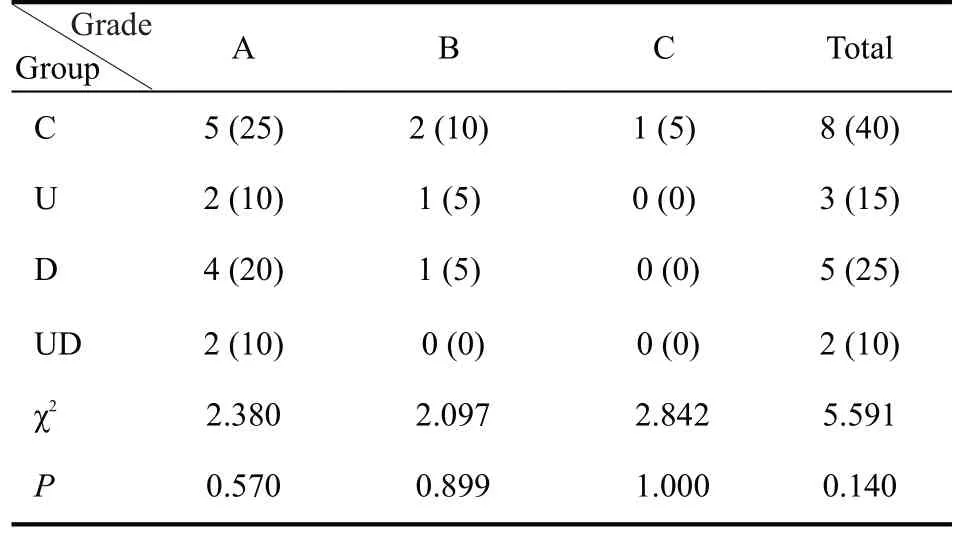
表5 4组患者的肝功能不全发生率比较Table 5 Comparison of the incidence of liver insufficiency among the 4 groups[n(%)]
3 讨论
本研究乌司他丁的用法参考文献[12],采取切肝开始时予以乌司他丁1.0×104U/kg。右美托咪定在临床前和临床研究中已被证明可以减轻IRI,且对肝脏IRI具有一定保护作用[11,15-17]。研究发现,右美托咪定能通过调节MALAT1/miR-126-5P/HMGB1轴来保护肝切除术后IRI 的肝细胞,显著降低IRI 诱导的MDA 水平[16]。Zhang等[18]研究显示,右美托咪定能显著降低早期肝损伤指标α-GST水平,且能减轻炎症反应,降低TNF-α和IL-6水平,对肝脏IRI具有一定保护作用。因此,本研究右美托咪定的用法与之相同,即负荷剂量以0.5 μg/kg输注10 min后改为维持剂量0.5 μg/(kg·h)。宋春雨等[19]通过动物实验发现右美托咪定联合乌司他丁可以进一步保护肝损伤,其机制可能是通过抑制TLR4/NF-kB炎症信号通路实现,且两者具有协同作用。然而,临床上两者联合应用对肝脏IRI保护的研究尚缺乏。因此,本研究通过观察及探讨乌司他丁联合右美托咪定对肝癌合并肝硬化患者能否具有更好的肝脏IRI保护作用。
肝脏IRI包括缺血性肝损伤和随后的再灌注损伤,这是一个发生在肝切除和肝移植过程中的两个阶段的病理生理过程[20]。而在LH中,由于间歇性Pringle动作及气腹的充气和放气等原因可能导致肝脏IRI,但一般肝脏缺血时间较短,再灌注损伤不如肝移植等手术明显,术后损伤以缺血性肝损伤为主,根据缺血的持续时间可能发生不同程度的肝脏IRI[21]。既往有研究支持α-GST是缺血性肝损伤的敏感标志物,当出现肝脏血流阻断时,可用于早期发现肝脏IRI[22]。α-GST是一种肝脏特异性胞浆酶,在所有肝细胞中均匀分布,体积小(约50 kDa),半衰期很短(约60 min),可迅速恢复到正常范围,便于早期发现肝损伤,在检测肝细胞完整性方面具有显著的临床优势,已被多项研究用作肝脏IRI早期敏感而特异的标志物[18,22,23]。因此,本研究将α-GST作为检测早期肝脏IRI特异与敏感的生物标志物,主要反映缺血性肝损伤。既往有研究发现,α-GST在肝切除术后30 min显著升高,但术后24 h基本恢复到正常范围[18]。本研究对行LH的肝癌合并肝硬化患者监测术前、术后30 min与术后24 h三个时间点的α-GST浓度。考虑此类患者术中出血风险较大,为了减少术中出血及提供良好的操作术野,研究中采用间歇性Pringle 动作联合CLCVP技术。研究发现,4组患者α-GST浓度在术后30 min均出现显著升高,表明肝癌合并肝硬化患者在LH后30 min存在不同程度的缺血性肝损伤,一方面,Pringle动作可能导致不同程度肝组织缺血[24];另一方面,术中失血结合CLCVP技术和限制性液体治疗可能导致血流动力学不稳定及组织灌注不足,进一步加重缺血性肝损伤[3,25]。而与C组比较,U、D和UD组均能显著降低α-GST浓度,且UD组较U和D组效果更显著。本研究结果提示,乌司他丁也能降低缺血性肝损伤指标α-GST浓度,且联合右美托咪定应用效果更加显著。而4组患者α-GST浓度术后24 h迅速恢复正常,且差异无统计学意义,这可能与α-GST浓度的正常范围值较小有关。

表6 4组患者的并发症发生率比较Table 6 Comparison of incidences of complications among the 4 groups[n(%)]
肝脏IRI分为早期和晚期两个肝损伤阶段[26]。早期肝损伤发生肝脏IRI后2 h内,氧化应激和(或)Kupffer坏死和凋亡诱导的细胞因子,直接导致肝细胞损伤[18]。氧化应激可以通过MDA浓度来评估,MDA是自由基产生引起的脂质过氧化的一个指标[23]。晚期肝损伤发生在24 h内,促炎症细胞因子的释放,如TNF-α、IL-6等可诱导中性粒细胞,引起多种组织的全身性炎症损伤[27]。本研究也监测了术前、术后30 min和术后24 h氧化应激与炎症因子指标MDA、TNF-α和IL-6浓度。本研究发现,4组患者氧化应激及炎症因子指标MDA、TNF-α和IL-6浓度在术后30 min与术后24 h均出现了明显升高,且术后24 h更为显著。与C组比较,U、D和UD组均能显著降低MDA、TNF-α和IL-6浓度,且UD组较U和D组效果更显著。因此,本研究结果提示,肝癌合并肝硬化患者在LH后肝脏IRI早期和晚期均存在明显氧化应激及炎症反应,且晚期更为显著,而乌司他丁与右美托咪定干预后均能明显抑制氧化应激及炎症反应,且两者联合效果更显著。可能乌司他丁能阻断炎症中的信号传导途径,降低促炎因子,且能抑制氧化应激反应,与右美托咪定具有一定的协同作用[19,28-30]。
ALT和AST常被用作传统检测肝脏IRI与肝功能障碍的标志物[11,12]。但ALT(约48 h)和AST(约20 h)半衰期明显长于α-GST,因它们分布在门脉周围区域,限制了在肝脏IRI期间的释放和早期检测,通常在肝切除术后24 h出现明显升高,且术后3 d、5 d开始恢复[18]。因此,本研究对术后肝功能的恢复进行了监测,同时监测了术后肾功能。本研究结果发现,ALT和AST浓度在术后24 h出现显著升高,之后开始呈现下降趋势。本研究提示,肝脏IRI早期测得的α-GST的值对预测术后肝功能ALT和AST也是有一定作用的。既往研究表明,乌司他丁与右美托咪定能明显降低肝切除术后的ALT和AST浓度[11,12]。本研究发现,与C组比较,U、D和UD组均能显著降低肝癌合并肝硬化患者术后24 h、3 d和5 d 的ALT和AST浓度,且UD组较U和D组效果更显著。因此,本研究结果提示,在LH中,乌司他丁与右美托咪定均能明显改善术后肝功能,且联合应用效果更显著,可能通过协同抑制氧化应激与炎症反应。此外,本研究还发现UD组较C组术后住院时间明显缩短。因此,本研究结果说明在LH中,乌司他丁联合右美托咪定干预可能加快肝癌合并肝硬化患者的术后恢复,缩短患者住院时间。4组患者大部分手术均安全完成,术后肝功能不全、并发症发生率和肾功能差异无统计学意义,可能还需要更大的样本量及更多的临床试验和指标在进一步的研究中评估与证明这种明显作用。
综上所述,α-GST可以用来评估早期肝脏IRI,且对预测术后肝功能有一定作用。在LH中,乌司他丁与右美托咪定对肝癌合并肝硬化患者的肝脏IRI具有一定保护作用,且联合应用效果更显著。其机制可能与协同抑制氧化应激与炎症反应有关,进而加速患者术后肝功能恢复,缩短患者住院时间。
