丹参酮IIA 通过抑制RIP3/FUNDC1 信号通路减轻LPS 诱导的小鼠肾小管上皮细胞凋亡
2022-02-03苏保林王亮亮汤水福陈刚毅
张 舒,苏保林,王亮亮,汤水福,陈刚毅
广州中医药大学第一附属医院肾病科,广东 广州 510405
脓毒血症是危重患者发生AKI的主要病因之一,尽管目前诊疗水平不断提高,但脓毒血症AKI在危重患者中的患病率及死亡率仍较高[1]。因此积极探索脓毒血症AKI的发病机制,对寻找有效的诊治方案具有重要的临床意义。
肾小管上皮细胞(RTECs)损伤是AKI发病的重要原因[2,3],内毒素通过受体相互作用蛋白激酶(RIP)3导致RTECs死亡是AKI的重要机制。一方面,RIP3可介导RTEC发生凋亡性坏死[4-6];另一方面,它可以通过介导FUN14结构域蛋白1(FUNDC 1)诱导细胞凋亡[7]。FUNDC1是一种线粒体受体蛋白,参与线粒体自噬、细胞凋亡及线粒体Ca2+稳态的调控,近年来研究发现FUNDC1在肾脏疾病中发挥重要作用[7-9]。然而RIP3/FUNDC1信号通路在脓毒血症AKI中的作用,目前尚无报道。
丹参作为临床常用中药,具有活血祛瘀、通经止痛、清心除烦等功效,丹参酮IIA是从丹参中提取的脂溶性化合物,具有广泛的生理活性,包括抗氧化、抗凋亡、抗炎等[10,11]。近年来研究表明,丹参酮IIA对脂多糖所致的AKI动物具有防治作用[12,13],但其机制尚不清楚。
本研究分别建立LPS诱导的脓毒血症AKI小鼠模型以及LPS刺激的HK-2细胞凋亡细胞模型,观察丹参酮IIA 对脓毒血症AKI 的保护作用以及其对RIP3/FUNDC1通路的影响。
1 材料和方法
1.1 材料
1.1.1 药物与试剂 丹参酮IIA,分子式C19H18O3,相对分子质量:294.34(成都植标化纯生物技术有限公司),用DSMO 配制为1g/L 的原液,用时根据需要应用培养基进行稀释。DMEM/F12培养基(CORNING)、二甲基亚砜(DMSO)(Sigma)、脂多糖(L-2880)(Sigma)、RIP3 siRNA(广州锐博生物有限公司)、胎牛血清(FBS)(Hyclone)、Anti-RIP3(Cat No.17563-1-AP)(Proteintech)、Anti-cleaved-caspase3 抗 体(ab2302)(Abcam)、Anti-p-FUNDC 1(Tyr18)(Abgent)、TUNEL试剂盒(瑞士罗氏公司)、Scr、BUN试剂盒(美国博世生物技术有限公司)、糖原PAS染色试剂盒(Solarbio Life Sciences)。
1.1.2 细胞 人源性肾小管上皮细胞株HK-2细胞(广州永诺生物科技有限公司)。
1.1.3 仪器 超净工作台(Thermo Fisher);CO2培养箱(Thermo Fisher);电泳仪(Bio-Rad);垂直电泳槽和Trans-Blot转印槽(Bio-Rad);研究级正置荧光显微镜Eclipse Ni-E(Nikon)。
1.2 实验方法
1.2.1 动物建模 动物实验通过广州永诺生物动物中心伦理审查(编号IACUC-AEWC-F2109012)。30只雄性C57BL/6小鼠饲养于广州永诺生物科技有限公司,10只/组,饲养于SPF级的动物房,小鼠自由进水及进食。造模前全部小鼠均禁食12 h,造模条件如下:对照组予以腹腔注射与LPS等体积的生理盐水;LPS组小鼠腹腔注射10 mg/kg LPS,刺激24 h;LPS+丹参酮IIA 组预先腹腔注射10 mg/kg 丹参酮IIA 处理15 min 再给予10 mg/kg LPS作用24 h。
1.2.2 细胞培养 HK-2细胞置于有10%胎牛血清的培养基(DMEM/F12)、5%CO237 ℃条件下进行培养,每1~2 d换液,细胞生长至密度约90%时即可传代。实验分为5组:空白对照组、LPS组(LPS 10 μg/mL,24 h)、LPS+丹参酮IIA 组(丹参酮IIA 10 mg/L 预处理1 h后,再给予LPS 10 μg/mL 刺激24 h)、LPS+siNC 组(LPS 10 μg/mL+50 nmol/L siNC)、LPS+siRIP3组(LPS 10 μg/mL+50 nmol/L siRIP3)。
1.2.3 TUNEL染色 将约1×104细胞接种于无菌盖玻片上,培养24~48 h,进行相应刺激后,PBS清洗细胞1次,4%多聚甲醛固定细胞30 min,用0.1%Triton X-100透化2 min。按说明书配置TUNEL检测液,将TUNEL检测液滴加至各待检测样本中,37 ℃避光孵育60 min。PBS清洗3次后,荧光显微镜下观察。
1.2.4 siRNA干扰 去除细胞培养基,PBS清洗细胞,加入适量无血清DMEM/F12 培养基。将已混匀的siRNA-Lipo2000混合液培养基中,使含有siRNA的混合液均匀分布于细胞表面,并将培养皿放入5%CO237 ℃培养箱中。6~8 h后观察细胞转染情况及细胞状态,细胞表面出现透亮的圆孔,提示转染成功,即可更换10%FBS完全培养基。
1.2.5 Western blot检测 去除细胞培养基,PBS清洗细胞后,加入细胞裂解液充分裂解细胞,收集上清液,离心后取上清液,根据BCA法检测蛋白浓度,各组样本根据相同质量配齐蛋白,加入Loading buffer后煮沸后加样,进行SDS-PAGE电泳实验。应用湿转法将蛋白转移至PVDF膜上,脱脂奶粉封闭,一抗孵育过夜,二抗孵育后显影。
1.3 统计学处理
采用SPSS 20.0 统计软件进行统计分析。所有数据进行正态性检验及方差齐性检验,符合正态分布的计量资料,采用均数±标准差表示,多组比较采用单因素方差分析,各组间的两两比较采用Bonferroni多重比较法。当P<0.05认为差异有统计学意义。所有实验均独立重复3次。
2 结果
2.1 丹参酮IIA改善小鼠脓毒血症肾损伤
应用LPS刺激小鼠建立脓毒血症AKI小鼠模型,LPS 刺激小鼠24 h 后,Scr 及BUN 明显高于对照组(P<0.001,图1C),肾组织PAS染色显示,LPS组小鼠近段RTEC出现空泡变性,管腔狭窄,上皮细胞脱落,基底膜裸露,而对照组没有这些改变(图1A、B)。这些结果表明LPS刺激成功建立了脓毒血症AKI模型,损伤部位主要为近段RTEC。应用丹参酮IIA预处理后(LPS+丹参酮IIA组),小鼠Scr及BUN水平较LPS组下降(P<0.001),肾组织病理显示,和LPS组比较,近段RTEC空泡变性、上皮细胞脱落、基底膜裸露等损伤改变显著减轻。

图1 各组小鼠肾组织肾脏病理情况(PAS染色)及肾功能水平(Scr、BUN)Fig.1 Renal pathology and serum creatinine and blood urea nitrogen levels in the mice in different groups.A:Representative acid-Schiff-stained kidney sections in the three groups (PAS staining,original magnification: ×200).B:Quantification of tubular injury(10 fields for each kidney section).C:Serum creatinine and blood urea nitrogen levels in the 3 groups.*P<0.001 vs control,#P<0.001 vs LPS.
2.2 丹参酮IIA可抑制小鼠RIP3/FUNDC1信号通路及肾脏凋亡水平
应用Western blot检测肾组织中Cleaved-caspase3的表达水平,结果显示,与对照组相比,LPS组肾组织中Cleaved-caspase3表达上调,丹参酮IIA预处理后(LPS+丹参酮IIA 组),再给予LPS 刺激,小鼠肾组织中Cleaved-caspase3表达水平较LPS组明显下降(图2A、B)。
检测肾组织中RIP3及p18-FUNDC1的表达水平,结果显示LPS刺激后,肾组织中RIP3、p18-FUNDC表达上调,而LPS+丹参酮IIA组,RIP3、p18-FUNDC表达水平较LPS组下降(图2A、B)。
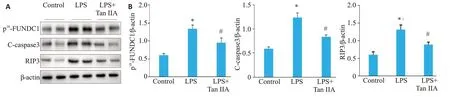
图2 各组小鼠肾组织中p18-FUNDC1、C-caspase3、RIPK3表达水平Fig.2 Expression levels of p18-FUNDC1,cleaved caspase-3 and RIP3 in the kidney of the mice detected by Western blotting.A:Western blots of p18-FUNDC1,C-caspase-3 and RIP3.B:Quantification of p18-FUNDC1,C-caspase-3 and RIP3 protein expressions.*P<0.001 vs control,#P<0.001 vs LPS.
2.3 丹参酮IIA可减轻LPS诱导的HK-2细胞凋亡水平
与对照组相比,LPS刺激HK-2细胞24 h后(LPS组),细胞凋亡水平明显增加,差异有统计学意义(P<0.05)。丹参酮IIA预处理后,LPS诱导的HK-2细胞(LPS+丹参酮IIA组)凋亡水平明显减少,差异有统计学意义(P<0.05)(图3A、B)。
通过Western blot 检测各组凋亡蛋白Cleavedcaspase3表达水平发现,与对照组相比,LPS刺激后,HK-2细胞Cleaved-caspase3表达增加,丹参酮IIA预处理后,LPS刺激下的HK-2细胞表达Cleaved-caspase3表达较LPS组下降(图4A、B)。
2.4 抑制RIP3/FUNDC1信号通路可减轻HK-2细胞凋亡水平
通过TUNEL检测发现,转染siRIP3后给予LPS刺激(LPS+siRIP3组),细胞凋亡水平明显较LPS组减少(图3A、B)。Westernblot检测各组细胞Cleaved-caspase-3的表达水平发现,LPS+siRIP3 组细胞蛋白Cleavedcaspase-3表达较LPS组明显下调(图4A、B,P<0.05)。
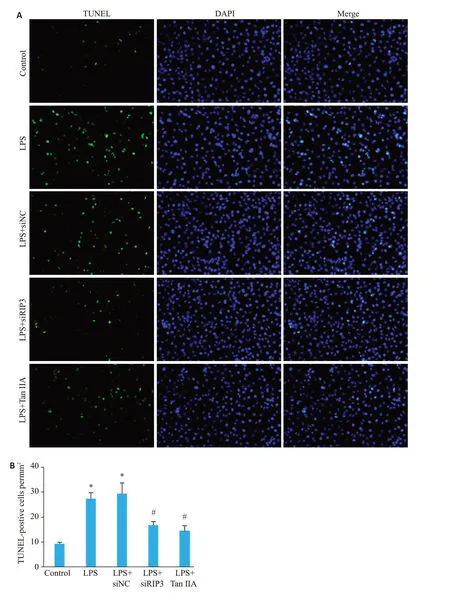
图3 LPS刺激下不同处理组细胞凋亡水平Fig.3 Apoptosis of HK-2 cells with LPS exposure in different treatment groups.A:TUNEL staining of the cells with different treatments (×200).B:Quantification of TUNEL-positive cells in each group.*P<0.05 vs control,#P<0.05 vs LPS.*P<0.001 vs control,#P<0.001 vs LPS.
通过Western blot各组细胞p18-FUNDC1表达水平发现,转染siRIP3后给予LPS刺激(LPS+siRIP3组),而p18-FUNDC1的表达水平下降(P<0.05)。
2.5 丹参酮IIA可抑制HK-2细胞RIP3/p18-FUNDC1信号通路
通过Western blot检测各组RIP3及p18-FUNDC1的表达水平发现,与对照组相比,LPS组RIP3、p18-FUNDC1表达水平增加。丹参酮IIA预处理下,LPS刺激的HK-2细胞,RIP3、p18-FUNDC1表达水平下调(图4A~C,P<0.05)。
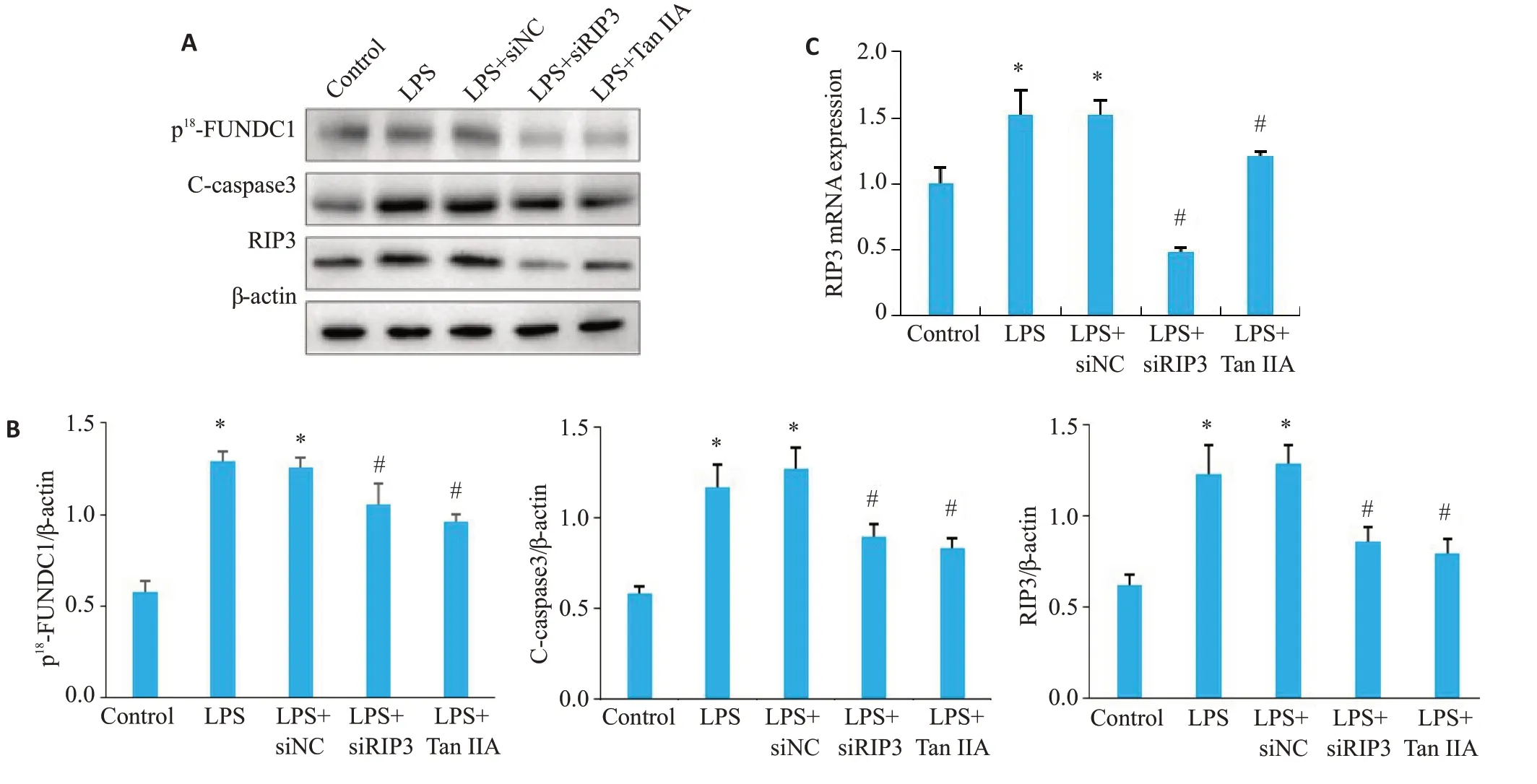
图4 LPS刺激下不同处理组细胞RIP3、c-caspase3、p18-FUNDC1表达水平Fig.4 Expression of RIP3 and cleaved caspase-3 in HK-2 cells in different groups.A:Western blot of p18-FUNDC1,C-caspase-3 and RIP3 in HK-2 cells with different treatments.B:Quantification of p18-FUNDC1,C-caspase3 and RIP3 protein expressions.C:RIP3 mRNAexpression detected using qRT-PCR in HK-2 cells following different treatments.*P<0.05 vs control,#P<0.05 vs LPS.
3 讨论
AKI是脓毒血症最常见并发症之一,脓毒血症AKI在危重患者中具有较高的死亡率,其高死亡率与其发病机制尚不完全明确有关。RTEC损伤是脓毒血症AKI主要的发病基础[14-16],研究显示,RTEC凋亡在脓毒血症AKI的发病中起重要作用[17-20]。本研究分别用LPS注射小鼠和体外刺激RTEC 构建了体内及体外脓毒血症AKI 模型。在这些模型中,丹参酮IIA 能抑制RIP3/FUNDC1信号通路,减少细胞凋亡,并改善LPS刺激小鼠的肾功能。
RIP3是受体相互作用蛋白家族成员,由N端激酶结构域及C端RIP同型相互作用基序组成,具有磷酸化酶活性,在体内广泛分布,主要表达于肾脏、心脏、脑、脾脏等部位[21-26]。RIP3是凋亡性坏死通路中的关键因子,此外RIP3还可以通过介导FUNDC1参与细胞凋亡的发生。有研究显示脓毒血症AKI患者血、尿中RIP3水平增加,进一步动物研究也发现LPS诱导脓毒血症AKI小鼠,肾组织中RIP3表达增加,并参与脓毒血症AKI中RTEC凋亡的发生,然而机制尚不明确[27]。为验证RIP3是否通过调控FUNDC1介导RTEC凋亡的发生,本研究分别在体内、体外模型中检测RIP3、FUNDC1蛋白的表达情况。
在RIP3/FUNDC1信号通路介导的细胞凋亡途径中,RIP3 通过磷酸化FUNDC1 上的Tyr18 位点,使其失活,进而FUNDC1介导的线粒体自噬被抑制,引起Caspase 依赖的细胞凋亡的发生[7]。因此在RIP3/FUNDC1 信号通路凋亡通路中,RIP3 将介导p18-FUNDC1表达上调。本研究在LPS诱导的小鼠AKI模型及LPS刺激的HK-2细胞中检测RIP3及p18-FUNDC1的表达水平发现,LPS诱导的AKI小鼠模型,肾组织中RIP3、p18-FUNDC1蛋白表达上调;LPS刺激下HK-2细胞中RIP3、p18-FUNDC1 表达同样增加,提示RIP3、FUNDC1可能参与LPS诱导的细胞凋亡损伤过程。在体外进一步沉默RIP3后,LPS介导的RTEC凋亡显著减少,p18-FUNDC1蛋白表达减少,表明RIP3/FUNDC1信号通路可能参与介导RTEC凋亡。
中药单体丹参酮IIA是中药丹参的主要成分,其分子结构及相关药理学功效都较为明确,具有抗凋亡、清除氧自由基、抗炎、抗肿瘤等作用。前期研究观察到,丹参酮IIA具有潜在的肾脏保护效应[28-30],但目前还没有关于丹参酮IIA对保护脓毒血症AKI的效应及机制研究。本研究中,我们发现丹参酮IIA可减轻LPS诱导的RTEC凋亡损伤。我们首先证实了丹参酮IIA可下调LPS诱导的AKI小鼠肾组织中凋亡蛋白Cleaved-caspase3的表达;还可减少TUNEL染色的阳性细胞数及下调HK-2细胞中蛋白Cleaved-caspase-3的表达。进一步,我们在体外模型中证实了丹参酮IIA的这一保护效应。
丹参酮IIA是通过什么机制减轻RTEC损伤?我们首次发现丹参酮IIA可下调RIP3的表达水平,并通过抑制RIP3/p18-FUNDC1 信号通路改善RTEC 凋亡水平。这为这种单体中医成分的肾保护提供了一种可能的机制假说。因此,我们提出丹参酮IIA一种新的RTEC保护途径。本研究不足之处,所选丹参酮IIA的剂量单一,对AKI的具体保护机制尚不清楚,故仍需进一步研究。综上,丹参酮IIA可通过抑制RIP3/p18-FUNDC1信号通路来保护LPS诱导的RTEC损伤。丹参酮IIA作为中药丹参的主要活性成分,其现代药理作用丰富,毒副作用小,在临床中具有较好的应用价值。
