新风胶囊含药血清抑制脂多糖诱导的类风湿关节炎大鼠的滑膜成纤维细胞焦亡
2022-02-03王露琳黄传兵张皖东
王露琳,汪 元,刘 健,黄传兵,张皖东,万 磊,孙 玥,黄 旦
1安徽中医药大学,安徽 合肥 230038;2安徽中医药大学第一附属医院风湿科,安徽 合肥 230031
类风湿关节炎(RA)是全身自身免疫性疾病,以慢性滑膜炎为主要特征,患者可出现双手小关节对称性肿胀疼痛、活动不利、关节畸形,严重者可出现关节功能丧失,并出现多系统受累表现[1,2]。滑膜炎是RA的基本病理基础,滑膜成纤维细胞(FLS)的异常增殖会分泌大量的炎性因子,新生的炎性因子又持续不断的刺激FLS异常增殖,两者之间相互促进,形成恶性循环[3]。近年来NLRP3炎症小体在RA滑膜炎症中的作用越来越受到研究者的重视,研究表明,NLRP3炎症小体能够诱导pro-IL-1β、pro-IL-18等促炎因子的成功剪切和最终释放,从而诱导细胞炎症反应。RA的发生发展过程中可能伴随着NLRP3炎性小体的活化[4],因此抑制NLRP3炎性小体的活化,可能是抑制RA-FLS细胞焦亡发生的关键环节。
本课题组前期研究发现,新风胶囊(XFC)不仅能够改善RA患者临床症状,减轻患者炎症反应[5,6],同时能明显缓解AA大鼠组织肿胀度和炎症指数,抑制过度表达的炎性因子[7,8]。有研究发现,RA关节滑膜中细胞焦亡和程序性坏死均明显增强,提示细胞焦亡可能在RA滑膜炎的发病中起着重要作用,可能成为RA的治疗潜在靶点[9],RA-FLSs的过度增殖及焦亡等在RA的破坏和持续炎症中发挥关键作用[10]。吴宁等[10]通过数据挖掘指出了与RA-FLSs焦亡相关的蛋白和细胞因子,并得出可能存在的焦亡通路,但具体机制仍不明确。本课题组前期仅研究了RA-FLSs凋亡[8],关于焦亡研究还未深入。因此,本文通过构建RA-FLS 焦亡模型,拟从NLRP3炎症小体信号通路阐明XFC对RA滑膜成纤维细胞焦亡的影响,并探讨其作用机制。
1 材料和方法
1.1 材料
1.1.1 动物和细胞 RA-FLS购自iCell(赛百慷(上海)生物技术股份有限公司)。SPF级雄性SD大鼠20只,体质量200±20 g,源于安徽省实验动物中心,许可证号:SCXK(皖)2019002,实验通过伦理委员会批准,动物伦理编号:AHUCM-rats-2019008。按照标准饲养,适应性培养7 d后进行实验。
1.1.2 药物 XFC由安徽中医药大学第一附属医院制剂中心提供(皖药制字Z20050062,批号:20200115),由黄芪、薏苡仁、蜈蚣、雷公藤组成,每粒药含生药0.4 g)。
1.1.3 试剂与仪器 脂多糖(Solarbio);NLRP3、Caspase-1、GSDMD(Affinity);Cell Counting Kit 8(Bestbio);IL-18(Human)ELISA KIT、IL-1β(Human)ELISA KIT(RUIXIN Biotech);NLRP3 抑制剂MCC950(MCE)等。酶标分析仪(Rayto,RT-6100);高速冷冻离心机(Anhui Jiawen Instrument Equipment Co.,Ltd,JW-3021HR);透射电子显微镜(HITACHI,HT7700);自动曝光仪(P&Q Science&Technology,JS-M6P);CO2培养箱(Thermo,3111)等。
1.2 方法
1.2.1 含药血清制备 SD大鼠分为2组:空白组和XFC组予采用经人大鼠体表面积比值折算成相当于人临床等效用量0.324 mg/g 灌胃(等价于临床等效剂量的20倍)[8],空白组予等量蒸馏水灌胃,连续灌胃3 d,2次/d,末次给药2 h后,取大鼠腹主动脉血,2500 r/min,离心15 min取上清,56 ℃水浴箱中孵育0.5 h,灭活除菌后分装,储存在-80 ℃冰箱里备用。
1.2.2 CCK-8法检测XFC对RA-FLS最佳干预浓度和时间 细胞中加入不同浓度的XFC 含药血清(2.5%、5.0%、10.0%、20.0%、40.0%),分别干预12、24、48、72 h后,根据CCK-8法筛选不同浓度XFC含药血清对RAFLS细胞活力的影响,筛选出XFC含药血清最佳浓度和时间。
1.2.3 分组与模型制备 将RA-FLS放于20%胎牛血清DMEM高糖培养基中,5%CO2、37 ℃培养箱中培养。实验分为空白组(RA-FLS)、模型组(RA-FLS+5 μg/mL 的LPS,培养48 h)、MCC950组(RA-FLS+LPS+MCC950)、XFC组(RA-FLS+LPS+XFC含药血清)。
1.2.4 CCK-8检测细胞活性 在96孔版中接种RA-FLS悬液(100 μL/孔),在恒温箱中培养。3个复孔/组,各组按标准进行不同处理24 h,各孔中放CCK-8溶液(10 μL),孵育2 h 37 ℃,通过酶标仪测吸光度A450nm,计算细胞活性。
1.2.5 细胞焦亡形态学检测 弃去培养液,PBS清洗后,加入2.5%戊二醛,4 ℃、固定3 h,收集细胞后,1000 r/min 10 min,离心成1.5~2 mm×2~3 mm大小的细胞团块,再使用1%的锇酸室温固定2 h。PBS漂洗后,经过乙醇、丙酮脱水。用812、丙酮包埋渗透后烤箱聚合48 h,温度60 ℃。切片60~80 nm后铀铅双染色15 min(2%醋酸铀饱和酒精溶液,枸橼酸铅),透射电镜下观察、采集图像。
1.2.6 ELISA检测IL-1β、IL-18浓度 使用IL-18(Human)ELISA KIT、IL-1β(Human)ELISA KIT(RUIXIN Biotech)试剂盒检测,操作按试剂盒说明书完成。
1.2.7 qRT-PCR 法检测NLRP3、caspase-1 和GSDMD mRNA表达 按照Trizol试剂盒说明提取细胞总RNA,以1.0 μLcDNA为模板进行扩增,依次按照95 ℃1 min;95 ℃20 s、60 ℃1 min(40个循环)。按2-ΔΔCt法进行定量分析,引物由Sangon Biotech提供(表1)。
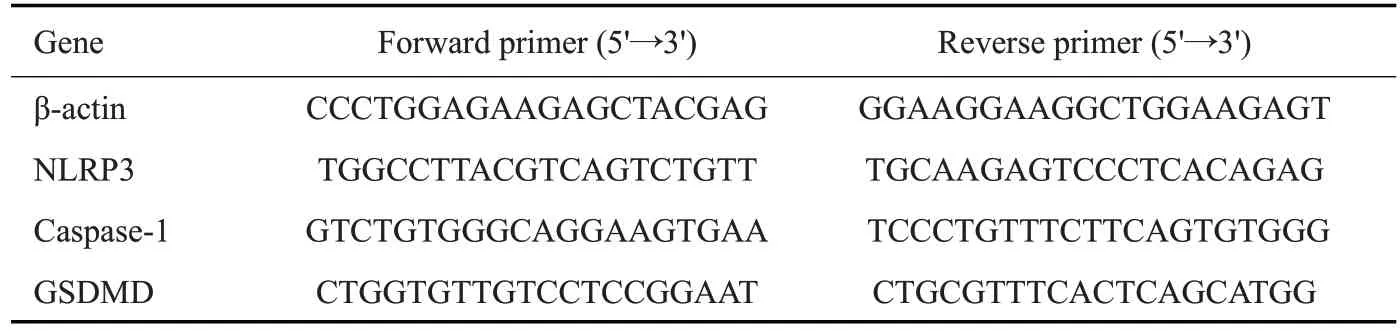
表1 引物列表Table 1 List of primers for RT-PCR
1.2.8 Western blot 检测NLRP3、caspase-1 和GSDMD蛋白表达使用Western blotting法检测蛋白,收集细胞沉淀,加入10%RIPA(含1mM PMSF),置于冰上、裂解细胞20 min,离心收集收集上清液(即细胞总蛋白)。电泳后,将被分离的蛋白转移至PVDF膜上。用5%脱脂奶粉恒温封闭2 h。放入1∶1000对应一抗,4 ℃摇动孵育过夜。PBST洗PVDF膜后,再加入稀释(1∶10 000)的二抗溶液,37 ℃孵育2 h,PBST洗3次。利用混合好的ECL溶液反应显色,并使用凝胶成像系统拍照,蛋白表达的灰度值用ImageJ软件进行,最后与内参条带内的灰度值进行比较,得到蛋白的相对表达量。
1.3 统计学分析
采用SPSS 25.0 统计学软件进行分析。各组数据以数±标准差表示,两组比较采用t检验,多组间比较采用单因素方差分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 XFC含药血清作用于RA-FLS最佳干预浓度和时间
将不同浓度2.5%、5.0%、10.0%、20.0%、40.0%XFC作用于RA-FLS:12、24、48、72 h后。细胞活力随时间及新风胶囊浓度的增加逐渐降低,当新风胶囊浓度为20%、作用时间为24 h时,细胞活力最接近50%,故选择20%、24 h为XFC含药血清作用于RA-FLS的最佳浓度和时间(图1)。
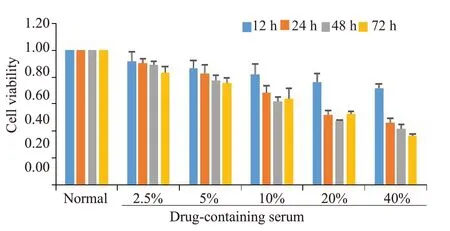
图1 RA-FLS最佳含药血清浓度和时间测定Fig.1 Determination of the optimal concentration and treatment time of the drug-containing serum for RA-FLS.
2.2 XFC含药血清对RA-FLS细胞活性的影响
与空白组相较,模型组RA-FLS细胞活力显著上升(P<0.05);与模型组相较,XFC 组和MCC950 组RAFLS细胞活力明显降低(P<0.01,图2)。
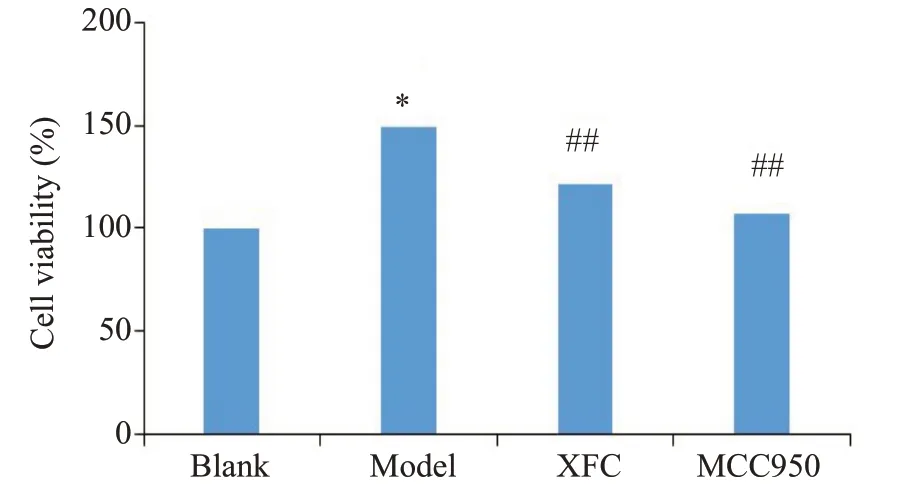
图2 各组RA-FLS细胞活性的影响Fig.2 Viability of RA-FLS in different groups.*P<0.05 vs blank group;##P<0.01 vs model group.
2.3 XFC含药血清对RA-FLS焦亡情况的影响
通过透射电镜观察焦亡情况,与空白组相较,模型组细胞膜破裂,细胞形成大量小泡(即焦亡小体),细胞内容物流出;与模型组相较,XFC组、MCC950组细胞焦亡情况较前改善(图3)。
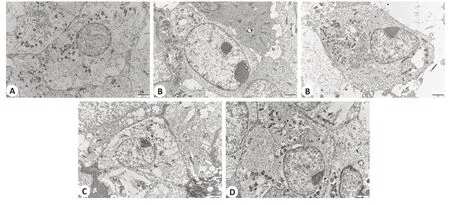
图3 各组RA-FLS细胞焦亡情况Fig.3 Pyroptosis of RA-FLS in different groups(electron microscopy,scale bar=2µm).A:Blank group.B:Model group.C:XFC group.D:MCC950 group.Cell membrane ruptures are marked with red arrows.
2.4 XFC含药血清对IL-1β和IL-18的影响
与空白组比,模型组IL-1β和IL-18浓度显著上升(P<0.01);与模型组比,XFC组和MCC950组IL-1β和IL-18浓度显著下降(P<0.05,P<0.01,图4)。
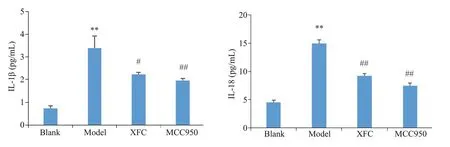
图4 各组IL-1β、IL-18的浓度Fig.4 Concentrations of IL-1β and IL-18 in each group.**P<0.01 vs blank group;#P<0.05,##P<0.01 vs model group.
2.5 XFC含药血清对焦亡相关mRNA表达的影响
qRT-PCR法检测以下指标,与空白组相较,LPS组GSDMD、caspase-1、NLRP3 mRNA表达明显上调(P<0.01);与模型组相较,MCC950组和XFC组GSDMD、caspase-1、NLRP3 mRNA表达明显下调(P<0.01,图5)。
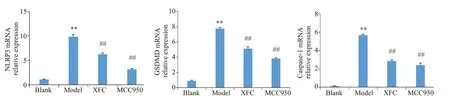
图5 各组细胞焦亡相关mRNA水平变化Fig.5 Changes of pyroptosis-related mRNAlevels in RA-FLS in each group.**P<0.01 vs blank group;##P<0.01 vs model group.
2.6 XFC含药血清对焦亡相关蛋白表达的影响
与空白组相较,LPS组GSDMD、caspase-1、NLRP3蛋白表达明显上调(P<0.01);与模型组相较,MCC950组和XFC组能抑制GSDMD、caspase-1、NLRP3蛋白表达(P<0.05,P<0.01,图6、7)。

图6 各组细胞焦亡相关蛋白表达Fig.6 Expressions of pyroptosis-related proteins in RA-FLS in each group.A: Blank group;B:Model group;C:XFC group;D:MCC950 group.
3 讨论
目前RA的病理机制尚未完全阐明,但免疫炎症反应始终贯穿RA发生发展的始终,炎症反应的长期刺激会引起关节疼痛、肿胀、变形,最终导致关节畸形、关节功能丧失等,降低患者生活质量和幸福度[11,12],是RA病情逐步进展的重要环节。细胞焦亡是一种新型炎性程序性细胞死亡方式,其焦亡过程为:细胞膜形成孔隙,细胞持续肿胀直至胞膜破裂,胞膜失去完整性,细胞内容物得以释放,从而引起炎症反应,释放炎性因子,反过来促进细胞焦亡,如此循环反复后炎症反应被无限扩大,进一步损伤机体[13-14]。本次研究通过LPS诱导RA-FLS制备滑膜炎症模型,并给予新风胶囊含药血清进行干预,发现LPS诱导的RA-FLS细胞活力上升,细胞膜破裂或趋于破裂,细胞形成大量焦亡小体,经新风胶囊含药血清干预后RA-FLS细胞活力明显下降,焦亡小体减少,与NLRP3抑制剂MCC950组结果相同。这说明LPS能诱导RA-FLS发生炎症反应,引起滑膜成纤维细胞焦亡,而新风胶囊含药血清对LPS诱导的RA-FLS有明显抑制作用,并能有效改善滑膜炎症导致的细胞焦亡。
关于细胞焦亡的上游通路,即炎性小体的激活可能参与RA的疾病进程已有报道。然而,RA中细胞焦亡的研究相对较少。NLRP3炎症小体是一类模式识别受体,可识别内源性及外源性的危险信号,介导caspase-1的成熟活化,参与IL-1β和IL-18加工、分泌,诱导细胞炎症[15]。迄今为止,关于GSDMD的研究主要集中于它对细胞焦亡的调控作用,NLRP3炎症小体介导caspase-1的成熟活化,同时切割GSDMD-N,释放其有识别功能的N端,使N端结构插入细胞膜,细胞膜形成孔隙,完整性消失,导致细胞渗透压失衡,最终胞膜被破坏,诱导细胞焦亡[16,17]。上调的NLRP3与RA细胞焦亡密切相关[18]。有研究表明,RA患者体内包括caspase-1、短长度NLRP3及全长NLRP3在内的NLRP3炎性体组分表达水平均显著升高[19]。抑制NLRP3炎性小体的激活则可显著改善胶原诱导关节炎模型小鼠的炎性反应[20]。在RA发病过程中,炎症反应起着决定性作用,而细胞焦亡会加剧炎症反应,NLRP3在细胞焦亡中扮演重要角色,其激活产生的caspase-1通过切割GSDMD-N,使胞膜被GSDMD孔通途化后,释放炎症因子,扩大炎症反应,诱导细胞焦亡,因此NLRP3/GSDMD通路介导的滑膜成纤维细胞焦亡,可能成为潜在的治疗靶点。本研究结果表明,与LPS组相比,给予NLRP3抑制剂MCC950和新风胶囊含药血清均能降低RA-FLS 细胞NLRP3、caspase-1、GSDMD的mRNA和蛋白表达,表明新风胶囊抗细胞焦亡的作用可能与抑制NLRP3炎症小体的活化及其下游炎症因子的释放相关,从而抑制滑膜成纤维细胞焦亡的发生,最终达到控制RA患者炎症反应,达到治疗RA炎症的作用。
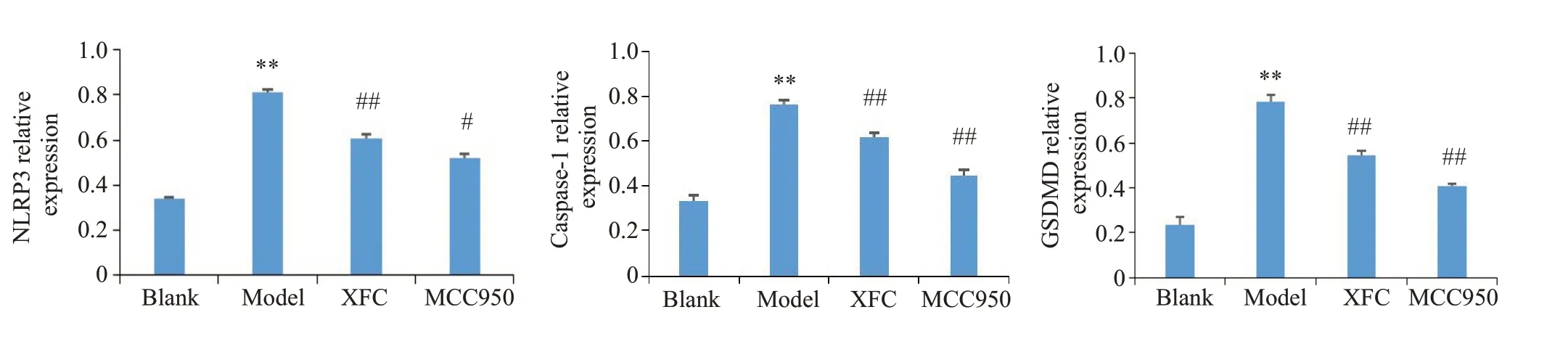
图7 各组RA-FLS相关蛋白水平变化Fig.7 Changes of pyroptosis-related proteins in each group.**P<0.01 vs blank group;#P<0.05,##P<0.01 vs model group.
RA属中医“痹证”、“鹤膝风”、“尪痹”范畴,本团队提出RA的中医基本病机在于脾虚湿盛、痰瘀痹阻,并研制新风胶囊应用于临床,疗效明确[5,6]。方中以黄芪、薏苡仁为君药,具有益气健脾化湿之功,现代药理学研究显示黄芪可以抑制IL-1β、IL-18、caspase-1的表达,降低炎症相关指标,抑制炎症反应[21,22],薏苡仁可能通过下调NLRP3、caspase-1蛋白的表达,抑制细胞焦亡,从而改善炎症反应[23],臣药雷公藤、蜈蚣通经络止痹痛,研究表明,雷公藤能抑制IL-1β、caspase-1分泌[24],蜈蚣破瘀通络止痛,降低炎症因子水平,具有改善细胞焦亡的作用[25],诸药合用,共同起到健脾化湿通络、抑制细胞焦亡作用。本研究可进一步证明XFC可以抑制RA-FLS细胞焦亡。因此,深入研究XFC治疗RA细胞焦亡的机制研究具有重大意义。
综上所述,XFC含药血清可抑制RA-FLS异常增殖,抑制其焦亡,从而下调炎症细胞因子的分泌,减轻关节局部炎症反应而发挥治疗作用,其分子机制可能与抑制NLRP3炎症小体、caspase-1、GSDMD蛋白表达,降低IL-1β、IL-18细胞因子的表达水平有关。该结果为XFC临床治疗RA提供新依据,并且表明了NLRP3炎症小体可能成为中医药治疗RA新的靶点。
