miR-34a 通过靶向抑制Notch 信号通路减轻糖尿病肾病小鼠的足细胞损伤
2022-02-03王欢岚张燕敏陈伟栋
王欢岚,刘 红,张燕敏,陈伟栋
武汉市第一医院(武汉市中西医结合医院)肾内科,湖北 武汉 430022
糖尿病肾病(DN)主要是由糖尿病所致慢性肾病,临床表现为蛋白尿、高血压以及水肿等症状[1]。DN的发病机制较为复杂,普遍认为是因高糖环境引起机体糖代谢紊乱、肾脏的血流动力学发生改变和氧化应激、炎症反应过度活化,导致系膜细胞增大肥厚、细胞外基质聚集、肾小管间质纤维化和肾小球硬化,降低肾功能[2,3]。足细胞即为肾小球上皮细胞,其微结构改变在DN蛋白尿产生过程汇中发挥重要作用[4]。微小RNAs(miRNAs)是具有调控基因转录后水平的内源性非编码单链的小分子RNA,可参与细胞增殖、凋亡、代谢、肿瘤发生以及病毒感染等病理过程[5]。研究表明miRNAs也参与DN发病过程[6,7]。有研究通过基因组学分析发现在早期DN中miR-34a的表达显著降低[8],但其对DN所致足细胞损伤的相关研究尚未有相关报道。Notch信号通路是高度保守的信号通路,参与细胞、组织、器官的发育和分化过程,同时也参与多种病理生理过程[9-11]。有研究证实,辐射照射后大鼠肾组织中miR-34a 能够靶向Notch配体表达降低[12],提示miR-34a能够靶向Notch调控肾组织的内皮细胞变化。本研究主要探究miR-34a对DN足细胞损伤和凋亡的影响,以期为DN药物研发提供参考意见。
1 材料和方法
1.1 实验材料
MPC5小鼠足细胞系(ATCC),SPF级雄性8周龄C57BL/6J小鼠。动物实验遵循3R原则,通过实验动物的福利伦理审查。
1.2 主要试剂
甘露醇(上海源叶生物科技有限公司),miR-34a mimic及其阴性对照、pcDNA3.1质粒载体和pc-Notch 1过表达质粒载体、agomir-34a和agomir-NC、miR-34a结合位点缺失突变型(Notch 1-mut)及其野生型(Notch 1-wt)的3'UTR的荧光素酶的报告载体(上海吉玛制药技术有限公司),Lipofectamine®2000(Invitrogen),荧光素酶试剂盒(中国台湾亚诺法生技股份有限公司),RNA纯化提取试剂盒和逆转录试剂盒(中国天根生化科技北京有限公司),RT-PCR试剂盒(中国北京庄盟国际生物基因科技有限公司),CCK-8(北京百奥莱博科技有限公司),兔抗鼠caspase-3、caspase-9、Bax、Bcl-2抗体(上海康朗生物科技有限公司)。
1.3 主要仪器
Vilber Fusion Fx7 凝胶成像仪(Vilber Lourmat),LightCycler®96实时定量PCR仪(中国罗氏诊断产品上海有限公司),Aurora 3L-5L 流式细胞仪(Cytek Biosciences),SpectraMax iD3 酶标仪(Molecular Devices),DFM-60D荧光显微镜(中国上海蔡康光学仪器有限公司)。
1.4 体外实验
1.4.1 细胞培养和高糖诱导 使用含有10%胎牛血清、50 U/L γ干扰素的RPMI 1640培养基将MPC5小鼠足细胞置于I 型鼠尾胶原包被的培养瓶中,培养环境为37 ℃、5%CO2培养箱,待细胞融合至90%左右,进行消化传代,然后用不含γ干扰素的完全培养基在37 ℃、5%CO2培养箱中诱导分化14 d,用于后续实验。将成熟的足细胞在无血清的完全培养基中培养24 h,分为正常糖组、高糖组和高渗透组,正常糖组给予5.3 mmol/L葡萄糖、高糖组给予30 mmol/L葡萄糖、高渗透组给予5.3 mmol/L葡萄糖+19.5 mmol/L甘露醇刺激48 h,然后收集细胞,使用RT-PCR法检测细胞中miR-34a表达水平。
1.4.2 RT-PCR检测 提取细胞总RNA并逆转录生成第一条链cDNA,然后使用RT-PCR法检测miR-34a表达水平,以U6作为内参基因,计算方法使用2-△△Ct。
1.4.3 细胞转染 成熟的足细胞在无血清的完全培养基中培养,待细胞融合度为70%~90%时,参照Lipofectamine®2000 说明书将miR-34a mimic 及其阴性对照转染足细胞,分别记为miR-34a组、miR-NC组,孵育6 h后,更换为含有血清培养基,48 h后,收集细胞,在聚焦显微镜下观察转染情况,RT-PCR验证细胞miR-34a表达水平,明确成功转染后,将pc-Notch 1过表达质粒载体及其空质粒分别转染miR-34a组和miR-NC组足细胞,分别记为miR-34a+Notch 1组、Notch 1组。
1.4.4 荧光素酶实验 采用荧光素酶报告载体来验证miR-34a和Notch 1的关系。软件预测在Notch 1 3'-UTR的190~196 是与miR-34a 结合的位点,并合成该位点的DNA片段(Notch 1 wt)以及含该位点突变体(Notch 1 mut)DNA片段,退火后克隆到双荧光素酶启动子载体pGL3,将miR-34a mimic共转染至足细胞,孵育48 h,依据试剂盒说明书操作比较各组细胞荧光素酶活力值。
1.4.5 CCK-8法检足细胞增殖情况 将转染成功的足细胞以1×105/孔接种至24孔板,均给予高糖(30 mmol/L葡萄糖)刺激,同1.4.1,分别与培养1、2、3、4、5 d时,加入10 μL CCK-8溶液,继续孵育2 h,在波长450 nm处检测光密度A450nm。每组设置6个复孔,实验重复3次。
1.4.6 流式细胞法检测足细胞凋亡情况 收集高糖刺激48 h足细胞,1000 r/min离心5 min,收集细胞沉淀,加入1×Binding Buffer 300 μL 重悬细胞,然后加入5 μL Annexin V-FITC和10 μL PI混合均匀,室温避光孵育15 min,上样流式细胞仪,检测细胞凋亡率。
1.4.7 Western blot法检测蛋白表达水平 提取高糖刺激48 h足细胞总蛋白,Bradford蛋白定量,SDS-PAGE分离,经SDS-PAGE凝胶电泳、电转膜至PVDF膜,5%脱脂奶粉密封2 h,加入兔抗鼠caspase-3、caspase-9、Bax、Bcl-2、GAPDH一抗(1∶500)4 ℃孵育过夜,TBST漂洗,加入HRP标记二抗(1∶500)孵育1 h,TBST漂洗,显色、定影,使用成像仪子代系统分析蛋白条带灰度值。
1.5 体内实验
1.5.1 糖尿病肾病模型制备 将35只C57BL/6J小鼠参考文献[13]中高脂饮食+链脲佐菌素(一次性腹腔注射100 mg/kg)DN模型制备方法进行2型DN造模,另选15只C57BL/6J小鼠给予正常饮食和腹腔注射等体积的柠檬酸缓冲液,35只小鼠造模不成功5只。动物实验遵循3R原则。
1.5.2 动物分组和干预 将制模成功的DN小鼠随机均分为模型组、miR-34a组,15只/组。miR-34a组和模型组小鼠分别尾静脉注射agomir-34a(80 mg/kg-1·d-1)[14]、agomir-NC(80 mg/kg-1·d-1),连续注射3 d。4周后,麻醉处死小鼠,快速取出肾组织,一部分肾组织固定于甲醛中性溶液,余下肾组织于-20 ℃保存备用,使用RT-PCR检测各组小鼠肾组织miR-34a表达水平。
1.5.3 肾组织HE染色和TUNEL凋亡检测 将已固定肾组织进行常规石蜡包埋、切片,所得切片用于HE染色观察肾组织病理结果变化和TUNEL检测肾组织凋亡情况,详细操作见文献[15]。
1.5.4 肾组织凋亡、Notch信号通路相关蛋白表达水平检测 提取肾组织中总蛋白水平,参照1.4.7中操作方法检测肾组织中caspase-3、caspase-9、Notch 1蛋白水平。
1.6 统计学分析
运用SPSS 22.0软件统计分析数据,定量资料以均数±标准差表示,满足正态分布且方差齐的数据,两组比较采用t检验,多组间比较用单因素方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 高糖环境对足细胞miR-34a表达水平的影响
在高糖环境诱导下足细胞中miR-34a表达水平低于正常糖诱导下足细胞和高渗透压下作用下的足细胞(P<0.05,图1)。
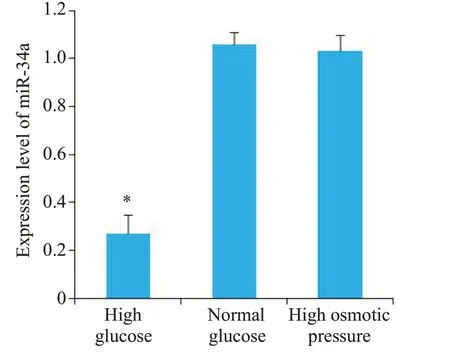
图1 miR-34a表达水平Fig.1 Expression level of miR-34a in the podocytes with different treatments.*P<0.05 vs normal glucose group.
2.2 转染足细胞系验证及miR-34a与Notch1靶向关系验证
miR-34a细胞转染效率为86.75%,Notch 1细胞转染率效为81.69%,miR-34a组足细胞中的miR-34a表达水平高于miR-NC组(P<0.05),双色荧光素酶实验结果显示Notch 1 wt/miR-34a 组荧光素酶活力值低于Notch 1 wt组(P<0.05),而Notch 1 mut/miR-34a组荧光素酶活力值和Notch 1 mut/miR-NC组差异无统计意义(P>0.05)。miR-34a组足细胞中Notch 1表达水平低于miR-NC组(P<0.05);Notch 1组足细胞中Notch 1表达水平高于其空质粒组(P<0.05,图2)。
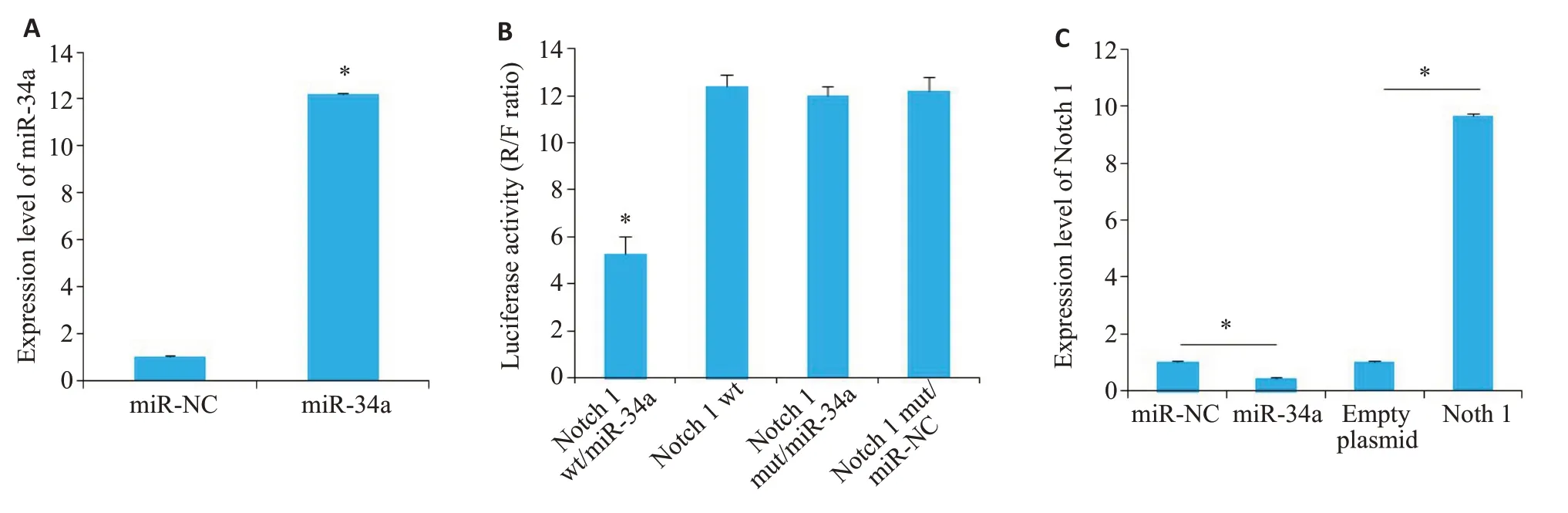
图2 转染足细胞系验证及miR-34a与Notch 1靶向关系验证Fig.2 Verification of mRNA-target relationship between miR-34a and Notch 1 in transfected podocytes.A:Expression level of miR-34a in transfected podocytes (*P<0.05 vs miR-NC group).B: Luciferase activity in the podocytes (*P<0.05 vs Notch 1 wt group).C:Expression level of Notch 1 in the transfected podocytes(*P<0.05).
2.3 各组足细胞在高糖情况下存活情况比较
高糖组足细胞的A 值与miR-NC 组差异无统计意义(P>0.05),miR-34a组足细胞的A值高于miR-NC组(P<0.05),Notch 1组足细胞的A值低于miR-NC组(P<0.05),miR-34a+Notch 1 组足细胞的A 值低于miR-34a组(P<0.05,图3)。
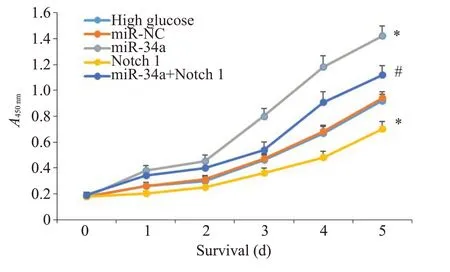
图3 各组足细胞在高糖情况下细胞存活曲线Fig.3 Survival curves of the podocytes with different treatments.*P<0.05 vs miR-NC group;#P<0.05 vs miR-34a group.
2.4 各组足细胞凋亡情况比较
高糖组足细胞细胞凋亡率和caspase-3、caspase-9、Bax/Bcl-2 蛋白水平与miR-NC 组差异无统计意义(P>0.05),miR-34a 组足细胞凋亡率和caspase-3、caspase-9、Bax/Bcl-2 蛋白水平均低于miR-NC 组(P<0.05),Notch 1组足细胞凋亡率和Caspase-3、Caspase-9、Bax/Bcl-2 蛋白水平均高于miR-NC 组(P<0.05),miR-34a+Notch 1 组足细胞凋亡率和caspase-3、caspase-9、Bax/Bcl-2 蛋白水平均高于miR-34a 组(P<0.05,图4、5)。
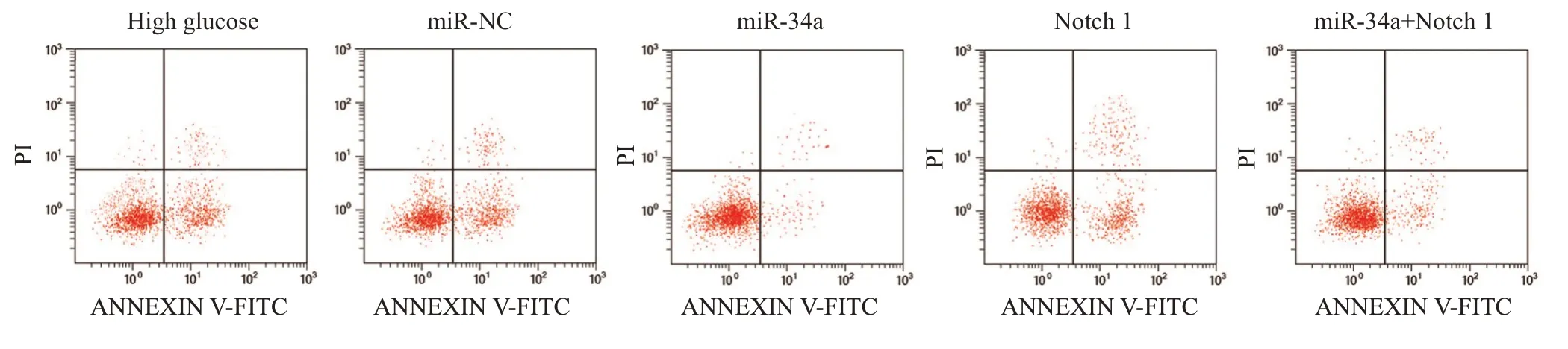
图4 各组足细胞流式凋亡结果Fig.4 Flow cytometry of podocyte apoptosis in each group.
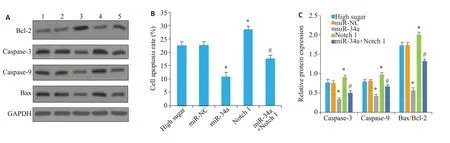
图5 各组足细胞凋亡率和凋亡相关蛋白水平Fig.5 Podocyte apoptosis and expressions of apoptosis-related proteins in each group.A and C:Levels of Caspase-3,Caspase-9 and Bax/Bcl-2 proteins(1:High glucose group;2:miR-NC group;3:miR-34a group;4:Notch 1 group;5:miR-34a+Notch 1 group);B:Apoptosis rate of podocytes.*P<0.05 vs miR-NC group;#P<0.05 vs miR-34a group.
2.5 各组小鼠肾组织病理情况和肾组织miR-34a表达比较
对照组小鼠肾组织细胞结构清晰完整,模型组小鼠肾组织细胞结构呈现出肾小球肿胀、体积增大以及部分伴有纤维化,miR-34a组小鼠的肾组织损伤程度降低(图6)。模型组小鼠肾组织miR-34a表达水平低于对照组(P<0.05),miR-34a组小鼠的肾组织miR-34a表达水平高于对照组(P<0.05,图7)。
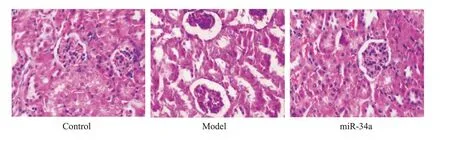
图6 各组小鼠肾组织HE染色Fig.6 HE staining of renal tissues in each group(Original magnification:×200).

图7 各组小鼠肾组织miR-34a表达Fig.7 Expression of miR-34a in the renal tissues in each group.*P<0.05 vs control group.
2.6 各组小鼠肾组织凋亡情况
模型组小鼠肾组织凋亡指数和caspase-3、caspase-9、Notch 1 蛋白水平高于对照组(P<0.05),miR-34a组小鼠肾组织凋亡指数和caspase-3、caspase-9、Notch 1蛋白水平低于模型组(P<0.05,图8、9)。
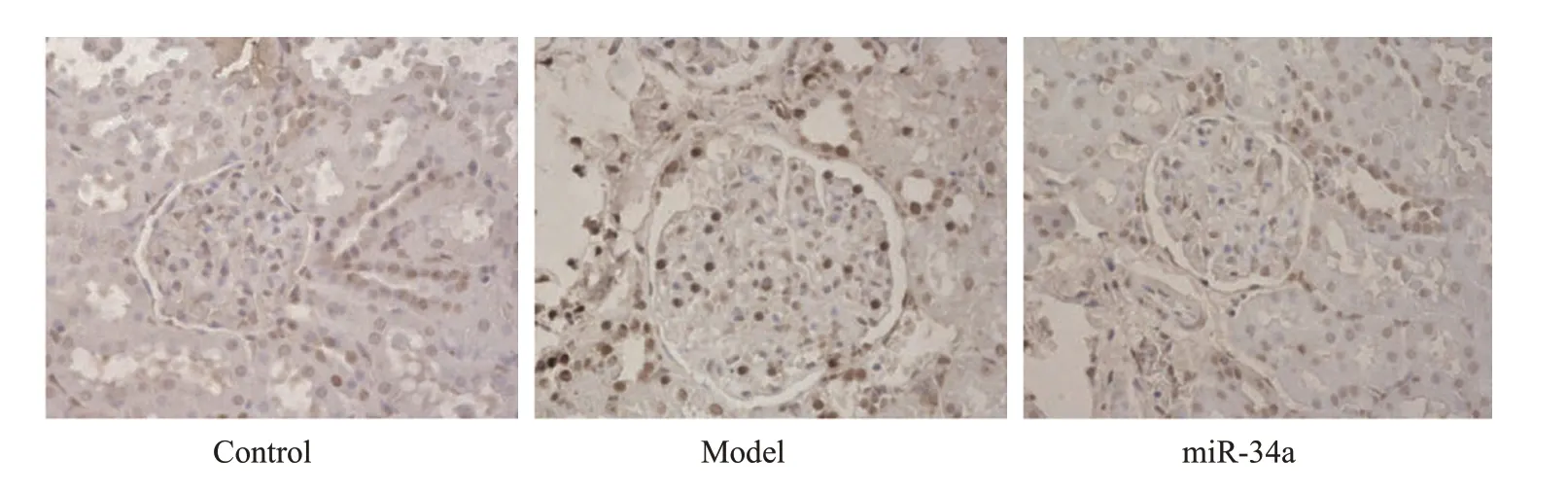
图8 各组小鼠肾组织TUNEL染色Fig.8 TUNELstaining of renal tissues in each group(×400).
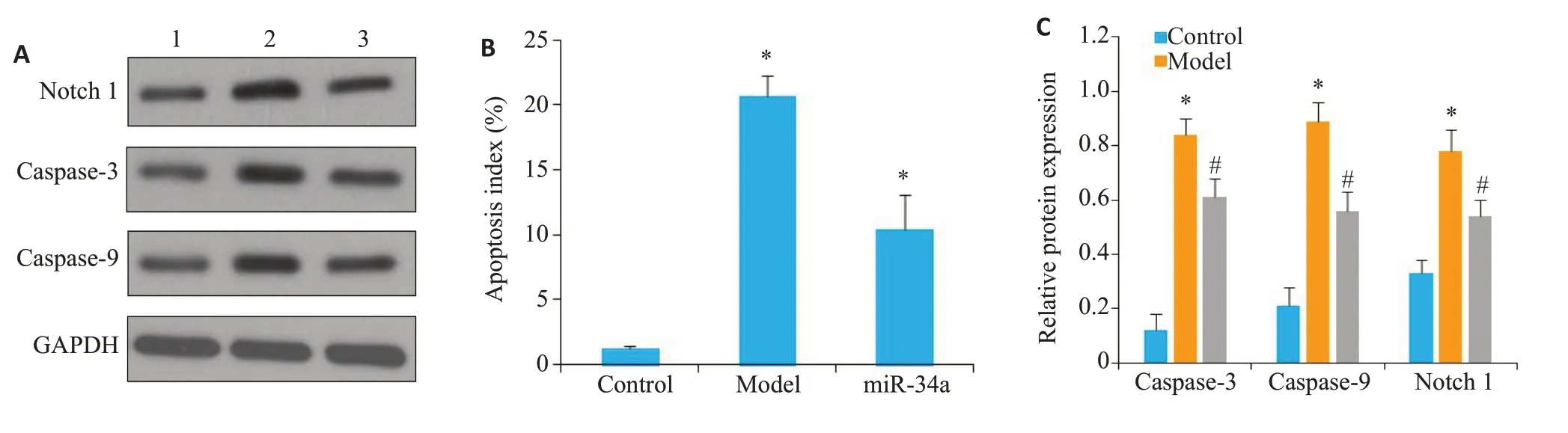
图9 各组小鼠肾组织凋亡相关蛋白水平Fig.9 Apoptosis index and expressions of apoptosis-related proteins in the renal tissues in each group.A and C:Expressions of caspase-3,caspase-9 and Notch 1 proteins detected by Western blotting(1:Control group;2:model group;3:miR-34a group);B:Apoptosis index of renal tissues.*P<0.05 vs control group;#P<0.05 vs model group.
3 讨论
DN是临床糖尿病患者常见的远期微血管并发症之一,随着病情恶化,可进展为肾功能衰竭,因此也是糖尿病患者致死因素之一[16,17]。DN早期发病具有隐匿特点,导致大部分DN确诊者的肾功损伤程度较大,目前主要采取早发现、早治疗的方式以延缓糖尿病患者肾功能降低进程[18]。目前尚无治疗DN的特效药,积极探索DN发病机制对控制DN病情进展具有重要意义。DN患者临床常见症状为蛋白尿,足细胞有助于维持肾小球滤过屏障的完整性,预防蛋白尿发生[19]。因此,足细胞损伤可能会影响DN发生以及患者预后。
miRNAs具有高度保守性、特异性,参与多种正常生理、病理生理过程[20,21],本研究结果显示高糖条件诱导下小鼠足细miR-34a表达水平降低,有研究表明高糖刺激能够促使足细胞miR-34a表达下调,诱导足细胞损伤[22]。本研究结果与其趋势相似,说明高糖环境确实可以诱导产生足细胞损伤,并且miR-34a也参与足细胞损伤过程。已有研究表明miR-145-5p也参与高糖诱导足细胞损伤过程,其作用机制可能是靶向作用于Notch信号通路减轻高糖诱导的细胞凋亡[23]。本研究结果显示miR-34a组足细胞中Notch 1表达水平呈降低趋势,此结果与上述前人研究结果相似,说明miR-34a对高糖诱导的足细胞损伤可能与Notch信号通路有关。
本研究通过荧光素酶实验明确miR-34a与Notch 1存在靶向关系,Notch信号通路参与肾脏导管上皮细胞的上皮间质转化过程,Notch 1是Notch信号通路的主要受体之一,该信号通路中的受体及其相应配体结合后,能够使Notch 1的构象发生改变并释放Notch胞内域,从而激活下游基因,调节细胞增殖、分化和凋亡等过程[24,25]。研究表明Notch信号通路在DN中呈明显活化状态,能够对血管生成、胰腺内分泌、外分泌细胞发生等产生影响,发挥介导足细胞损伤、凋亡等作用,还可促进肾小管间质损伤、纤维化,加重DN进展[26,27]。本研究结果显示miR-34a表达水平升高可以提高足细胞存活情况并降低足细胞的凋亡率和caspase-3、caspase-9、Bax/Bcl-2蛋白水平,而在miR-34a过表达水平基础上过表达Notch 1可以缓解上述指标的趋势,但是单纯Notch 1表达水平升高的足细胞的上述指标趋势呈完全相反状态,说明miR-34a过表达可以降低高糖诱导足细胞损伤和凋亡,可能与直接靶向作用Notch 1有关,而有研究证实,MicroRNA-34a通过负靶向脊髓损伤中的Notch通路来抑制神经元凋亡并减轻小胶质细胞炎症[28],与本研究结果一致。本研究通过建立动物DN实验发现DN小鼠肾组织存在肾小球肿胀、体积增大以及部分伴有纤维化现象,肾组织miR-34a表达水平降低,并且肾组织凋亡指数和促凋亡蛋白、Notch 1表达水平较正常小鼠升高,而给予miR-34a干预可以部分逆转DN小鼠的肾组织损伤和凋亡情况,还能抑制肾组织Notch 1蛋白水平,说明miR-34a表达水平升高可以通过介导Notch信号通路缓解DN足细胞损伤和凋亡情况。研究证实糖尿病肾病小鼠足细胞损伤与Numb依赖性Notch 1通路激活有关[29],提示miR-34a可能作为减轻DN足细胞损伤的靶向位点。
综上所述,miR-34a表达升高可以改善DN足细胞损伤和凋亡情况,可能与直接靶向抑制Notch 1表达进而抑制Notch信号通路激活有关。
