miR-519d-3p 调控TLR4 抑制脂多糖所致THP-1 源性巨噬细胞炎症的机制研究
2022-01-29周垂杨柯乐斌高仁贤
周垂杨 柯乐斌 高仁贤
急性肺损伤(acute lung injury,ALI)是肺部受到急性刺激后引发的严重肺部损伤疾病,表现为严重的低氧血症和多器官功能衰竭,在重症监护病房患者中造成较高的死亡率和不良的预后。尽管机械通气和对症治疗取得了进步,但针对ALI 患者仍没有具体有效的治疗策略[1]。ALI 过程中肺部的巨噬细胞炎症反应和上皮细胞的凋亡是导致肺部急性损伤的关键因素[2]。巨噬细胞释放大量炎性因子,诱导局部产生炎症风暴,同时诱导上皮细胞发生凋亡,探究其中的分子机制将有利于进一步了解和治疗ALI[3]。MicroRNA(miRNA)是由20~25 个核苷酸组成的单链短非编码RNA,其主要的功能是通过与靶基因3’UTR 序列结合,诱导mRNA 发生降解,从而抑制基因转录后蛋白的翻译过程。研究表明,miRNA 在调节败血症诱导的炎症,氧化应激和ALI 中发挥着重要的作用[4]。此前研究发现,多种恶性肿瘤miR-519d-3p 表达下调,主要功能为抑制肿瘤细胞增殖、迁移和缺氧应激[5],而对于炎症反应研究较少。本研究利用LPS 构建巨噬细胞炎症模型,探究miR-519d-3p 在ALI 病理损伤过程中对巨噬细胞的活化所引发炎症的作用及分子机制。
1 实验材料
1.1细胞株 人髓系白血病单核细胞株(THP-1)购自北京北纳创联生物技术研究院(目录号BNCC342033)。培养条件:RPMI1640 培养基(含10%热灭活胎牛血清和1%双抗)。
1.2试 剂 脂多糖(LPS)(批号46683)、佛波酯(Phorbol ester,PMA)(批号54878)购自美国Sigma公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(批号95465)、白介素-1β(interleukin-1β,IL-1β)(批号51483)、白介素-6(interleukin6,IL-6)等炎症因子检测试剂盒购自美国Sigma 公司。Trizol,荧光定量PCR 试剂购自日本Takara 公司;一步法miRNA 反转录试剂盒购自北京信诺金达生物科技有限公司(批号Q1014L);Lipofectamine 2000 购自Life Technologies(批号11668030)。抗体p-p65(批号a165648);T-p65(批 号355648);p-IκBα(批 号19812);T-IκBα(批 号498414);p-RIP3(批 号a29104);受体相互作用蛋白激酶1(RIPK1,批号a18498)均购自美国CST 公司;甘油醛3-磷酸脱氢酶(GAPDH,批号19842)为内参蛋白,购自杭州戴格生物技术有限公司。el-miR-519d-3p 及antago-NC、miR-519d-3p mimic 及mimic-NC,siNC 及siTLR4均由上海吉玛制药技术有限公司合成提供。PCR 引物均由北京擎科生物科技有限公司合成提供。引物序列:miR-519d-3p:F:5′-TGCGGCAAAGTGCCTCCCTTTAG-3′,R:5′-CCAGTGCAGGGTCCGAGGT-3′;U6:F:5′-CTCGCTTCGGCAGCACA-3′,R:5′-AACGCTTCACGAATTTGCGT-3′。
2 实验方法
2.1THP-1 细胞诱导及LPS 炎症模型建立 THP-1细胞用含10%热灭活胎牛血清的RPMI1640 培养基扩增培养,并以3×105个/孔接种于6 孔板中,培养基中添加100ng/mL 佛波酯(PMA,用DMSO 溶解)作用48h,诱导细胞分化为巨噬细胞。每孔中加入200ng/mL LPS 刺激构建炎症模型,对照组添加磷酸盐缓冲液(PBS),于处理后12h 后进行后续检测。
2.2荧光定量PCR(RT-PCR)检测THP-1 细胞miR-519d-3p 表达 将上述LPS 处理后的细胞利用Trizol 提取总RNA,并利用一步法miRNA 反转录试剂盒逆转为cDNA,后续利用TB Green 进行荧光定量PCR,以U6 为内参,检测miR-519d-3p 表达水平,以2-△△Ct 法计算相对表达量。
2.3细胞转染 THP-1 细胞经PMA 诱导48h 贴壁后,按Lipofectamine 2000 说明书转染antago-miR-519d -3p 及antago -NC、miR -519d -3p mimic 及mimic-NC,转染方法如下:取2 个1.5mL 离心管分别加入500μL opti-MEN 培养基,两管中分别加入1μg的质粒或2μL Lipofectamine 2000 室温静置20min,之后加入到细胞中,转染6h 后换液。细胞转染24h后,用LPS 刺激12h,收集细胞上清及细胞进行后续检测。siTLR4 的转染同上。
2.4巨噬细胞炎症水平检测 采用酶联免疫吸附测定(ELISA)试剂盒检测TNF-α、IL-1β、IL-6 含量,设置6 个复孔。具体方法按说明书操作。
2.5蛋白免疫印迹测TLR4、p-p65、T-p65、p-IκBα、T-IκBα 蛋白水平 将处理好的细胞用RIPA 裂解液裂解提取全蛋白,进行蛋白免疫印迹(Western blot),经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白后转膜至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,之后利用5%牛奶封闭,4℃孵育一抗过夜,次日TBS-T 洗去未结合的一抗,加入二抗室温孵育1h,在PVDF 膜上滴加超敏反应底物进行曝光,利用扫膜仪进行成像分析,检测Toll 样受体4(Toll-like receptor 4,TLR4)、磷酸化核因子κB 蛋白(phospho nuclear factor kappa-B,p-NF-κB/p-p65)、总核因子κB 蛋白(total nuclear factor kappa-B,T-NF-κB/T-p65)、磷酸化NF-κB 抑制蛋白(phospho inhibitor of NF-κB,p-IκBα)、总NF-κB 抑制蛋白(total inhibitor of NF-κB,T-IκBα)蛋白水平。
2.6统计学方法 应用SPSS 22.0 软件进行统计分析,计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用SNK-q 检验。P<0.05 表示差异有统计学意义。
3 实验结果
3.1miR-519d-3p 在LPS 诱导的THP-1 源巨噬细胞表达 与对照组(1.00±0.25)比较,LPS 组(1.85±0.10)细胞内miR-519d-3p 水平明显升高,差异有统计学意义(P<0.05)。
3.2过表达miR-519d-3p 拮抗剂可抑制LPS 诱导的巨噬细胞上清液炎症因子释放 与antago-NC 组比较,LPS+antago-NC 组细胞上清液TNF-α、IL-6、IL-1β 相对表达量明显升高,差异有统计学意义(P<0.05),表明LPS 诱导巨噬细胞炎症模型成功。与LPS+antago-NC 组比较,LPS+antagomiR-519d-3p 组细胞上清液TNF-α、IL-6、IL-1β 相对表达量明显降低,差异有统计学意义(P<0.05)。见表1。
表1 各组细胞上清液TNF-α、IL-6、IL-1β相对表达量()
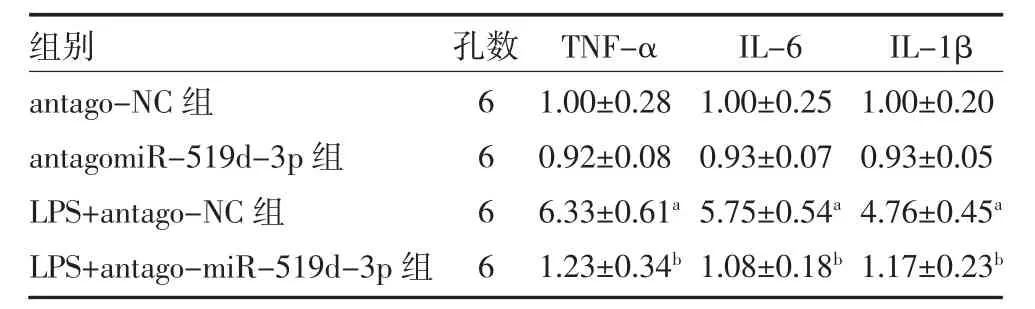
表1 各组细胞上清液TNF-α、IL-6、IL-1β相对表达量()
注:TNF-α 为肿瘤坏死因子-α;IL-6 为白介素-6;IL-1β 为白介素-1β;与antago-NC 组比较,aP<0.05;与LPS+antago-NC 组比较,bP<0.05
3.3miR-519d-3p 拮抗剂抑制LPS 诱导的巨噬细胞p-p65、p-IκBα 活化 与antago-NC 组比较,LPS+antago-NC 组p-p65、p-IκBα 蛋白活化水平明显升高,而T-p65、T-IκBα 无明显变化。与LPS+antago-NC 组比较,LPS+antago-miR-519d-3p 组细胞中pp65、p-IκBα 蛋白活化水平明显降低。见图1。
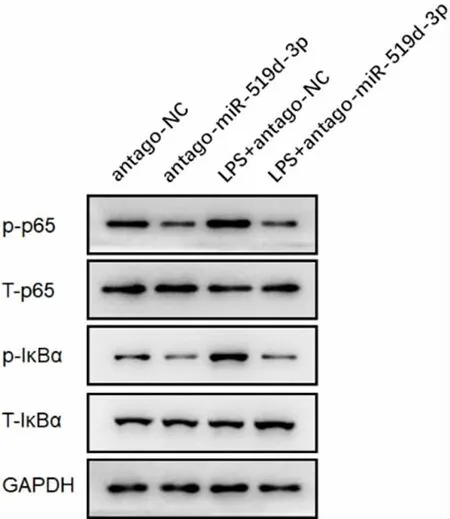
图1 各组巨噬细胞p-p65、T-p65、p-IκBα、T-IκBα 蛋白水平
3.4miR-519d-3p 调控TRL4 表达 与antago-NC比较,LPS+antago-NC 组TLR4 蛋白水平明显升高。与LPS+antago-NC 组比较,LPS+antagomiR-519d-3p组细胞TLR4 蛋白水平明显降低。见图2。
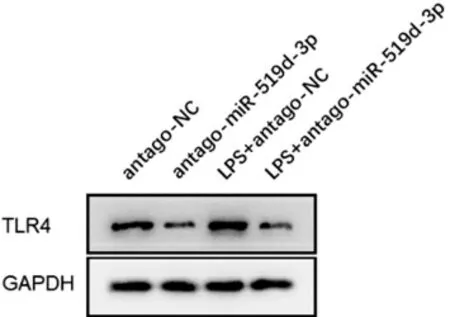
图2 各组巨噬细胞TLR4 表达情况
3.5敲降TRL4 抑制巨噬细胞p-p65、p-IκBα 活化 为了进一步验证miR-519d-3p 通过TLR4 调控下游p-p65、p-IκBα 活化,我们在巨噬细胞中敲低TLR4,同时过表达miR-519d-3p mimic,经LPS 诱导后,检测相关蛋白表达。结果显示,与LPS+siScr+mimic-NC组比较,LPS+siTLR4+mimic-NC 组pp65、p-IκBα 活化水平明显降低,而LPS+siScr+miR-519d-3p mimic 组p-p65、p-IκBα 活化水平明显升高。与LPS+siScr+miR-519d-3p mimic 组比较,LPS+siTLR4+miR-519d-3p mimic 组p-p65、p-IκBα 活化水平明显降低。见图3。
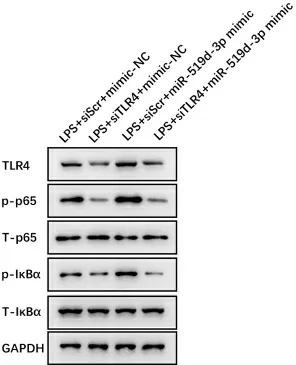
图3 各组巨噬细胞TLR4、p-p65、T-p65、p-IκBα、T-IκBα 蛋白水平
4 讨论
ALI 中巨噬细胞诱导的急性炎症反应导致细胞因子和趋化因子的过度释放以及富含蛋白质的液体的溢出,加剧局部组织损伤破坏。巨噬细胞活化方式分为M1 促炎型和M2 抑炎型,在炎症过程中,M1 和M2 参与调节固有免疫应答及各种炎症反应。炎症早期,巨噬细胞主要极化为M1 型起到清除病原微生物的作用,而随着炎症发展,后期则以M2 型为主,发挥抑炎作用,促进损伤修复[6]。LPS 诱导巨噬细胞为M1型是研究炎症的经典细胞模型,因此,在本研究中,我们利用LPS 刺激的THP-1 源性巨噬细胞炎症模型,研究miR-519d-3p 在巨噬细胞介导的ALI 炎症中的作用和机制。
近年研究表明,miRNA 可以用作疾病的生物标志物和治疗方法,在癌症、过敏性疾病[7]、心血管疾病[8]、糖尿病[9]等疾病中均有应用。文献报道,miR-519d-3p在多种肿瘤细胞表达上调,通过调控磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI3K/AKT)、Wnt/β-连环蛋白(Wnt/βcatenin)等信号通路的活化,促进肿瘤细胞的恶性增殖、迁移、侵袭[10-13]。此外miR-519d-3p 梗死心肌组织表达上调,通过与HOX 转录反义RNA(HOX transcript antisense RNA,HOTAIR)相互作用,加剧缺氧诱导的心肌细胞凋亡[14]。研究发现,miRNA 在ALI中起重要作用,miRNA 的表达与免疫应答、炎症反应等密切相关,且基于其在血液、组织等样本中表达稳定,miRNA 有望成为ALI 新的生物标志物及潜在的治疗靶点。本研究发现,在LPS 诱导的巨噬细胞炎症模型中,细胞miR-519d-3p 表达明显上调,提示miR-519d-3p 可能在ALI 中发挥重要作用。
巨噬细胞在LPS 刺激作用下,TLR4 受体表达明显上调,同时TLR4 信号激活后可最终导致下游NFκB 信号异常活化,p-p65、p-IκBα 磷酸化水平增加,促进分泌大量TNF-α、IL-6、IL-1β[15]。本研究发现,巨噬细胞抑制miR-519d-3p 可明显抑制LPS 诱导的TLR4 受体表达上调,降低的p-p65、p-IκBα 活化水平,减少促炎因子TNF-α、IL-6、IL-1β 的分泌。表明miR-519d-3p 可能通过抑制TLR4 的表达而降低巨噬细胞内炎症反应。
综上所述,本研究结果显示,miR-519d-3p 在ALI 中低表达,过表达miR-519d-3p 可以抑制LPS诱导的巨噬细胞炎症反应,该调控可能通过抑制TLR4 表达水平完成。提示miR-519d-3p 可能作为ALI 诊断治疗过程的生物标志物和潜在靶点。
