铜取代的多金属氧酸盐电催化水氧化性能研究
2022-01-27喻莉,梁钦
喻 莉,梁 钦
(信阳师范学院 a.化学化工学院;b.人事处,河南 信阳 464000)
0 引言
全球范围内人口的增长和生活水平的提高使得人们对能源的产生、储存、利用的关注日益强烈。当前,地球上大部分的能源来自于化石燃料 (石油、煤和天然气),虽然这些化石燃料的储量能够满足人类50~150 a的需求,但是一经耗尽便无法再生[1]。另外,大量的使用化石燃料还会带来严重的环境问题,例如空气污染和温室效应[2]。以上问题使得人们开始研究和开发能替代化石燃料的新型能源,以满足人类对能源的大量需求。基于经济、环境和人类健康等重要因素,新型能源必须具备廉价、丰产、环保和可再生等特点[3-4]。
氢气作为一类热值高、无污染、可再生的绿色能源,是构建未来清洁能源格局的理想组成部分[5]。水裂解是最直接、最简便以及最环保的用于制备氢气的方法之一,它由两个步骤组成,分别为产氧反应和产氢反应。由于需要四电子的转移,导致产氧反应相对于产氢反应更加复杂和困难,成为制约全分解水发展的瓶颈,所以高效、稳定以及廉价的水氧化催化剂的设计与开发具有重要的理论意义及应用背景[6]。
多金属氧酸盐 (多酸,POMs) 是一类结构多样的多金属氧簇化合物,这类具有全无机配体的化合物在氧化环境中具有较好的稳定性,而且在快速、可逆以及逐步多电子转移的过程中不发生结构的变化[7-9]。另外,Cu是地球上的第八丰产元素,由于具有优秀的生物性、无毒性、光学性、环境友好性以及杰出的催化性能,使得含Cu的化合物已被认为是最重要的水氧化催化剂之一[10]。
因此,我们选择Cu取代的POM:[Cu5(OH)4(H2O)2(A-α-SiW9O33)2]10-(化合物1)[11]在酸性环境下用于电催化产氧,利用循环伏安、恒电压电解、扫描电镜、能量色散X射线谱等考察化合物1在电催化过程中和对应简单金属盐 (CuCl2) 在催化行为和催化能力上的区别,验证化合物1在参与的电催化体系中是否是真正的产氧活性物种。
1 实验部分
1.1 化学试剂
Na2SiO3·9H2O、Na2WO4·2H2O、HCl、KCl、K2CO3、CuCl2·2H2O、CH3COOH、CH3COONa·3H2O等均购于国药集团化学试剂有限公司,且均为分析纯试剂,固体试剂直接使用,没有经过纯化。
1.2 仪器装置
电化学工作站(CHI600D,上海辰华仪器有限公司),傅里叶变换红外光谱仪(VERTEX 70v,Bruker公司),场发射扫描电子显微镜(S-4800,日立公司)。
1.3 反应条件
由GCE/ITO、Pt丝电极、Ag/AgCl电极 (3.5 mol/L KCl) 组成三电极体系,扫速为100 mV/s,100 mmol/L枸橼酸钠缓冲溶液 (pH 4.2),催化剂用量为2.0 mmol/L。
1.4 配体K8-α-[SiW11O39]的合成
K8-α-[SiW11O39]按照文献报道的方法合成[12],步骤如下:室温下,取2 g (9 mmol) Na2SiO3·9H2O溶于18 mL水中 (溶液A);另取33 g (0.1 mol) Na2WO4·2H2O溶于54.5 mL沸水中 (溶液B)。向沸腾的溶液B中缓慢滴加30 mL HCl溶液 (4 mol/L),滴加时间不少于30 min,沉淀随着搅拌逐渐溶解。快速地将A溶液和9 mL HCl溶液 (4 mol/L) 倒入至上述溶液中,此时pH值为6,保持沸腾1 h。冷却后过滤,往滤液中加入27 g KCl,产生大量白色沉淀,过滤收集目标产物,并用1 mol/L KCl溶液和水冲洗产物,将白色产物放到容器中,自然干燥。
1.5 配体K10[A-α-SiW9O34]的合成
K10[A-α-SiW9O34]按照文献[13]报道的方法合成,步骤如下:取3.12 mmol K8-α-[SiW11O39]溶于100 mL水中,加热至50 ℃,冷却至室温 (溶液A)。另取2.58 g (18.72 mmol) K2CO3溶于22 mL水中,并将此溶液缓慢滴加到溶液A中,此时溶液pH值为9.4,继续搅拌20 min,过滤,并往滤液中加入8 g (0.058 mol) K2CO3,持续搅拌2 h,产生白色沉淀,过滤,收集产物,并用饱和KCl溶液冲洗产物,将白色产物置于空气中自然干燥。
1.6 化合物1的合成
化合物1按照文献[11]报道的方法合成,步骤如下:取0.16 mmol K10[A-α-SiW9O34]和0.076 g (0.44 mmol) CuCl2·2H2O于20 mL的0.5 mol/L NaAc缓冲溶液中 (pH 4.8),加热至80 ℃,保持30 min,冷却后过滤,将淡绿色的滤液转移到结晶皿中,4~5周后得到淡绿色晶体。
[{Cu2(H2O)SiW8O31}2]12-、[Cu4(H2O)2(OH)4Si2W16O58]8-、[Cu6Cl(SbW9O33)2]7-和[Cu20Cl(OH)24(H2O)12(P8W48O184)]25-按照文献[14-17]方法合成。
2 结果与讨论
2.1 化合物1的表征
化合物1是本文的主要催化剂,它是一个二聚物,由两个Keggin型的A-α-[SiW9O34]10-基团和一个[Cu5(OH)4(H2O)2]6+中心组成,通过相邻的W-O-W将以上两个基团连接起来,从而形成一个具有C2v对称的结构 (图1a)。IR是POMs中最常用的表征手段,图1b为化合物1的IR谱图。由图1b可以看出,化合物1在1009、 949、916、890、812、769、699、596、546、428 cm-1处有特征吸收,与文献[14]报道的非常接近。
[{Cu2(H2O)SiW8O31}2]12-、[Cu4(H2O)2(OH)4Si2W16O58]8-、[Cu6Cl(SbW9O33)2]7-和[Cu20Cl(OH)24(H2O)12(P8W48O184)]25-的FT-IR如图2所示。[{Cu2(H2O)SiW8O31}2]12-在1013、960、907、805、746、687、625、541、529、492 cm-1处有特征吸收,基本与文献一致 (图2a);[Cu4(H2O)2(OH)4Si2W16O58]8-在988、946、890、836、734、684、570 cm-1处有特征吸收,基本与文献一致 (图2b);[Cu6Cl(SbW9O33)2]7-在938、889、845、770、734、511 cm-1处有特征吸收,基本与文献一致 (图2c);[Cu20Cl(OH)24(H2O)12(P8W48O184)]25-在1002、950、902、813、769、699、538 cm-1处有特征吸收,基本与文献一致 (见图2d)。

图1 (a) 化合物1的多面体模型 (左) 和球棍模型 (右); (b) 化合物1的FT-IR谱图Fig. 1 (a) The polyhedral model (left) and ball-andstick model (right) of compound 1;(b) FT-IR spectrum of compound 1

图2 [{Cu2(H2O)SiW8O31}2]12- (a)、 [Cu4(H2O)2(OH)4Si2W16O58]8- (b)、[Cu6Cl(SbW9O33)2]7- (c) 和[Cu20Cl(OH)24(H2O)12(P8W48O184)]25- (d) 的FT-IR谱图Fig. 2 FT-IR spectrums of [{Cu2(H2O)SiW8O31}2]12- (a)、 [Cu4(H2O)2(OH)4Si2W16O58]8- (b)、[Cu6Cl(SbW9O33)2]7- (c) and [Cu20Cl(OH)24(H2O)12(P8W48O184)]25-
2.2 化合物1电催化水氧化的研究
在相同的反应条件下,对以下几个含Cu的POMs进行了电催化产氧活性的测试,分别为:化合物1、[{Cu2(H2O)SiW8O31}2]12-、[Cu4(H2O)2(OH)4Si2W16O58]8-、[Cu6Cl(SbW9O33)2]7-和[Cu20Cl(OH)24(H2O)12(P8W48O184)]25-。如图3所示,以上几个POMs在相同条件下展现出不同的产氧活性,其中在化合物1中具有最大的催化电流,而且在电流密度为0.35 mA/cm2处有最小的起始电位 (1.20 V@0.35 mA/cm2)。由此可知,POMs的产氧活性和自身所包含的金属中心个数是无关的,而与POMs的独特结构有关。
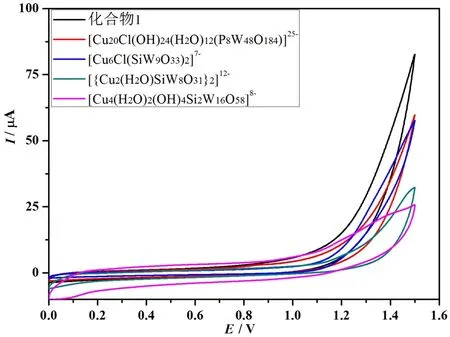
图3 不同Cu取代的POMs在相同条件下的CV曲线Fig. 3 CVs of different copper-containing POMs in buffer
在均相催化剂参与的电催化反应中,研究真正的活性物种是非常重要的,因为不稳定的均相催化剂在施加一定电压后容易发生分解释放出对应的金属离子,从而生成其他的多相活性物种,而均相催化剂本身只充当前催化剂,这使得对应体系产生的催化电流以及实验现象都是值得怀疑的,所以在POMs参与的电催化过程中要寻找真正的活性来源,才能进一步地研究水氧化反应。由此可见,研究POMs的电催化稳定性显得尤为重要。因此,通过考察化合物1与Cu2+在催化过程中的相异性来研究化合物1的稳定性。
第一,使用标准三电极体系,对化合物1进行了CV测试,如图4a中黑线所示,化合物1在pH值为4.2的缓冲溶液中产生的催化电流为85 μ A (电流密度为1.2 mA/cm2);取上述实验后的工作电极,在不打磨不清洗的情况下,插入到空白的缓冲溶液中继续进行CV测试 (图4a中红线),发现产生的催化电流仅略高于单独使用缓冲溶液时的电流 (图4a中蓝线),由此可知工作电极表面并没有活性物质的残留。而CuCl2在相同条件下却具有不同的催化能力和催化行为,如图4b中黑线所示,CuCl2在缓冲溶液中产生的催化电流为270 μA (电流密度为3.7 mA/cm2);取上述实验后的工作电极,在不打磨不清洗的情况下,插入到空白的缓冲溶液中继续进行CV测试,发现产生的催化电流并没有明显的降低 (图4b中红线),这说明工作电极表面残留了能产生催化电流的活性物种。通过以上几组CV实验可知,虽然CuCl2具有更高的催化电流,但是在催化过程中生成了多相活性物种CuOx,而化合物1参与的产氧反应中,工作电极表面并没有生成其他的活性物种,从而说明化合物1在电催化过程中是稳定的。
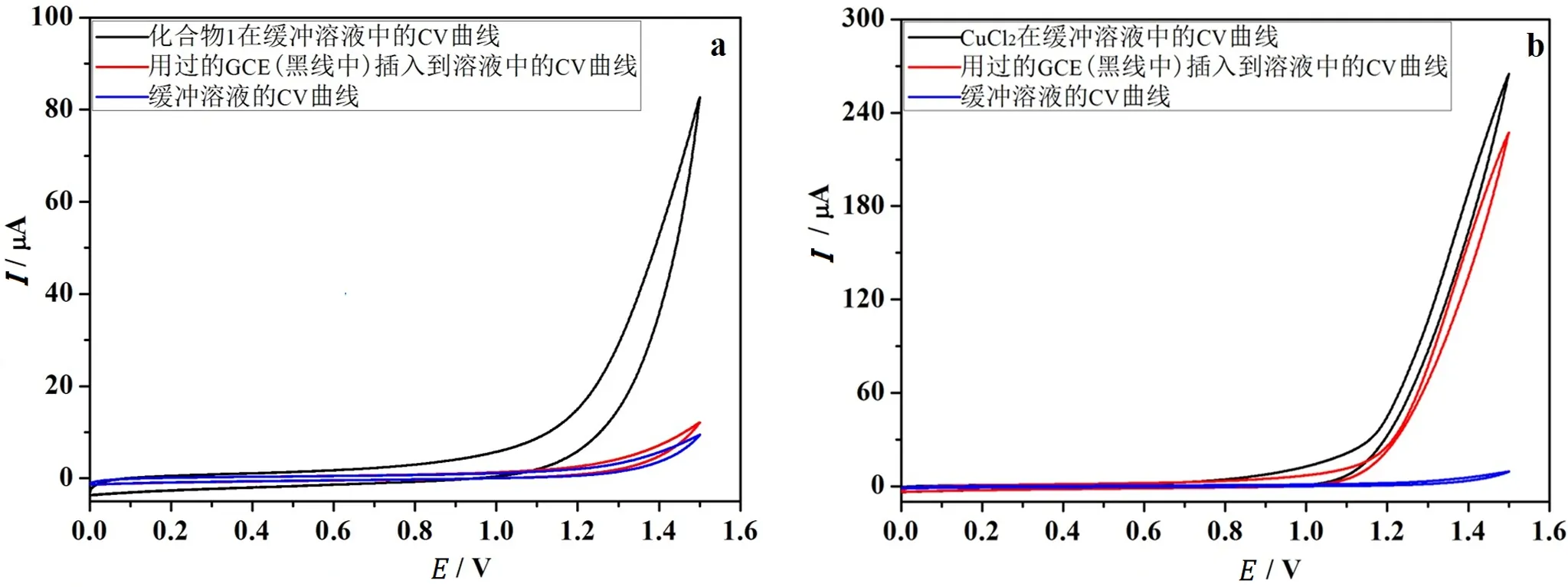
图4 (a) 化合物1的CV测试;(b) CuCl2的CV测试Fig. 4 (a) CV curve of compound 1;(b) CV curve of CuCl2
第二,为了进一步证明化合物1的稳定性,对化合物1和CuCl2分别进行了另外一组线性循环伏安 (LSV) 测试。如图5a所示,化合物1在进行第1次和第100次LSV测试时产生的催化电流基本相同,由此说明化合物1在电催化过程具有较好的稳定性;而CuCl2在相同条件下产生的电流随着LSV测试次数的增加而增加 (图5b),电流随着时间的延续而发生变化是催化剂不稳定的特征。
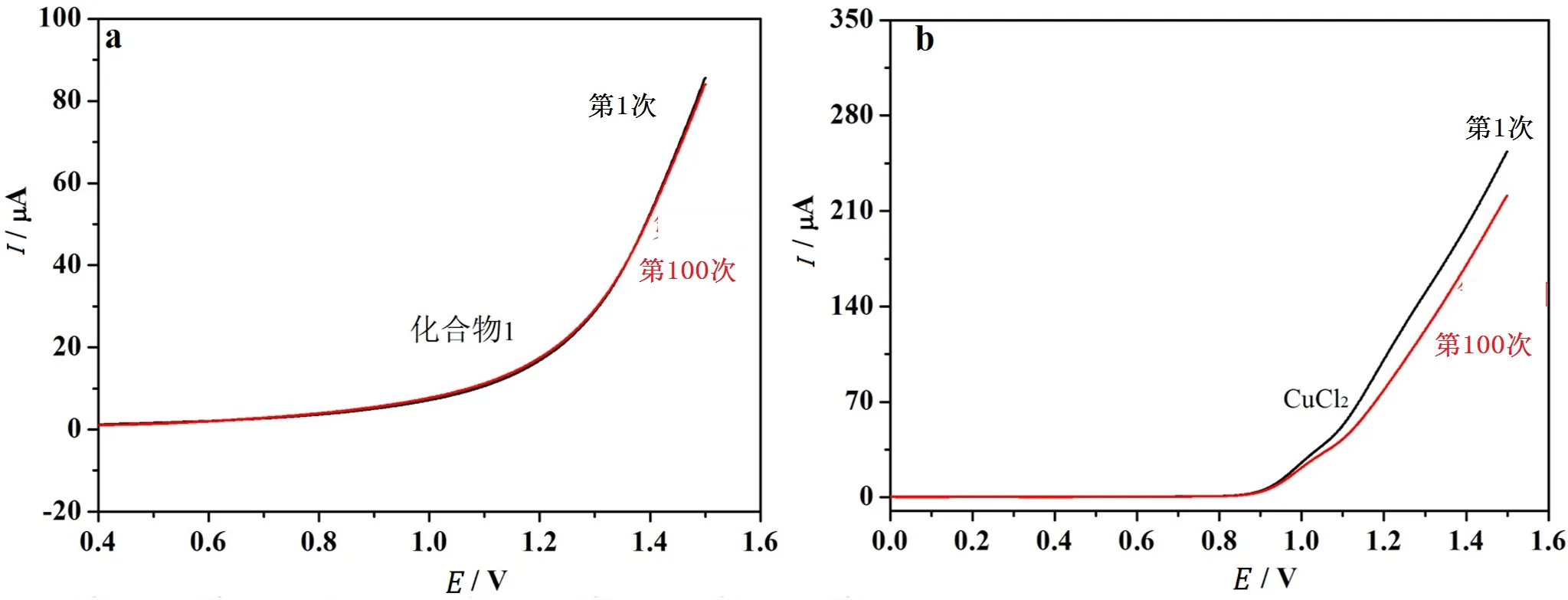
图5 (a) 化合物1 (a) 和CuCl2 (b) 在缓冲溶液中的LSV曲线 (第1次和第100次LSV的测试数据)Fig. 5 LSV curves and of catalysts for the 1st and 100th cycle in buffer: compound 1 (a), CuCl2 (b)
第三,通过电解实验考察了化合物1和CuCl2在电催化产氧过程中的稳定性。如图6a所示,对化合物1参与的产氧体系施加1.2 V (vs. Ag/AgCl电极) 的电压进行电解,化合物1产生的电流随着电解时间的延续始终保持恒定 (红线);将上述电解实验后的工作电极直接插入到空白的缓冲溶液中继续进行第二次的电解实验 (蓝线),发现产生的电流仅略高于空白时的电流 (黑线),这说明工作电极表面并没有活性物种的残留。对CuCl2参与的产氧体系同样施加1.2 V (vs. Ag/AgCl电极) 的电压进行电解,如图6b所示,CuCl2产生的电流随着电解时间的延续出现上下波动的趋势;将上述电解实验后的工作电极也直接插入到空白的缓冲溶液中继续进行电解实验,发现产生了较高的催化电流 (蓝线),这说明工作电极表面可能有多相活性物种的残留。为了验证以上两种结论,取图6中两条红线对应体系中的ITO进行了扫描电镜(SEM)和能量色散X射线谱(EDX)测试,发现化合物1参与产氧体系中的ITO电极表面确实没有多相物种的生成 (图7a、b),而对应的简单金属盐CuCl2在催化过程中却生成了其他的活性物种 (图7c、d)。通过以上分析可知,化合物1和CuCl2不管是在催化活性还是在催化行为上都有明显的区别。
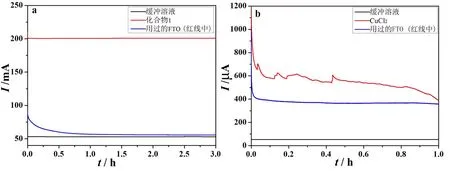
图6 化合物1 (a) 和CuCl2 (b) 在1.2 V (vs. Ag/AgCl电极) 的电压下产生的电流随时间的变化趋势Fig. 6 Water electrolysis under an applied voltage of 1.2 V vs Ag/AgCl electrode in buffer solution: compound 1 (a), CuCl2 (b)
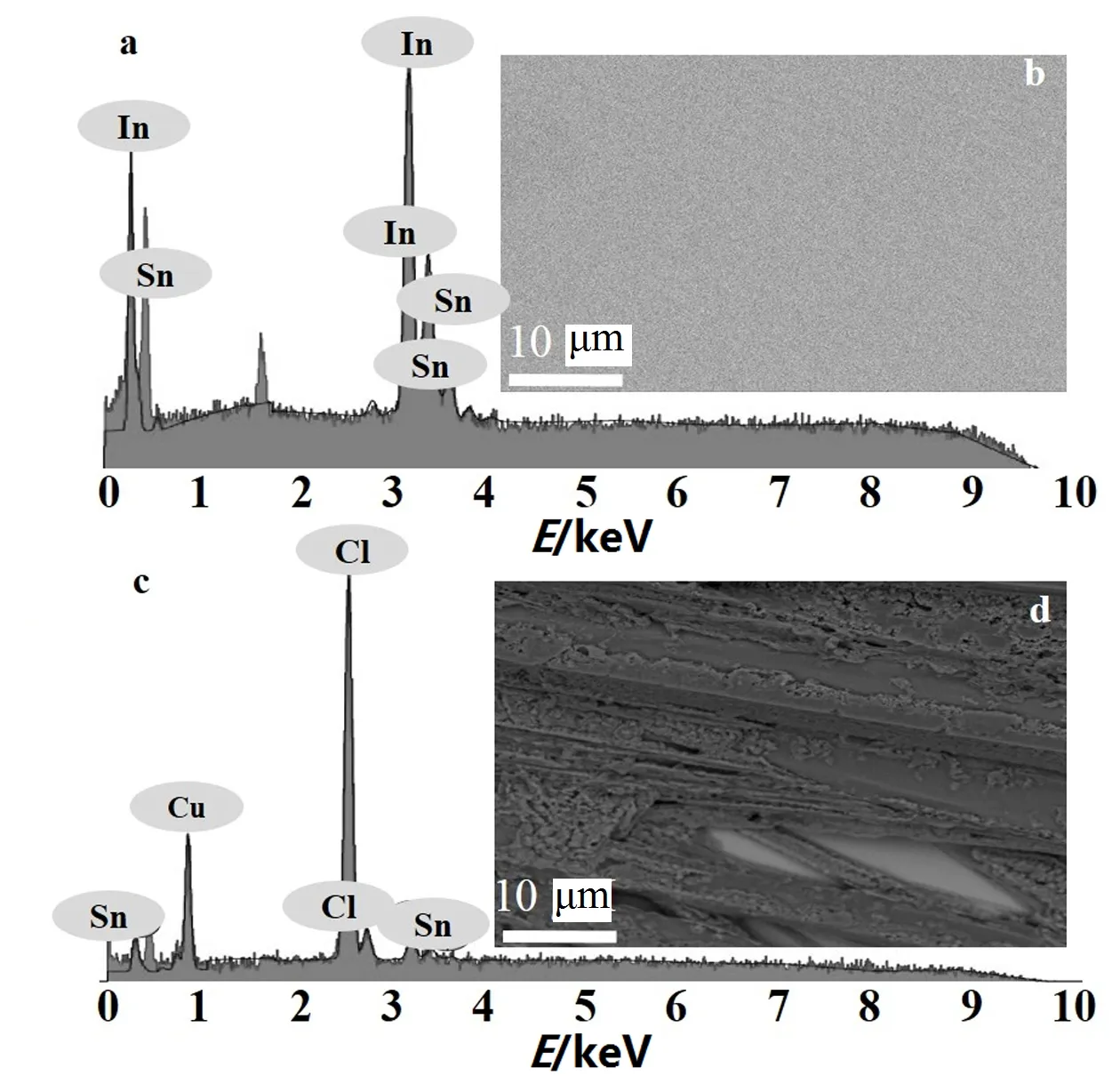
图7 化合物1 (a, b) 和CuCl2 (c, d) 参与电解实验后ITO的SEM图和EDX图Fig.7 SEM and EDX of the surface of an ITO electrode after 3 h (compound 1, ab)/1 h (CuCl2, cd) of catalytic water electrolysis
第四,POMs和对应的简单金属盐在化学组成和空间结构上都是不同的,这导致它们在水氧化体系中具有不同的电荷转移电阻。电化学阻抗谱(EIS)关系到水氧化过程中电荷和电子转移的反应动力学,所以可以通过阻抗谱区别POMs和CuCl2在水氧化行为上的不同。化合物1和CuCl2的EIS测试条件是:5 mV的交流电压、100 000到0.1的频率以及pH值为4.2的枸橼酸钠缓冲溶液(100 mmol/L)。如图8所示,化合物1和CuCl2的半圆直径不同,这说明它们拥有不同的电荷转移电阻,也就是具有不同的电荷和电子转移速率,由此可以解释为什么化合物1和CuCl2在相同条件下展现出不同的电催化产氧性能。
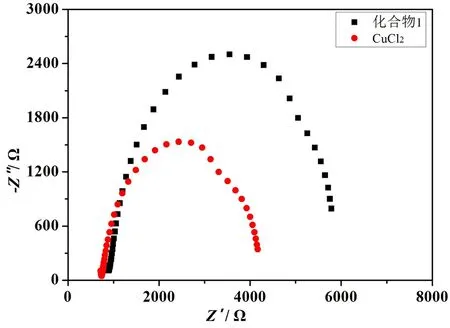
图8 化合物1和CuCl2的EISFig. 8 Electrochemical impedance spectroscopy tests of compound 1 and CuCl2
3 结论
合成并表征了一个Cu取代的POM:[Cu5(OH)4(H2O)2(A-a-SiW9O33)2]10-(化合物1),并首次在酸性环境下将它应用到电催化体系中进行产氧反应。很多基于Cu的水氧化催化剂基本都是在pH>10.8的环境中进行产氧反应,而化合物1在pH值为4.2的条件下却具有电催化产氧的能力。同时利用CV、LSV以及电解实验说明了化合物1在催化过程中是稳定的,并利用SEM和EDX验证了化合物1参与的电解实验中的工作电极表面确实没有多相物种的生成,而对应的简单金属盐CuCl2在催化过程中却生成了其他的活性物种,这进一步说明了化合物1在本体系中是真正的产氧活性物种。
