一株氨化芽孢细菌的分离鉴定及氨化培养基优化
2022-01-27朱欣乐陈思宇杨正刘晶黄元昊彭英杰兰时乐
朱欣乐, 陈思宇, 杨正, 刘晶, 黄元昊, 彭英杰, 兰时乐
(湖南农业大学 生物科学技术学院,湖南 长沙 410128)
人类需要从食物中摄取蛋白质以维持正常的生命活动。水产品、谷类和牛奶是食物蛋白质的主要来源,其中水产品约占蛋白质总供应量的6.5%[1]。随着消费者对水产品需求量的增加,促使了水产高密度养殖模式的快速发展,同时也导致了养殖水体日益严重的富营养化问题,而氮是导致水体富营养化的关键元素[2]。养殖水体中的氮污染物主要包括有机氮化物以及NH4+-N、NO2--N、NO3--N等无机氮。目前,国内外许多科研工作者对水体中无机氮的去除进行了大量卓有成效的研究[3-6],但有机氮的氨化过程研究较少。氨化作用是水体中有机氮去除的起始环节,直接影响到后续除氮进程[7]。氨化细菌将有机氮降解为NH4+-N,再通过硝化作用和反硝化作用转化为N2O、N2[8-9],以此实现水体脱氮。
目前已报道的氨化细菌主要包括Bacillus[10]、Pseudomonas[2,11]、Micrococcus[12]、Arthrobactersp.[2]、Lysinibacillusfusiformis[13]、Stenotrophomonasmaltophilia[14]、Enterobacteraerogenes[15]等。本试验从精养池塘底泥中分离纯化得到10株具有氨化能力的芽孢杆菌,根据形态学、生理生化特征及16S rDNA序列分析的方法鉴定菌株ZXL-7,初步探讨培养基组成对菌株ZXL-7氨化能力的影响,为氨化细菌用于养殖水体中有机氮降解提供了科学依据。
1 材料与方法
1.1 材料
1.1.1 菌种分离样品来源
菌种分离样品采集于湖南农业大学水产养殖基地精养池塘底泥。
1.1.2 培养基
富集培养基:鱼粉1%,葡萄糖2%,KH2PO40.2%,MgSO4·7H2O 0.1%,FeSO4·7H2O 0.01%,pH 7.2。
平板分离培养基:在富集培养基中加入2%琼脂。
种子液培养基:牛肉膏0.5%,NaCl 0.5%,蛋白胨1%,pH 7.2。
斜面培养基:在种子液培养基中加入2%琼脂。
分离培养基:蛋白胨0.5%,NaCl 0.025%,FeSO4·7H2O 0.001%,KH2PO40.05%,MgSO4·7H2O 0.05%,pH 7.2。
氨化培养基[16]:葡萄糖3%,豆粕粉1.5%,KH2PO40.2%,MgSO4·7H2O 0.1%,MnSO4·H2O 0.05%,NaCl 0.3%,pH 7.2。
根据《常见细菌系统鉴定手册》[17]配制生理生化鉴定培养基。
1.2 方法
1.2.1 菌种初筛
称取10 g底泥样品接种至100 mL加有玻璃珠的富集培养基中,37 ℃、170 r/min摇床培养4 d,吸取10 mL富集液于90 mL无菌水中,置于80 ℃水浴锅中处理15 min。按照10倍稀释法逐级稀释,取0.1 mL梯度为10-5、10-6、10-7的稀释液分别涂于分离培养基平板,37 ℃培养至菌落生长。挑取不同形态的菌落进行多次划线分离。选择纯化的菌落转接于斜面保存。
1.2.2 菌种复筛
将分离得到的菌株接种到种子液培养基中,37 ℃、170 r/min培养24 h。按5%(V/V)接种量把菌液分别接种到氨化培养基中,相同条件下培养48 h,测定培养液中NH4+-N含量。3次重复。
1.2.3 菌种鉴定
(1)形态学观察。将菌株ZXL-7接种于牛肉膏蛋白胨固体培养基表面,37 ℃培养12 h,观察菌落形态特征,并进行革兰氏染色。
(2)生理生化试验。按照《常见细菌系统鉴定手册》进行试验。
(3)16S rDNA序列分析。通过Ezup柱式细菌基因组DNA抽提试剂盒提取菌株总基因组DNA,以通用引物27F(AGTTTGATCMTGGCTC)、1492R(GGTTACCTTGTTACGA)扩增16S rDNA。表1、2为PCR扩增反应体系、反应条件。PCR纯化产物由上海生物工程股份有限公司完成测序。测序结果通过BLAST程序与NCBI中GenBank数据库进行比对,利用软件Mega7.0(neighbor-joining法)构建系统发育树,其中Boot-strap分析重复设置为1 000。

表1 PCR扩增反应体系Table 1 PCR amplification reaction system
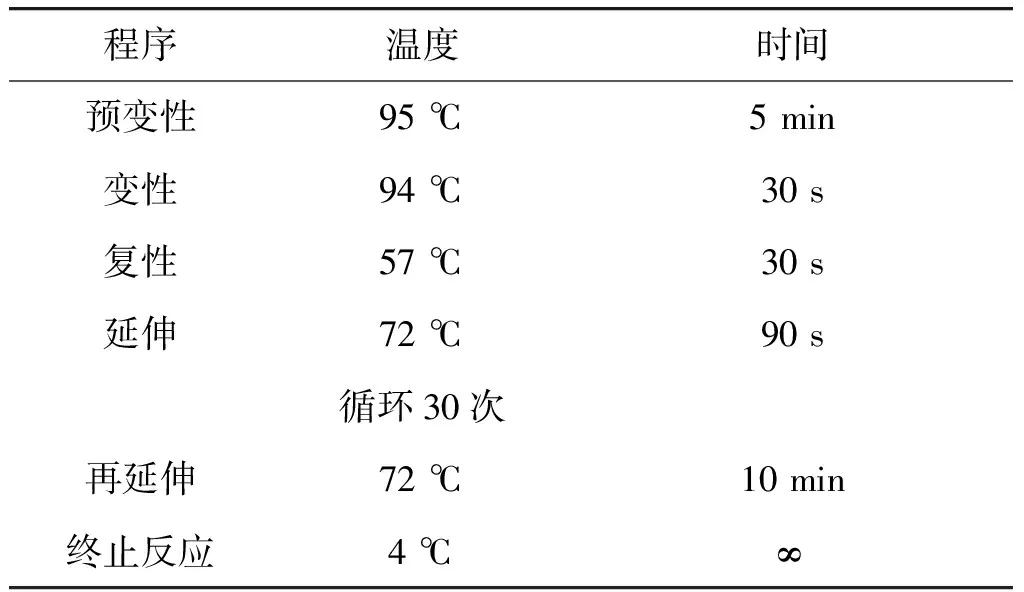
表2 PCR扩增反应条件Table 2 PCR amplification reaction conditions
1.2.4 氨化培养基研究
改变氨化培养基中碳源种类(酒石酸钾钠、乙酸钠、丁二酸钠、葡萄糖、蔗糖、淀粉、柠檬酸钠)、碳源添加量(20、25、30、35、40 g/L)、氮源种类(豆粕粉、酵母粉、酵母提取物、蛋白胨、胰蛋白胨)、KH2PO4添加量(1、1.5、2.0、2.5、3.0 g/L)、MgSO4·7H2O添加量(0.5、1、1.5、2.0、2.5 g/L)、MnSO4·H2O添加量(0、0.25、0.5、0.75、1 g/L)等研究各因素对菌株氨化效果的影响。
1.2.5 响应面优化
以单因素试验结果为依据,选择对氨化效果有显著影响的丁二酸钠(A)、KH2PO4(B)、MgSO4·7H2O(C)、MnSO4·H2O(D)为4个因素,以氨氮增加量(Y)为响应值,根据Box-Behnken中心组合试验原理,进行四因素三水平响应面优化试验。因素与水平如表3所示。
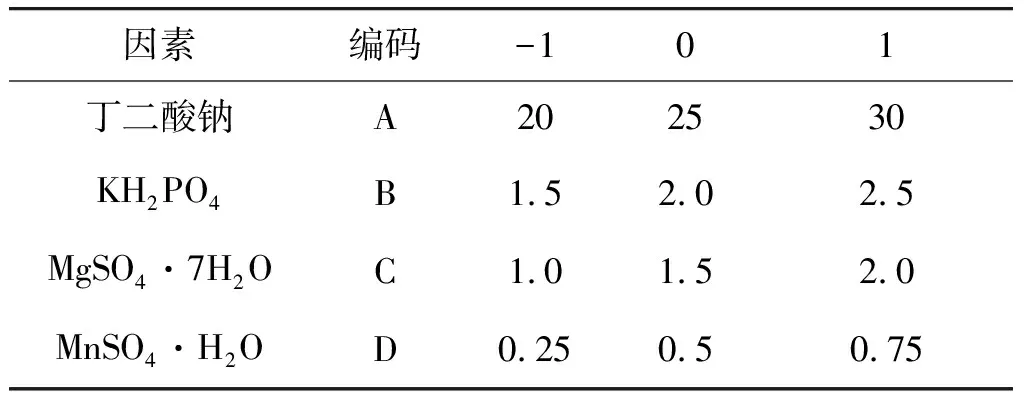
表3 响应面因素水平编码表Table 3 Level and factors design of response surface
1.3 氨氮含量测定
将培养液于4 ℃、10 000 r/min离心10 min,以未接种的氨化培养基作为空白对照,采用纳氏试剂分光光度法测定上清液中NH4+-N含量(氨氮增加量等于菌液中氨氮含量减去空白培养基中氨氮含量,单位:mg/L)。
1.4 数据处理
利用Excel、Mega7、GraphPad Prism等软件进行数据处理以及绘图,利用Design Expert软件进行模型拟合和方差分析。所有试验进行3次重复。
2 结果与分析
2.1 氨化细菌初筛和复筛结果
从精养池塘底泥中共分离出10株具有氨化作用的菌株。将菌株分别接种到氨化培养基中,于30 ℃、170 r/min摇床中培养48 h,测定培养液中NH4+-N含量,以空白培养基为对照。结果见表4。
由表4可知,不同菌株氨化能力不同,菌株ZXL-7的氨化能力最强,NH4+-N含量达到256.523 mg/L。故选择菌株ZXL-7进行后续研究。
2.2 氨化细菌ZXL-7的鉴定
2.2.1 氨化细菌ZXL-7的形态学与生理生化鉴定
菌株形态如图1所示。菌落为圆形,灰白色,不透明,表面湿润,边缘规则,无色素产生。菌体为杆状,两端钝圆,芽孢椭圆形,中生,革兰氏阳性(图2)。

表4 菌株筛选结果Table 4 The results of strain screening
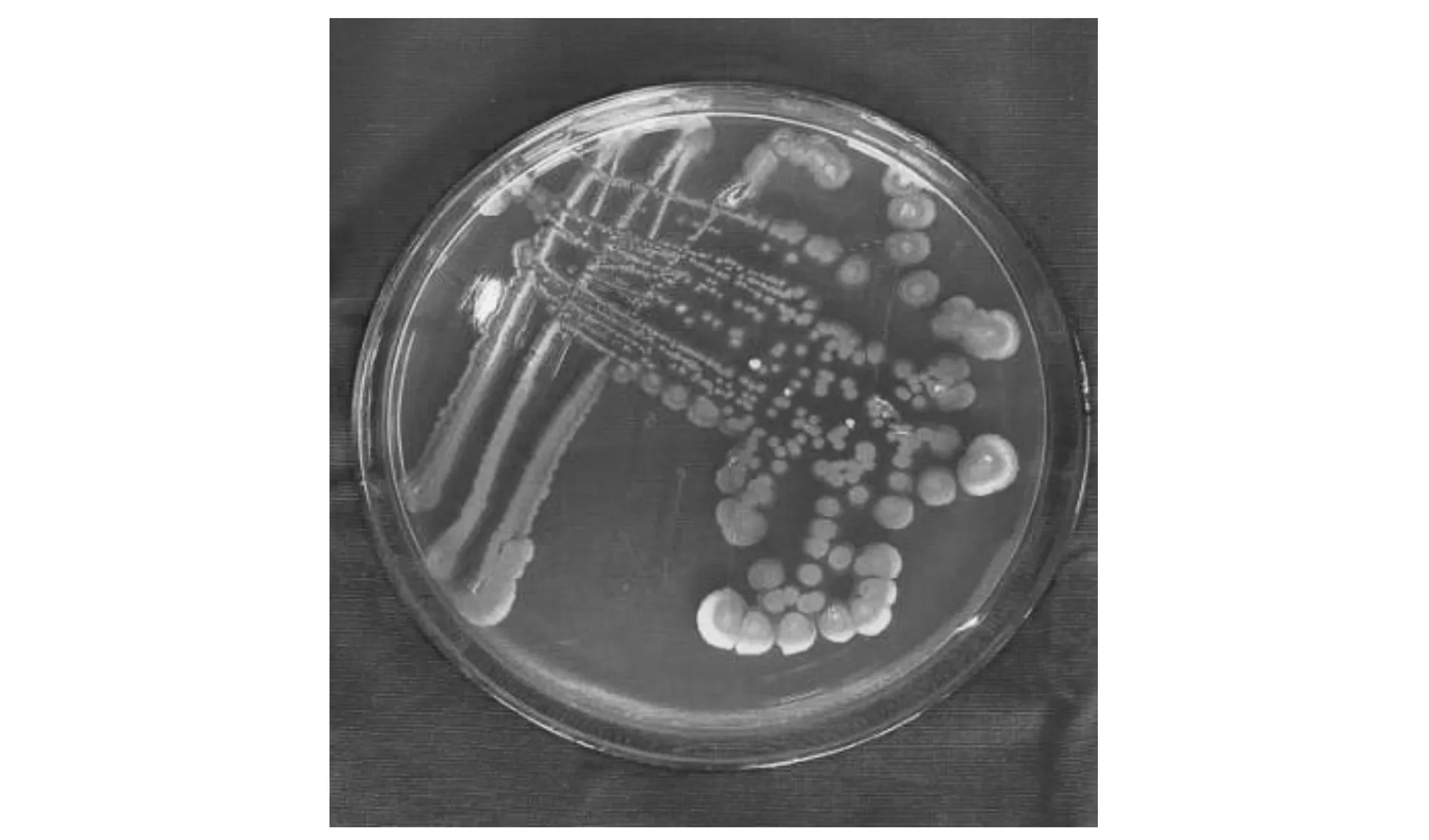
图1 菌株ZXL-7菌落形态Figure 1 Colony morphology of ZXL-7
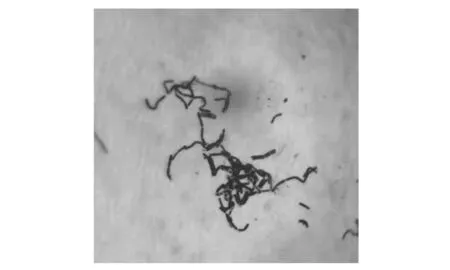
图2 菌株ZXL-7菌体及芽孢形态Figure 2 Morphology of bacteria and spores of strain ZXL-7
生理生化试验结果见表5。

表5 生理生化试验结果Table 5 Physiological and biochemical experiments results

图3 菌株ZXL-7 16S rDNA电泳图Figure 3 16S rDNA electrophoresis of strain ZXL-7
2.2.2 16S rDNA序列分析结果
菌株16S rDNA扩增序列电泳结果见图3。从图3可以看出,获得的16S rDNA片段大小为1 489 bp。将测序结果与NCBI中GenBank数据库经BLAST程序比对分析,利用软件Mega7(neighbor-joining法)构建系统发育树。结果见图4。
对比发现菌株ZXL-7与NR-117473.1:1-1488Bacillusmegateriumstrain ATCC 14581的同源性高达100%。综合形态学、生理生化鉴定和分子生物学分析结果,鉴定菌株ZXL-7为巨大芽孢杆菌(Bacillusmegaterium)。
2.3 氨化培养基优化
2.3.1 碳源种类对菌株ZXL-7氨化效果的影响
分别以3%的酒石酸钾钠、乙酸钠、丁二酸钠、蔗糖、淀粉、柠檬酸钠替代氨化培养基中的葡萄糖,于30 ℃、170 r/min条件下培养36 h,测定培养液中NH4+-N含量,以空白培养基作为对照,并计算培养基中氨氮增加量。结果如图5所示。

图4 菌株ZXL-7 16S rDNA系统发育树Figure 4 Phylogenetic tree based on 16S rDNA sequence of strain ZXL-7
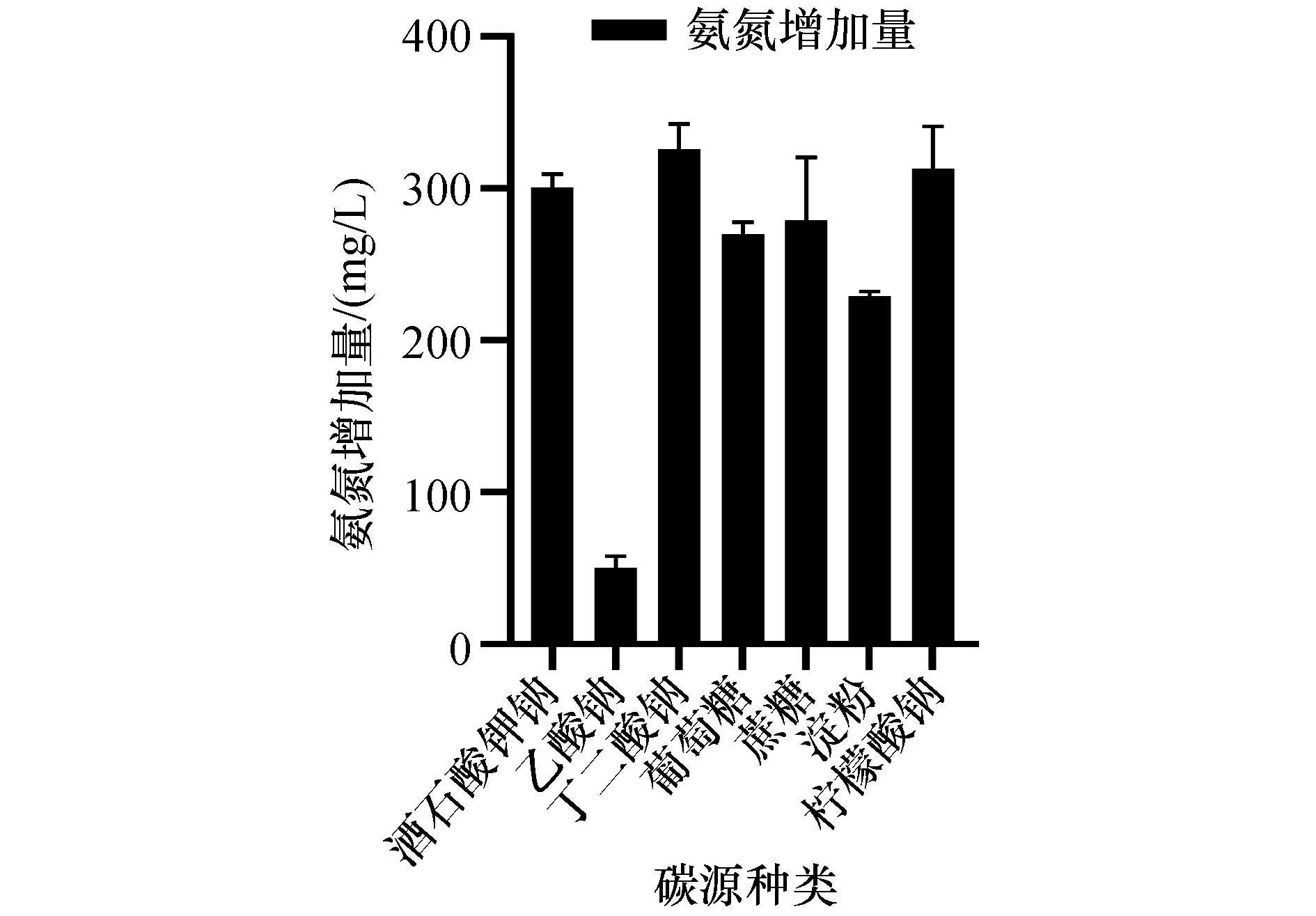
图5 碳源种类对菌株ZXL-7氨化效果的影响Figure 5 Effect of carbon sources on ammoniation of strain ZXL-7
图5结果表明,不同碳源对菌株ZXL-7的氨化能力作用差异较大。当以丁二酸钠作为碳源时,菌株ZXL-7的氨化能力最强,培养液中氨氮增加量达325.926 mg/L。故选择丁二酸钠作为碳源进行后续研究。
2.3.2 丁二酸钠添加量对菌株ZXL-7氨化效果的影响
在培养基中分别添加20、25、30、35、40 g/L的丁二酸钠,于30 ℃、170 r/min条件下培养36 h,测定培养液中NH4+-N含量,以空白培养基作为对照,并计算培养基中氨氮增加量。结果见图6,在一定范围内培养液中氨氮增加量随丁二酸钠添加量的增加而上升,当丁二酸钠添加量为25.0 g/L时,氨氮增加量最高达366.67 mg/L,但当丁二酸钠添加量继续增加时,氨氮增加量下降。

图6 丁二酸钠添加量对菌株ZXL-7氨化效果的影响Figure 6 Effect of sodium succinate addition on ammoniation effect of strain ZXL-7
2.3.3 氮源种类对菌株ZXL-7氨化效果的影响
以氨化培养基中的含氮量为基础,分别加入等氮量的豆粕粉(1.5%)、酵母粉(1.5%)、蛋白胨(0.662%)、酵母提取物(0.873%)、胰蛋白胨(0.756%),于30 ℃、170 r/min条件下培养36 h,测定培养液中NH4+-N含量,以空白培养基作为对照,并计算培养基中氨氮增加量。结果见图7。
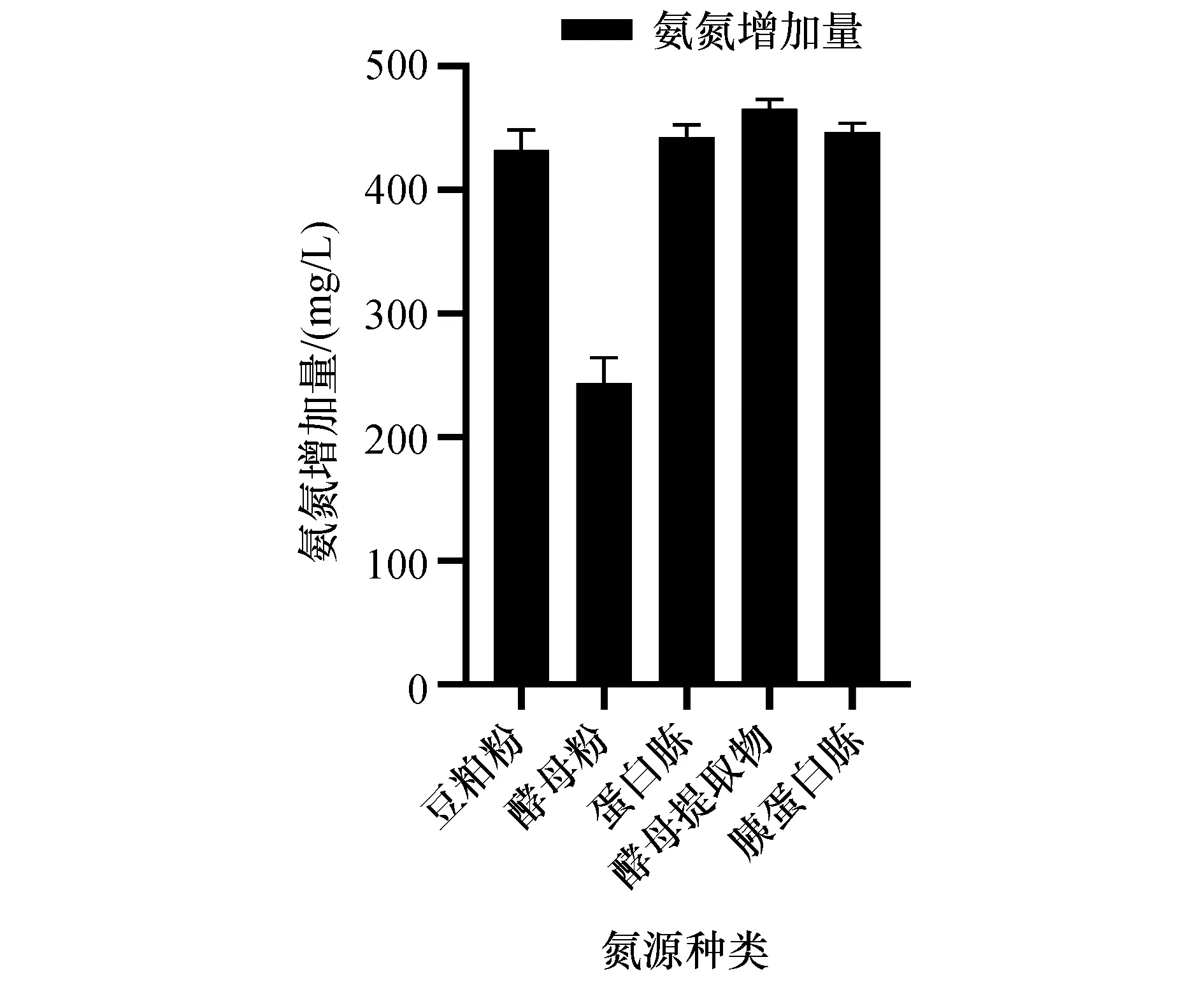
图7 氮源种类对菌株ZXL-7氨化效果的影响Figure 7 Effect of nitrogen sources on ammoniation of strain ZXL-7
从图7可以看出,以酵母粉为氮源时氨氮增加量显著低于其它氮源且差异不显著,原因可能是酵母粉是鲜酵母乳经分离洗涤、干燥后制得,其蛋白质存在于细胞内,微生物利用速度和效率较低所致。当以酵母提取物为氮源时,氨氮增加量最大,为465.74 mg/L。因此选择酵母提取物为氮源进行后续研究。
2.3.4 KH2PO4添加量对菌株ZXL-7氨化效果的影响
磷是微生物进行正常生命活动所必需的关键元素之一,是细胞中包括蛋白质、核酸等生物分子的重要组成,若培养基中缺磷,将影响微生物核酸、磷脂等生物大分子物质的合成以及正常代谢过程。图8结果表明,当KH2PO4添加量为2.00 g/L时,培养液中氨氮增加量最大,为498.61 mg/L,但KH2PO4添加量继续增加,氨氮增加量下降。故选择KH2PO4添加量为2.00 g/L进行后续研究。

图8 KH2PO4添加量对菌株ZXL-7氨化效果的影响Figure 8 Effect of KH2PO4 addition on ammoniation of strain ZXL-7
2.3.5 MgSO4·7H2O添加量对菌株ZXL-7氨化效果的影响
镁离子是微生物细胞中多种关键调控酶的活性中心组分,参与多种酶促反应并维持细胞结构的稳定性。从图9可以看出,氨氮增加量呈先升后降的趋势。当MgSO4·7H2O添加量为1.50 g/L时,氨氮增加量达到509.72 mg/L,但MgSO4·7H2O添加量继续增加,氨氮增加量下降。原因是培养基中Mg2+浓度太高,对微生物细胞产生毒性。因此,选择MgSO4·7H2O添加量为1.50 g/L进行后续研究。

图9 MgSO4·7H2O添加量对菌株ZXL-7氨化效果的影响Figure 9 Effect of MgSO4·7H2O addition on ammoniation of strain ZXL-7
2.3.6 MnSO4·H2O添加量对菌株ZXL-7氨化效果的影响
锰本身不构成微生物细胞组分,但参与超氧化物歧化酶、柠檬酸合成酶等酶的组成,并对芽孢的形成具有一定的促进作用。图10结果表明,氨氮增加量在0.50 g/L MnSO4·H2O添加量下有最大值512.96 mg/L,但MnSO4·H2O添加量超过0.50 g/L时,氨氮增加量呈下降趋势。
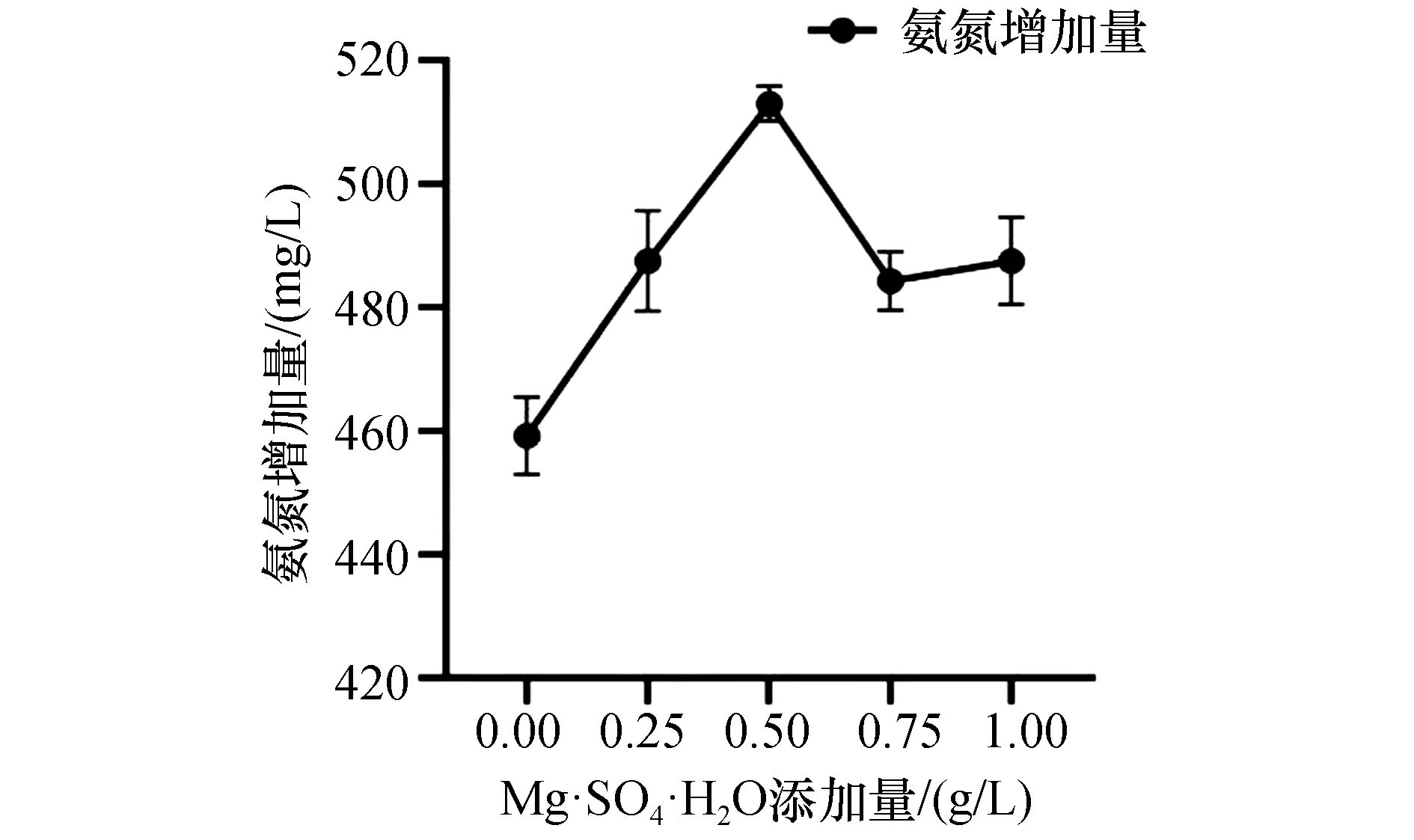
图10 MnSO4·H2O添加量对菌株ZXL-7氨化效果的影响Figure 10 Effect of MnSO4·7H2O addition on ammoniation of strain ZXL-7
2.4 响应面优化试验结果
试验结果见表6。
通过Design Expert12.0.3.0软件进行方程拟合与显著性分析,得到了氨氮增加量的二次多元回归方程:
Y=574.31+44.28A+27.61B+35.95C-27.53D-
20.50AB-11.09AC-27.19AD-44.26BC-
7.56BD+9.39CD-45.93A2-59.74B2-
57.31C2-38.04D2
对回归方程进行方差分析,结果见表7。
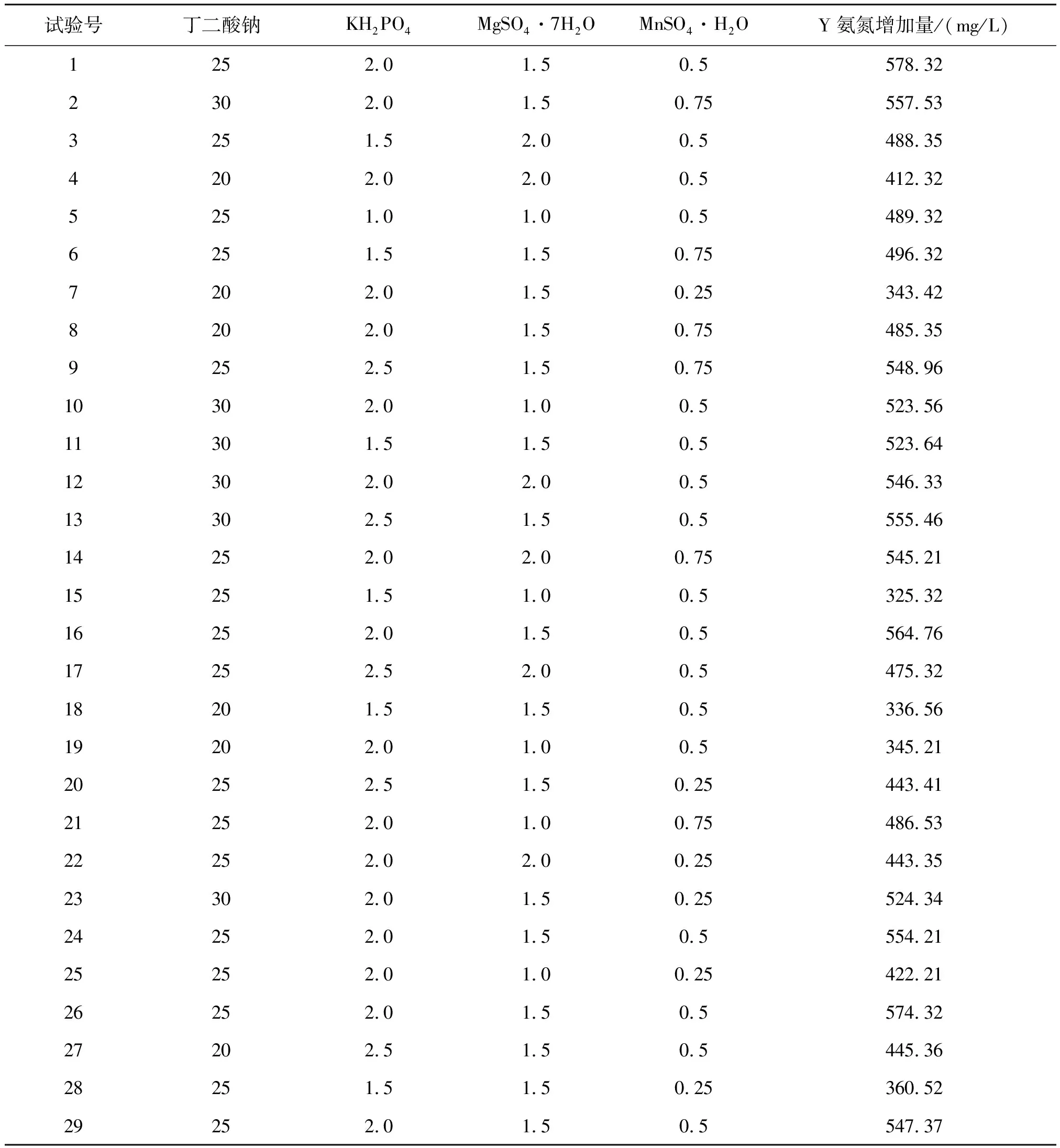
表6 Box-Behnken试验设计及结果Table 6 Design and results of Box-Behnken tests
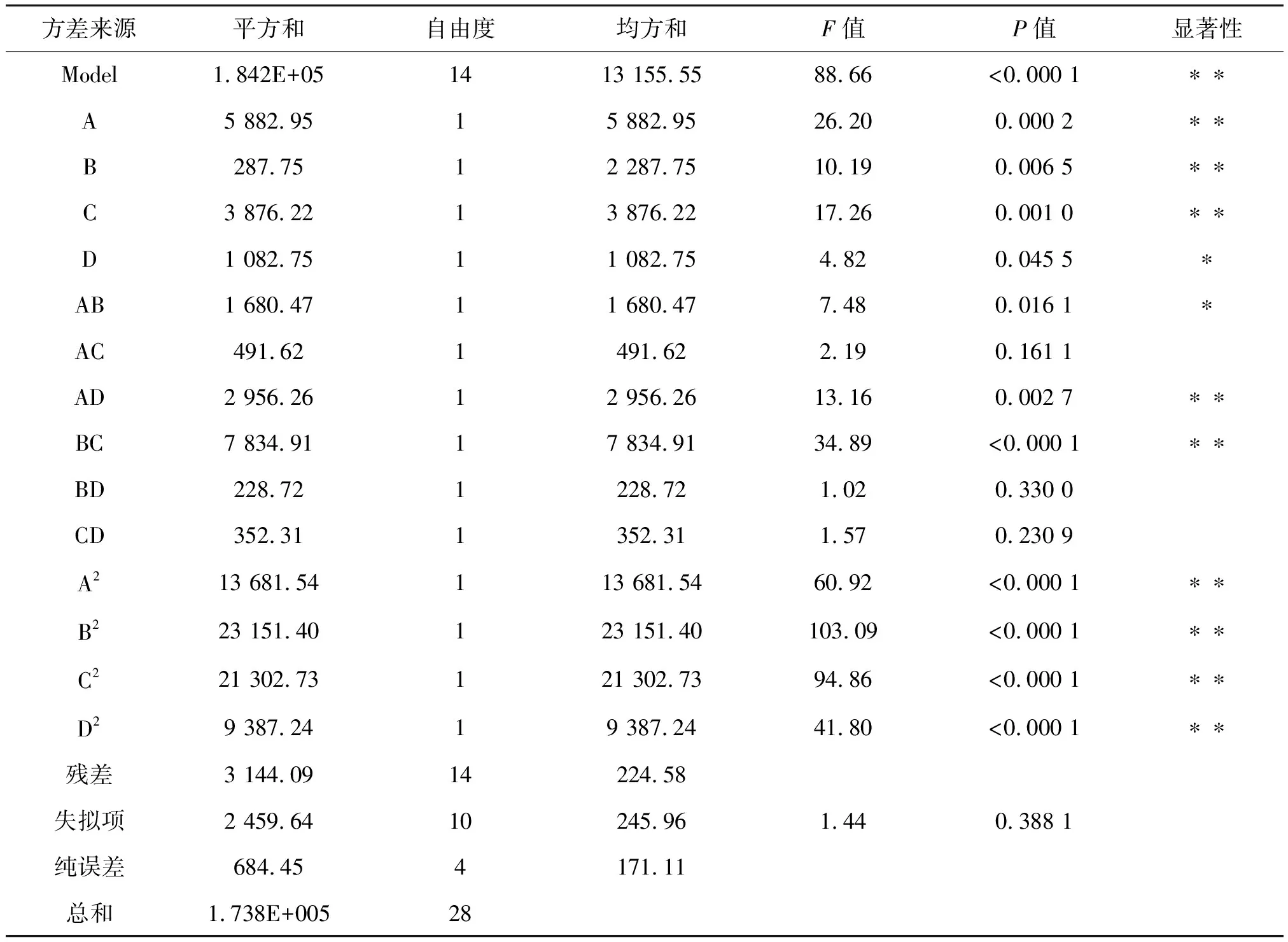
表7 回归方程方差分析Table 7 Analysis of regression model
由表7可知,模型P<0.000 1为极显著,失拟项P=0.388 1>0.05,失拟度不显著,说明模型可行;相关系数R2=0.981 9,表示本实验响应值氨氮增加量同各因素之间相关性良好;校正决定系数R2=0.963 8,变异系数C.V.%=3.12,说明该模型有良好的重现性,变异程度低。结合表中P值可知,丁二酸钠(A)、KH2PO4(B)、MgSO4·7H2O(C)、丁二酸钠和MnSO4·H2O的交互项(AD)、KH2PO4和MgSO4·7H2O的交互项(BC)以及丁二酸钠的二次项(A2)、KH2PO4的二次项(B2)、MgSO4·7H2O的二次项(C2)、MnSO4·H2O的二次项(D2)为极显著水平(P<0.01),MnSO4·H2O(D)、丁二酸钠和KH2PO4的交互项(AB)为显著水平(P<0.05),其它因素影响较小。
通过Design Expert12.0.3.0软件对氨氮增加量的回归方程进行分析,丁二酸钠、KH2PO4、MgSO4·7H2O、MnSO4·H2O各因素交互作用的响应面见图11。
从图11可以看出,丁二酸钠和MnSO4·H2O、KH2PO4和MgSO4·7H2O之间的交互作用极显著(P<0.01),丁二酸钠和KH2PO4的交互作用显著(P<0.05),而丁二酸钠和MgSO4·7H2O、KH2PO4和MnSO4·H2O、MgSO4·7H2O和MnSO4·H2O之间的交互作用均不显著。
根据模型可以得出适宜的优化培养基组成为:丁二酸钠添加量为28.04 g/L,KH2PO4添加量为2.05 g/L,MgSO4·7H2O添加量为1.58 g/L,MnSO4·H2O添加量为0.61 g/L,此时氨氮增加量理论产量为600.005 mg/L。将优化所得培养基组成进行三次重复试验验证,得到氨氮增加量分别为590.556、583.661、598.889 mg/L,平均值为591.035 mg/L,与预测值相差1.49%。说明该回归模型可以用来优化菌株ZXL-7氨化培养基组成,并且具有一定的准确性。
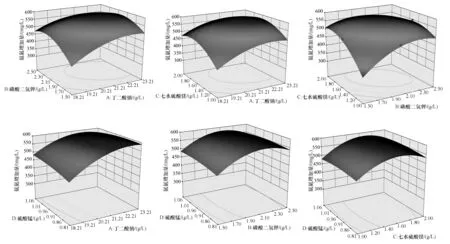
图11 各因素交互作用的响应面图Figure 11 Response surface diagram of interaction of various factors
3 讨论
本研究以蛋白胨为唯一氮源及高温处理法从精养池塘底泥中分离得到10株具有氨化能力的芽孢杆菌,根据细菌经典鉴定法并结合现代分子生物学手段,菌株ZXL-7鉴定为巨大芽孢杆菌(Bacillusmegaterium)。王娟[18]、侯颖[19]分别从南美白对虾养殖池、养鱼池水中分离筛选到氨化性能较高的巨大芽孢杆菌(Bacill-us megaterium),并研究了其对有机氮的降解效果。
目前研究表明,细菌、放线菌、霉菌和酵母菌等均具有降解有机氮的能力,但不同菌种对有机氮的降解能力不同。残饵是养殖水体中营养成分的主要来源,同时也是水体的主要污染物[20]。水体中的碳源、氮源等直接影响外源益生菌对水体的修复作用[21-23]。本研究表明,在以丁二酸钠为碳源、酵母提取物为氮源的条件下,菌株ZXL-7具有较强有机氮的降解能力,说明碳氮源种类和含量影响养殖水体中有机氮向氨氮的转化,进而影响养殖水体中氮素的去除。磷元素、亚铁等金属离子均可影响微生物的脱氮能力[24-26]。当环境中缺乏磷时,可降低糖类代谢速度,并可延迟生物滤池的启动时间[27]。矿质元素虽不参与细胞骨架的组成,但对酶的激活有重要作用。在培养基中添加适量浓度的磷酸盐、Mg2+等均可提高菌株ZXL-7对有机氮的降解能力。本试验筛选得到的巨大芽孢杆菌ZXL-7能有效降低养殖水体中有机氮的含量,并可应用于养殖水体氮污染物的去除,但对有机氮的降解条件和机理、安全性以及使用方法等还有待进一步研究。
4 结论
本试验采用平板分离法从精养池塘底泥中筛选得到1株高效氨化芽孢杆菌ZXL-7。通过经典鉴定法并结合现代分子生物学手段菌株ZXL-7鉴定为巨大芽孢杆菌(Bacillusmegaterium)。以单因素试验结果为依据,利用响应面法进行优化,最终确定了巨大芽孢杆菌ZXL-7适宜的氨化培养基组成为:丁二酸钠28.04 g/L,KH2PO42.05 g/L,MgSO4·7H2O 1.58 g/L,MnSO4·H2O 0.61 g/L,酵母提取物8.73 g/L,NaCl 3 g/L,此条件下,氨氮增加量达591.035 mg/L。说明本研究筛选的菌株可以用于养殖水体有机氮的降解,具有潜在的应用价值。
