白术多糖通过TLR4信号通路对结肠癌CT26荷瘤小鼠肿瘤生长及免疫调节的影响
2022-01-27冯子芳杨瑞宾
冯子芳, 杨瑞宾
(兴义市人民医院医学检验科,贵州 兴义 562400)
结肠癌是一种全球范围内发病率较高,发展极为迅速的恶性肿瘤之一。根据2000至2014年全球癌症生存趋势监测计划(CONCORD计划)第三阶段的调查数据[1]显示,我国结肠癌发病率高居所有癌症第3位,其5年生存率仅有 57.6%,远低于韩国、日本等亚洲其他国家。机体免疫系统在调节肿瘤免疫应答,改变肿瘤微环境中发挥重要作用,但大多数肿瘤细胞因机体免疫功能低下而逃逸免疫监控,最终表现出“免疫逃逸”的现象,这也是导致放化疗后肿瘤复发的主要原因[2]。因此,增强机体免疫功能将有助于提高机体的抗肿瘤效果。随着中医药临床价值逐渐被世界认可,传统中药因其显著的药理作用,在现代医学研究中备受关注。白术多糖是中药白术的主要药效成分之一,其具有抗氧化、保肝、抗炎、抗过敏、抗血栓、抗病毒、抗癌等多种药理作用[3]。并且有研究显示[4-5],白术多糖具有显著的免疫调节作用,能提高机体免疫功能。然而,白术多糖是否通过调控机体免疫功能而发挥抗肿瘤作用,目前鲜有报道。本研究采用结肠癌CT26细胞荷瘤小鼠模型,探讨白术多糖干预对荷瘤小鼠肿瘤生长、免疫调节的影响及其可能机制,以期为白术多糖的临床应用提供更多的药效研究基础。
1 材料与方法
1.1 细胞株与动物 小鼠结肠癌CT26细胞购自中国科学院上海生命科学研究院细胞资源中心。无特定病原体(Specific pathogen free,SPF)级雌性BALB/c小鼠30 只,6~8周龄,体质量18~22 g,购自长沙市天勤生物技术有限公司,动物生产许可证号SCXK(湘)2014-0011。在温度22~24 ℃,相对湿度40%~70%,通风良好,昼夜12 h光照条件下自由饲养。
1.2 试剂与药物 白术多糖(纯度≥98%,批号CY181005)及香菇多糖(纯度≥98%,批号CY181203)均购自陕西慈缘生物技术有限公司。小鼠肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α;批号190201)ELISA试剂盒、小鼠白介素-2(Interleukin-2,IL-2;批号190111)ELISA试剂盒均购自武汉伊莱瑞特生物科技股份有限公司;别藻蓝蛋白(Allophycocyanin,APC)标记的CD3e抗体(批号561042)、藻红蛋白(Phycoerythrin,PE)标记的CD4抗体(批号553653)、PE-CD8a抗体(批号553032)、异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)标记的CD11b抗体(批号557396)和PE标记的淋巴细胞抗原6复合物G位点(Ly-6G/Gr-1)抗体(批号561104)均购自美国BD公司;兔抗小鼠Toll样受体4(Toll-like receptor,TLR4)单克隆抗体(批号14358)、兔抗人髓样分化因子88(Myeloid differentiation factor 88,MyD88)单克隆抗体(批号4283)、兔抗人核因子-κB(Nuclear factor kappa-B,NF-κB p65)单克隆抗体(批号8242)和兔抗人GAPDH单克隆抗体(批号5174)购自美国Cell Signaling Technology公司;小鼠抗人TNF受体相关因子6(TNF receptor associated factor 6,TRAF6)单克隆抗体(批号sc-8409)购自美国Santa Cruz Biotechnology公司。
1.3 方法
1.3.1 建模及分组 取对数生长期的小鼠结肠癌CT26细胞,调整细胞密度至1×107/mL,接种于小鼠右前肢背部皮下,每只小鼠接种0.2 mL细胞悬液。待接种7 d左右,接种处可见平均直径约5 mm肿瘤时视为造模成功[6]。选择肿瘤体积无差异的荷瘤小鼠随机分为5组,每组6只,即模型组,给予等量生理盐水灌胃处理;阳性对照香菇多糖组,150 mg/kg香菇多糖灌胃处理;白术多糖低剂量组,125 mg/kg白术多糖灌胃处理;白术多糖中剂量组,250 mg/kg白术多糖灌胃处理;白术多糖高剂量组,500 mg/kg白术多糖灌胃处理;另选取6只正常的BALB/c小鼠作为空白对照组,给予等量生理盐水灌胃处理,每天1次,给药周期为21 d。给药期间,每4 d用游标卡尺测量一次肿瘤长径(a)和短径(b),按照V=ab2/2计算肿瘤体积并绘制肿瘤生长曲线。
1.3.2 免疫器官指数及抑瘤率测定 末次给药24 h后,断颈处死小鼠,称定体质量,在无菌条件下剥离肿瘤、脾、胸腺等组织,称定质量,按照以下公式计算抑瘤率、胸腺指数和脾脏指数[7]:抑瘤率=[(模型组平均瘤重-给药组平均瘤重)/模型组平均瘤重]×100%、胸腺(脾)指数=胸腺(脾)质量/小鼠体质量。
1.3.3 ELISA法检测小鼠血清TNF-α及IL-2表达 采用摘眼球取血法收集各组小鼠外周血,3 000 r/min离心10 min,分离血清,按照试剂盒说明书操作,使用酶标仪测定450 nm处吸光度,并按照说明书提供的公式计算血清TNF-α及IL-2水平。
1.3.4 流式细胞仪检测小鼠外周血T淋巴细胞亚群 取各组小鼠外周血,加入红细胞裂解液,600 r/min离心5 min,弃上清。PBS重悬细胞,加入APC-CD3e、PE-CD4和PE-CD8a抗体,室温避光孵育15 min,PBS洗涤2次后重悬细胞,流式细胞仪上机检测。以CD3e+CD4+双阳性细胞亚群百分比表示CD4+T细胞所占比例,以CD3e+CD8+双阳性细胞亚群表示CD8+T细胞所占比例,并计算CD4+/CD8+比值。
1.3.5 流式细胞仪检测肿瘤组织髓来源的抑制性细胞(Myeloid derived suppressor cells,MDSCs)水平 取各组小鼠新鲜肿瘤组织,制备成单细胞悬液,加入FITC-CD11b和PE-Gr-1抗体,室温避光孵育15 min,PBS洗涤2次后重悬细胞,流式细胞仪上机检测。以Gr-1+CD11b+双阳性细胞亚群百分比代表MDSC细胞所占比例。
1.3.6 Western blot检测脾脏组织中TLR4信号通路相关蛋白表达水平 取约20 mg各组小鼠脾脏组织,加入组织裂解液充分裂解,12 000 r/min、4 ℃离心20 min,取上清,采用BCA法进行蛋白定量。取20 μg蛋白进行SDS-PAGE凝胶电泳,分离蛋白并转移至PVDF膜上,5%脱脂牛奶室温封闭1 h,PBS洗涤3次,分别加入TLR4抗体(1∶1 000)、MyD88抗体(1∶1 000)、NF-κB p65抗体(1∶1 000)、TRAF6抗体(1∶500)和GAPDH抗体(1∶1 000),4 ℃孵育过夜。第2天,PBS洗涤3次,加入HRP标记的山羊抗兔或小鼠IgG(1∶10 000)室温孵育30 min,PBS洗涤3次,滴加ECL化学发光液,避光孵育1 min,显影。相对蛋白表达量以目的蛋白光密度值/内参蛋白光密度值表示。

2 结果
2.1 白术多糖对CT26荷瘤小鼠肿瘤生长的影响 各组小鼠肿瘤生长曲线如图1A所示,与模型组比较,白术多糖中、高剂量组以及香菇多糖组小鼠肿瘤生长速度相对缓慢;从接种第20天起,白术多糖高剂量组和香菇多糖组小鼠肿瘤体积均小于模型组(P<0.05);从接种第24天起,白术多糖中剂量组小鼠肿瘤体积均小于模型组(P<0.05)。CT26细胞接种28 d后,各组小鼠肿瘤如图1B所示,结果如表1所示,可知白术多糖中、高剂量组以及香菇多糖组小鼠瘤质量均小于模型组(P<0.05)。

表1 各组CT26荷瘤小鼠瘤重及抑瘤率比较
2.2 白术多糖对CT26荷瘤小鼠免疫器官指数的影响 与空白对照组比较,模型组小鼠脾脏指数和胸腺指数均降低(P<0.05);与模型组比较,白术多糖中、高剂量组以及香菇多糖组小鼠脾脏指数和胸腺指数均增加(P<0.05),但白术多糖低剂量组无显著性差异(P>0.05),如表2所示。

注:A为各组CT26荷瘤小鼠肿瘤生长曲线,B为接种CT26细胞28 d后各组荷瘤小鼠肿瘤实物图。相同时间点与模型组比较,*P<0.05,**P<0.01。图1 白术多糖抑制CT26荷瘤小鼠肿瘤生长
2.3 白术多糖对CT26荷瘤小鼠外周血T淋巴细胞亚群及肿瘤组织中MDSCs细胞水平的影响 与空白对照组比较,模型组小鼠外周血CD4+T细胞比例以及CD4+T/CD8+T比值降低(P<0.05),而CD8+T细胞比例升高(P<0.05);与模型组比较,白术多糖中、高剂量组以及香菇多糖组小鼠外周血CD4+T细胞比例以及CD4+T/CD8+T比值升高(P<0.05),而CD8+T细胞比例以及肿瘤组织中MDSCs细胞比例降低(P<0.05)。同时,白术多糖低剂量组与模型组比较以上指标均无显著性差异(P>0.05)。如表3所示。
2.4 白术多糖对CT26荷瘤小鼠血清TNF-α、IL-2水平的影响 与空白对照组比较,模型组小鼠血清TNF-α、IL-2水平降低(P<0.05);与模型组比较,白术多糖中、高剂量组以及香菇多糖组小鼠血清中TNF-α、IL-2水平增加(P<0.05),而白术多糖低剂量组两者水平无显著性差异(P>0.05)。如表4所示。

表2 各组CT26荷瘤小鼠脾脏和胸腺指数比较

表3 各组CT26荷瘤小鼠外周血CD4+T、CD8+T细胞及肿瘤组织中MDSCs水平比较

表4 各组CT26荷瘤小鼠血清TNF-α及IL-2水平比较
2.5 白术多糖对CT26荷瘤小鼠脾脏中TLR4信号通路相关蛋白表达的影响 如图2所示,与空白对照组比较,模型组小鼠脾脏组织中TLR4、MyD88、TRAF-6以及NF-κB p65等蛋白表达均降低(P<0.05);与模型组比较,白术多糖中、高剂量组荷瘤小鼠脾脏组织中TLR4、MyD88、TRAF-6以及NF-κB p65等蛋白表达均升高(P<0.05),而香菇多糖组、白术多糖低剂量组上述蛋白表达无明显变化(P>0.05)。
3 讨论
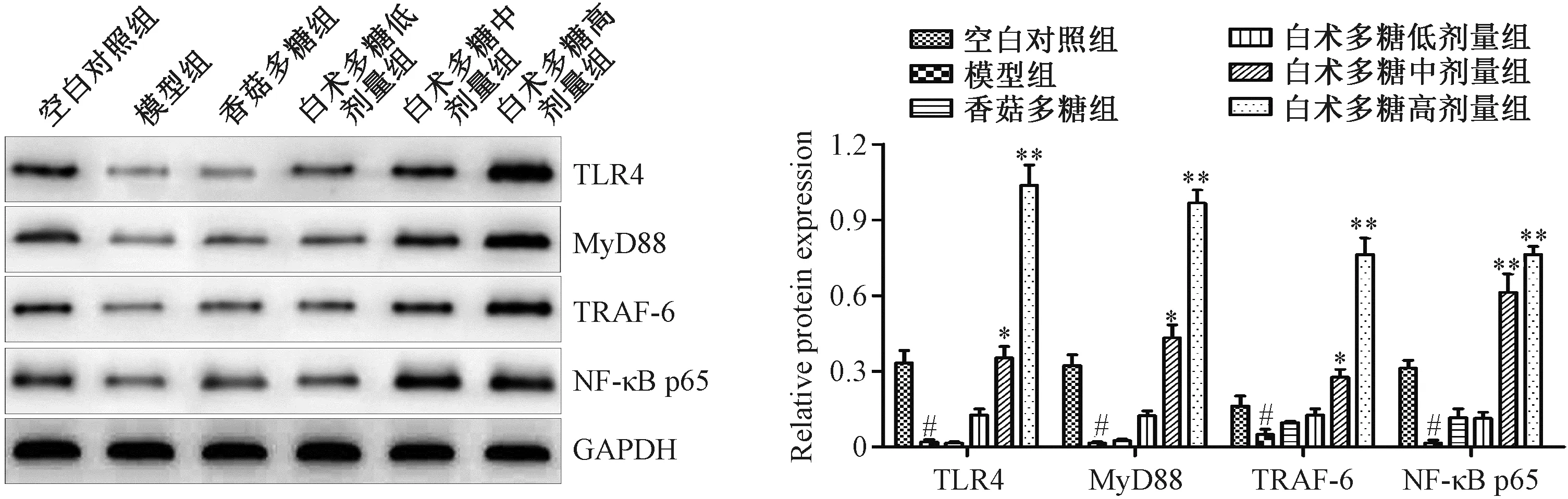
注:与空白对照组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01。图2 各组CT26荷瘤小鼠脾脏中TLR4信号通路相关蛋白表达
白术多糖是从白术根茎中提取的多糖类物质,其主要包含甘露聚糖、果聚糖等成分,其最为显著的药理作用是促免疫作用。例如,Ji等[8]研究发现,白术多糖可以通过激活NF-κB信号通路,促进炎症因子TNF-α、IFN-γ以及NO的释放,进而活化RAW264.7巨噬细胞。Kim等[5]研究显示,白术多糖作为一种佐剂,可以显著增加IgG滴度,促进抗原特异性淋巴细胞增殖,从而增强胸膜肺炎放线杆菌感染小鼠机体的细胞免疫和体液免疫反应。随着人们对白术多糖药理研究的进一步深入,发现白术多糖还具有抗肿瘤的作用,例如,Feng等[9]研究报道称,白术多糖通过引起细胞周期S期阻滞,诱导肝癌H22细胞凋亡,并抑制H22细胞移植瘤的生长。然而,白术多糖是否通过调节机体免疫功能发挥抗肿瘤作用目前还鲜有报道。本研究结果显示,白术多糖可以抑制CT26荷瘤小鼠肿瘤的生长,其在250、500 mg/kg剂量下的抑瘤率分别达到40.85%和65.11%。同时,白术多糖可以通过活化TLR4信号通路,促进炎症因子TNF-α及IL-2释放,提高CD4+/CD8+比值,降低肿瘤组织中MDSCs水平。因此,白术多糖有可能通过调节机体免疫功能发挥抗肿瘤作用。
众所周知,恶性肿瘤的发生、发展过程中常伴随着机体免疫功能的降低,甚至逃逸机体免疫系统的监控。胸腺和脾脏是机体重要的免疫器官,然而肿瘤的发生可引起机体免疫器官的萎缩[10],胸腺指数和脾脏指数的高低在一定程度上可以反应机体免疫功能的强弱。本研究结果表明,中、高剂量白术多糖干预可以提高CT26荷瘤小鼠脾脏指数和胸腺指数,说明白术多糖可以增强荷瘤小鼠的免疫功能。在机体免疫系统调节中,T淋巴细胞发挥重要作用,其中辅助/诱导T淋巴细胞(CD3+CD4+)主要分泌TNF-α、IL-2等细胞因子,刺激或增强细胞、体液免疫应答;而抑制细胞毒T淋巴细胞(CD3+CD8+)主要通过分泌抑制因子抑制细胞毒性T淋巴细胞和B淋巴细胞活化,起负调控作用。临床研究数据显示[11],肿瘤患者常出现CD3+CD4+细胞亚群明显减少,CD3+CD8+细胞亚群明显升高,以及CD4+/CD8+比值明显降低的现象。本研究结果显示,中、高剂量白术多糖干预可提高荷瘤小鼠血液中CD3+CD4+细胞亚群比例,降低CD3+CD8+细胞亚群比例,从而提高CD4+/CD8+比值。与此同时,中、高剂量白术多糖干预还可促进荷瘤小鼠血清TNF-α、IL-2等细胞因子的分泌,进一步激活机体免疫功能。此外,MDSC是一种重要的免疫抑制细胞,肿瘤组织中存在大量的MDSCs,其可以通过多种途径抑制T细胞的活化,并对肿瘤细胞适应性生长起到促进作用[12]。本研究结果显示,中、高剂量白术多糖干预可以降低荷瘤小鼠肿瘤组织中MDSC细胞水平。说明,白术多糖可能通过降低MDSCs水平,减少其对T细胞的影响,并通过分泌TNF-α、IL-2等细胞因子刺激T细胞的活化,以达到提高机体免疫力的功效,从而发挥抗肿瘤的作用。
Toll样受体(Toll-like receptors,TLRs)是一类天然免疫模式识别受体,常表达于免疫细胞表面,能够激活机体天然免疫和适应性免疫应答[13]。TLRs信号通路主要由MyD88依赖途径和MyD88非依赖途径组成,而TRAF-6是这两条途径的交叉点,继而激活NF-κB途径,诱导促炎因子的释放,最终促进淋巴细胞的增殖及活化。本研究结果显示,中、高剂量白术多糖可上调荷瘤小鼠脾脏组织中TLR4、MyD88、TRAF-6以及NF-κB p65等蛋白表达,表明白术多糖能够激活TLR4信号通路。提示,白术多糖发挥促免疫作用有可能是通过激活TLR4信号通路实现的。钱隆等[14]研究结果也显示,白术多糖能够激活TLR4信号通路,发挥增强免疫的作用。此外,作为阳性对照香菇多糖对TLR4信号通路相关蛋白表达无显著影响,可能是由于香菇多糖发挥免疫调节抗肿瘤作用的机制不是通过该信号通路实现的。
综上所述,本研究证实白术多糖具有调节结肠癌CT26荷瘤小鼠免疫功能及抑制荷瘤小鼠肿瘤生长的作用,其作用机制可能与TLR4信号通路激活有关。然而,由于白术多糖具有多种药理作用,在本研究中其是否还通过其他途径发挥抗肿瘤作用?还需进一步深入研究。
