竹节参总皂苷通过调节miR-181a/PPARα通路改善非酒精性脂肪性肝病的作用
2022-01-27刘小慧魏承亮刘朝奇贺海波蔡三金
罗 悦, 刘小慧, 魏承亮, 段 丽, 刘朝奇, 贺海波, 蔡三金*
(1.三峡大学医学院,湖北 宜昌 443002;2.三峡大学生物与制药学院,湖北 宜昌 443002)
随着生活方式的改变,非酒精性脂肪性肝病(NAFLD)全球发病率高达25%,为肝细胞癌的主要病因之一[1-2]。“多重打击”假说指出,肝细胞脂质过度积累和肝细胞炎症环境是导致肝细胞损伤、激活肝细胞死亡、促进星状细胞活化、纤维基质沉积的重要因素[3-4]。
miRNA是一类长度约为22个核苷酸的非编码单链RNA分子,可以通过靶向mRNA并抑制其翻译或促进其降解在转录后水平调节基因表达。有研究指出,miR-181a在NAFLD患者、高脂饮食小鼠及ob/ob小鼠的血液和肝脏中高度表达,并在NAFLD中作用显著[5]。
过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor α,PPARα)是一种配体诱导的转录因子,在能量代谢、肝功能、炎症、细胞周期改变和啮齿动物肝癌发生中起关键作用[6]。有研究报道,敲除肝细胞特异性PPARα基因导致小鼠肝脏和全身脂肪酸动态平衡受损,可见PPARα与NAFLD发展密切相关[7]。
目前,临床上仍缺乏针对治疗NAFLD的公认药物[8]。竹节参PanaxjaponicusC.A.Meyer是五加科人参属多年生草本植物,具有散瘀止血、消肿止痛、止咳祛痰、补虚强壮的功效,竹节参总皂苷是其主要活性成分[9],具有减轻肠道炎症反应、改善小鼠脂肪性肝病作用[10-11]。本研究利用高脂饮食建立NAFLD小鼠,并使用不同剂量竹节参总皂苷干预,为相关防治提供新的思路。
1 材料
1.1 动物 SPF级雄性BALB/c小鼠40只,饲养于三峡大学实验动物中心[动物生产许可证号SCXK(鄂) 2017-0012]。所有操作都遵循伦理委员会相关动物使用和保护规定,伦理审查表编号2013090B。
1.2 试剂及药物 竹节参购于恩施竹节参种植基地,经湖北省天然产物研究与开发重点实验室汪鋆植教授鉴定为正品。竹节参总皂苷采用醇提法提取,大孔树脂吸附法纯化[12]。丙氨酸氨基转移酶(ALT)试剂盒、甘油三酯(TG)试剂盒均购于中生北控生物科技有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser(Prefect Real Time)(日本TaKaRa公司,货号RR047A);Green Taq Mix(南京诺唯赞生物科技有限公司,P131-03);抗体TLR4(美国Santa Cruz公司,货号SC-293072)、p-STAT1(美国Cell Signaling公司,货号8826)、β-actin(美国Cell Signaling公司,货号4970L)。引物由生工生物工程(上海)股份有限公司合成。其余试剂均为分析纯。
1.3 仪器 PowerPas Basic电泳仪(美国Bio-Rad公司);核酸蛋白分析仪(美国Beckman公司); Gene Genius凝胶分析系统(英国Syngene公司);Step One Plus 实时定量PCR仪(美国Applied Biosystem公司);梯度PCR仪(美国Applied Biosystem公司);Gel Logic-200凝胶成像分析系统(美国Kodak公司);全波长酶标仪(美国 Thermo公司)。
2 方法
2.1 分组及给药 将小鼠随机分为正常饮食组、模型组、竹节参总皂苷低剂量组、竹节参总皂苷高剂量组,除正常饮食组外(标准饲料喂养)其他3组给予华阜康公司高脂饲料(H10060)喂养,同时竹节参总皂苷组灌胃不同剂量药物(15、45 mg/kg,溶于生理盐水),正常饮食组予等量的生理盐水灌胃,饲养19周,每2 d记录1次体质量。
2.2 标本采集 将喂养19周后的小鼠称定质量,腹腔注射10%水合氯醛麻醉,取血,血液静置于37 ℃下1 h,3 000 r/min离心10 min,收集血清。小鼠脱颈椎处死,切取肝脏,生理盐水冲洗并称质量,切取肝大叶中部长度、厚度适中部分置于包埋夹中,多聚甲醛固定,剩余新鲜肝脏组织置于1.5 mL离心管中,在-80 ℃下保存。
2.3 小鼠血清ALT活性检测 新鲜小鼠血清使用多功能酶标仪检测ALT活性,具体方法参照试剂盒说明书。
2.4 小鼠肝脏组织TG水平检测 称取小鼠新鲜肝脏50 mg,浸于1 mL无水乙醇,置于1.5 mL离心管中,充分研磨后室温抽提24 h,5 000 r/min离心5 min,收集上层澄清抽提液,使用多功能酶标仪检测TG水平。
2.5 小鼠肝脏组织HE染色 小鼠肝组织固定完成后修整大小,乙醇梯度脱水,石蜡包埋,切片(厚度4 μm),常规HE染色,在显微镜下观察。
2.6 RT-PCR与RT-qPCR检测SREBP-1c、ChREBP、IL-1β、TNFα、miR-181a、PPARαmRNA表达 称取小鼠新鲜肝脏50 mg至1.5 mL EP管中,使用Trizol充分裂解并提取总RNA,电泳检测RNA完整性,逆转录试剂盒逆转获得cDNA,RT-PCR技术验证引物,2%琼脂糖凝胶电泳(内参β-actin),成像系统中拍摄分析。miR-181a以U6作为内参,在实时定量PCR仪中扩增并测量绘制扩增曲线,反应体系为5 μL SYBR Green,2.4 μL RNase-free water,0.4 μL引物(浓度为10 μmol/L),2 μL cDNA(逆转后稀释10倍),0.2 μL ROX。反应结束后读取CT值,计算2-ΔΔCT,引物序列见表1。

表1 引物序列
2.7 Western blot法检测p-STAT、TLR4蛋白表达 称取小鼠肝脏组织适量,加入RIPA蛋白裂解液充分匀浆后,在4 ℃下提取30 min后,12 000 r/min离心10 min,收集上清为组织总蛋白,应用BCA蛋白定量法检测蛋白浓度,加入蛋白上样缓冲液,制备灭活样品。经SDS-PAGE凝胶电泳分离后,按照蛋白分子大小切取相应凝胶片段,采用湿法转膜将蛋白条带转移至PVDF膜上,经牛奶封闭、孵育一抗、洗膜、孵育二抗、洗膜等步骤后,X光片显影,扫描图像,Image J软件分析蛋白表达。

3 结果
3.1 竹节参总皂苷对高脂饮食小鼠体质量及肝质量指数的影响 小鼠给予高脂饲料喂养19周后,体质量及肝质量指数较正常组升高(P<0.05,P<0.01);经竹节参总皂苷药物干预后,小鼠体质量及肝质量指数下降(P<0.05,P<0.01),见表2。

表2 竹节参总皂苷对高脂饮食小鼠体质量及肝质量指数的影响
3.2 竹节参总皂苷对高脂饮食小鼠血液中ALT活性及肝组织TG水平的影响 小鼠给予19周高脂饲料喂养后,血液中ALT活性及肝组织TG水平升高,与正常组比较具有显著差异(P<0.05);与模型组比较,竹节参总皂苷低、高剂量干预后,血清中ALT活性及肝组织TG水平降低(P<0.05),见图1。

注:与正常组比较,#P<0.05;与模型组比较,*P<0.05。图1 竹节参总皂苷对高脂饮食小鼠血液中ALT及肝组织TG的影响
3.3 竹节参总皂苷改善高脂饮食小鼠肝组织病理变化 小鼠给予高脂饲料喂养19周后,肝小叶结构不完整,肝脏细胞肿胀、变圆,排列不规则,可见弥漫性的脂质空泡,并有融合现象,伴随炎性细胞浸润,结合“3.1”“3.2”项下结果证明模型构建成功[13];经竹节参总皂苷干预后,肝组织病理变化改善明显,肝索排列较整齐,脂肪空泡明显减少,肝组织炎症浸润现象轻微,见图2。

注:黑色剪头指示脂质空泡位置。图2 高脂饮食小鼠肝组织HE染色(×200)
3.4 竹节参总皂苷调节高脂饮食小鼠肝脏脂质代谢相关基因的表达 与正常组比较,模型组小鼠肝脏组织中脂质代谢相关基因SREBP-1c、ChREBPmRNA表达升高(P<0.05),高脂饮食引起小鼠肝脏脂质代谢紊乱;竹节参总皂苷干预后SREBP-1c、ChREBPmRNA表达降低(P<0.05),见图3。

注:与正常组比较,#P<0.05;与模型组比较,*P<0.05。图3 竹节参总皂苷对高脂饮食小鼠肝组织中脂质代谢及炎症相关基因表达的影响
3.5 竹节参总皂苷调节高脂饮食小鼠肝脏组织炎症相关基因及蛋白表达 小鼠高脂饲料喂养19周后,肝脏组织中TLR4、p-STAT1蛋白表达升高,见图4;TNFα、IL-1βmRNA表达也较正常饮食组高(P<0.05),见图3;低、高剂量竹节参总皂苷干预后,上述指标均有所下降,并趋于正常水平。
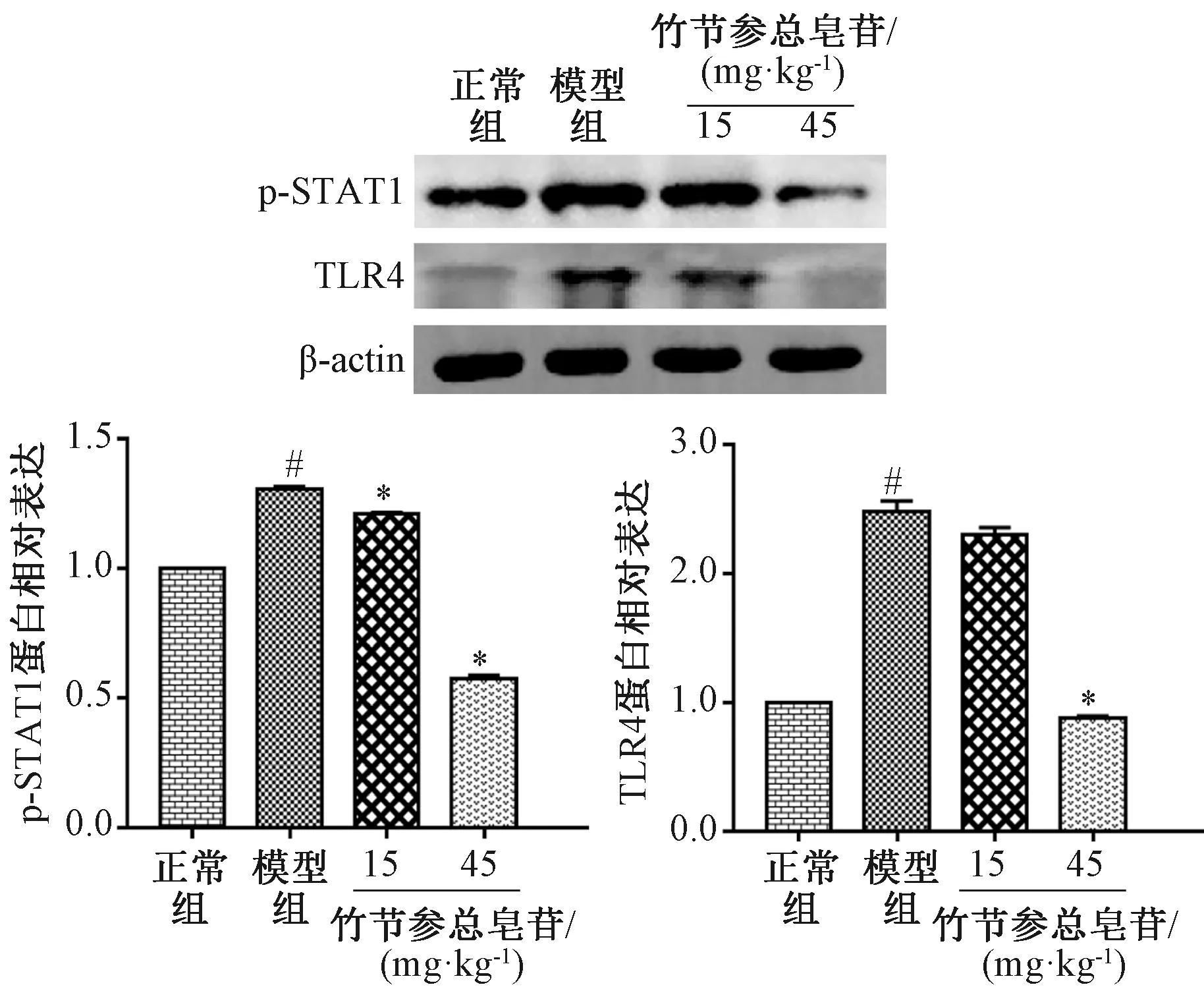
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05。图4 竹节参总皂苷对高脂饮食小鼠肝脏组织中炎症相关蛋白表达的影响
3.6 竹节参总皂苷调节高脂饮食小鼠肝脏组织miR-181a及PPARα基因表达PPARα基因表达在小鼠肝组织中下降(P<0.05),而经竹节参总皂苷干预后升高,并趋于正常组水平,见图3。同时,PPARα可作为miR-181a的靶蛋白,见图5。模型组miR-181a基因表达较正常组升高,竹节参总皂苷干预后其表达呈下降趋势(P<0.05),见图6。

图5 miR-181a和PPARα 3′UTR之间预测碱基配对

注:与正常组比较,#P<0.05;与模型组比较,*P<0.05。图6 竹节参总皂苷对高脂饮食小鼠肝脏组织中miR-181a基因表达的影响
4 讨论
miRNAs通过参与转录后调控干扰目标基因的表达,miRNA-181a是其中的一员,可调节基因表达所引起的肝脏代谢紊乱及应激激活途径,从而影响NAFLD及其向疾病更严重阶段的发展[14]。NAFLD患者及动物中显著上调的miR-181a可损害肝脏葡萄糖、脂质平衡,而miR-181a可直接靶向PPARα,激活TLR4/NF-κB途径,调节炎症反应[15-16]。本实验证实,NAFLD发生发展与miR-181a/PPARα信号通路相关,而竹节参总皂苷可通过调控该信号通路对NAFLD起到干预作用。
PPARα可同时参与NAFLD脂质代谢及炎症反应的调节过程[17],通过LXR途径调节SREBP-1c、ChREBP水平[18-19],调控乙酰辅酶a羧化酶(acetyl-CoA carboxylase,ACC)和脂肪酸合成酶(fatty acid synthase,FAS)活性[20-21],干预肝脏脂肪酸催化合成。抑制PPARα表达时,肝脏储存过量的脂肪酸,破坏其生理适应机制,引起活性氧形成、内质网应激、肝细胞功能障碍和损伤,导致脂毒性炎症发生[22]。脂毒性应激时Toll样受体4(toll-like receptor 4,TLR4)被激活,一方面通过MyD88依赖途径激活NF-κB诱导炎症介质IL-1β、TNFα的释放[23];另一方面通过MyD88和TRIF依赖性信号诱导STAT1在Ser727处的快速磷酸化,并形成同源二聚体进一步迁移到细胞核中驱动下游炎症途径,激化炎性反应[24-25],而PPARα可抑制TLR4表达来减轻炎症水平[26]。本实验结果显示,竹节参总皂苷可能通过调节PPARα/SREBP-1c、ChREBP的脂毒性及PPARα/TLR4/STAT1的炎症反应信号通路,达到改善NAFLD的作用。
综上所述,miR-181a/PPARα及其介导的SREBP-1c、ChREBP及TLR4/STAT1信号通路促进NAFLD的发生与发展,而竹节参总皂苷可通过调控上述信号通路对NAFLD起到治疗作用,为相关防治提供了新方向。
