二十五味鬼臼丸的植物雌激素样作用及其对雌激素受体的调控
2022-01-27李淑桢代冬芳张立雪吴佩锋李长兴
王 琦, 李淑桢, 代冬芳, 张立雪, 吴佩锋, 李长兴*
(1.青海大学医学院基础医学部,青海 西宁 810006;2.西北民族大学医学部,甘肃 兰州 730000)
围绝经期是指女性由性成熟期进入老年期的过渡时期,最显著的变化是卵巢功能衰退,最终卵巢内卵泡耗竭,雌激素及抑制素水平降低,引起一系列症状和体征,又称围绝经期综合征[1],其临床症状比较复杂,卵巢功能减退引起的雌激素缺乏将导致女性出现绝经晚期发生骨质疏松和老年痴呆等疾病,严重影响其生活质量[2]。雌激素-孕激素合用治疗被世界卫生组织癌症研究机构列在致癌物清单中[3],故人们将目光转到更加安全有效的植物雌激素上,植物雌激素是指存在于植物中的具有类雌激素效应的天然产物,其化学结构与内源性雌二醇(estradiol,E2)相似,根据化合物单体结构差异可分为木脂素、异黄酮、香豆素、二苯乙烯[4]。植物雌激素为一种天然的选择性雌激素受体调节剂,可在体内起到模仿或调节内源性雌激素的作用,缓解女性围绝经期综合征症状并防止长期应用雌激素所诱发的风险[5-6]。
鬼臼是二十五味鬼臼丸的主要成分,含有木脂素等植物雌激素,临床证实该制剂具有雌激素样作用,对围绝经期综合征有良好的预防及治疗作用,在治疗月经不调、妇女血症等方面有一定疗效[7-8],但其作用机制仍在不断探索中。本研究通过建立围绝经期综合征大鼠模型,观察二十五味鬼臼丸对围绝经期综合征大鼠血清激素水平及子宫组织中雌激素受体(estrogen receptor,ER)亚型表达的影响,以期为该制剂后续临床应用提供参考。
1 材料
1.1 动物 60只SPF级雌性SD大鼠,3月龄,体质量200~220 g,由西安交通大学医学部实验动物中心所提供,实验动物生产许可证号SCXK(陕)2017-003,饲养温度(22±1) ℃,相对湿度50%~60%,自由摄食进水,12 h/12 h昼夜自然规律。整个实验过程遵循本单位实验动物伦理委员会相关规定。
1.2 试剂与药物 戊酸雌二醇片(德国拜耳公司,批号201710BJ125);二十五味鬼臼丸(青海省藏医院,国药准字Z20140539,0.35 g×49丸/瓶,批号626189)。大鼠雌二醇(E2) ELISA试剂盒、黄体生成素(LH)ELISA试剂盒、促卵泡素(FSH)ELISA试剂盒(江苏酶标生物科技有限公司,批号分别为MM-0575R1、MM-0587R1、MM-0566R1);TRIzol Reagent(美国Ambion公司,批号229001);PCR引物由日本TaKaRa公司合成;RNA提取试剂盒、荧光定量PCR试剂盒[天根生化科技(北京)有限公司,批号分别为S7513、S7422];β-actin(英国Abcam公司,货号ab8227);大鼠ERα多克隆抗体、大鼠ERβ多克隆抗体(英国Abcam公司,批号分别为GR3230941-3、GR3236514-1);脱脂奶粉、SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒、SDS-PAGE电泳液、转膜液[生工生物工程股份(上海)有限公司,批号分别为G601BA0002、FC09DA0001、103019200520、121319200519];彩虹245广谱蛋白Marker(北京索莱宝生物科技有限公司,批号1223C022);5×蛋白上样缓冲液(武汉塞维尔生物科技有限公司,批号HJ195108);BCA蛋白定量试剂盒(武汉博士德生物工程有限公司,批号14I29C46);ECL显影液(爱必信上海生物科技有限公司,批号OA16);DAPI染色液(上海碧云天生物技术有限公司,批号C1006);Cy3标记羊抗兔IgG(北京博奥森生物工程有限公司,批号A0516)。
1.3 仪器 高速离心机(德国Eppendorf公司);多功能酶标仪(美国Bio-Rad公司);Nanodrop 2000(美国Thermo公司);Light Cycler96实时荧光定量PCR仪(瑞士Roche公司);全景切片扫描仪(匈牙利3DHISTECH公司);荧光显微镜(日本Nikon公司);FlourChem R多功能成像分析系统(美国Protein Simple公司)。
2 方法
2.1 分组、造模及给药 大鼠适应性饲养1周后,随机分为假手术组、模型组、雌二醇组、二十五味鬼臼丸组,每组15只,模型建立方法参考文献[9],术前12 h禁食不禁水,称定体质量后腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉,左侧背部最末肋骨下腋中线上距脊柱约2 cm处完整地切除双侧卵巢,假手术组剪除卵巢周围体积等大的脂肪组织,不摘卵巢,其余各组行双侧卵巢切除术,术后肌肉注射青霉素(20 000 IU/只)预防感染,连续3 d。术后5 d,对大鼠逐只进行阴道涂片,每天1次,连续5 d,若不出现动情期反应则表示造模成功。手术后恢复2周时开始给药,按照临床等效剂量换算后,雌二醇组剂量为0.1 mg/kg,用蒸馏水配成0.01 mg/mL混悬液;二十五味鬼臼丸组剂量为360 mg/kg,蒸馏水配成0.36 g/mL混悬液;假手术组和模型组灌胃等容量生理盐水,隔天给药,持续8周。
2.2 样本制备 各组大鼠末次给药后禁食12 h,腹腔注射10%水合氯醛麻醉,腹主动脉取血5 mL,室温静置2 h,4 ℃、3 000 r/min离心15 min,分离血清,置于-20 ℃冰箱中保存。摘取大鼠子宫,生理盐水冲洗,滤纸吸干组织表面水分,电子天平准确称定湿质量,计算子宫指数(uterine index,UI),公式为UI=子宫组织湿质量/大鼠体质量,取一部分置于4%多聚甲醛中固定,另一部分在液氮中保存用于后续实验。
2.3 ELISA法检测大鼠血清E2、LH、FSH水平 严格按照相关试剂盒说明书步骤,采用ELISA法检测血清E2、LH、FSH水平。
2.4 RT-qPCR检测大鼠子宫组织ERα、ERβmRNA表达 取大鼠子宫组织约100 mg,加入Trizol提取组织总RNA,按照反转录试剂盒说明书步骤将其反转录成cDNA,核酸分析仪检测RNA浓度及纯度后检测吸光度。实时荧光定量PCR反应条件为42 ℃,15 min;95 ℃,3 min,共40个循环。β-actin为内参基因,记录各样本CT值采用2-ΔΔCT相对定量法计算目的基因相对表达,每个样本的ΔCT=CT目的基因-CT内参,ΔΔCT=ΔCT实验组-ΔCT对照组,引物序列见表1。

表1 引物序列
2.5 Western blot检测大鼠子宫组织ERα、ERβ蛋白表达 从大鼠子宫组织匀浆中提取总蛋白,BCA试剂盒测定总蛋白浓度,上样量为30 μg,进行SDS-PAGE电泳,转膜后10%脱脂牛奶封闭2 h,PBST洗膜,4 ℃孵育多克隆抗体ERα(1∶1 000)、ERβ(1∶1 000) 10~14 h,洗膜后孵育二抗(1∶10 000),室温静置1 h,洗膜,ECL显色,曝光。采用AlphaEase FC软件对条带进行分析,以β-actin为内参,计算ERα、ERβ蛋白相对表达。
2.6 免疫荧光双标检测ERα、ERβ蛋白表达 将大鼠子宫组织切片后放入二甲苯中,乙醇梯度脱水,蒸馏水冲洗,置于EDTA抗原修复缓冲液(pH 9.0)中,高压抗原修复2.5 min,冷却后将玻片置于PBS(pH 7.4)中,脱色摇床上洗涤3次,每次5 min,轻轻甩掉封闭液,滴加ERα一抗(1∶200)、ERβ一抗(1∶200),4 ℃孵育过夜,加入荧光标记二抗(1∶300),37 ℃孵育1 h,DAPI复染细胞核封片,在荧光显微镜下观察拍照,图像用Image J 6.0软件分析,计算平均荧光强度。
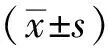
3 结果
3.1 二十五味鬼臼丸对大鼠子宫指数的影响 与假手术组比较,模型组大鼠子宫指数降低(P<0.01);给药8周后,与模型组比较,二十五味鬼臼丸组、雌二醇组大鼠子宫指数升高(P<0.05,P<0.01),见表2。
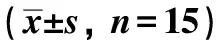
表2 各组大鼠体质量、子宫指数
3.2 二十五味鬼臼丸对大鼠血清E2、LH、FSH水平的影响 与假手术组比较,模型组大鼠血清E2水平降低(P<0.01),LH、FSH水平升高(P<0.01);与模型组比较,二十五味鬼臼丸组、雌二醇组大鼠血清E2水平升高(P<0.01),LH、FSH水平降低(P<0.05,P<0.01),见表3。
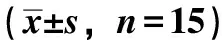
表3 各组大鼠血清E2、LH、FSH的水平
3.3 二十五味鬼臼丸对大鼠子宫组织ERα、ERβmRNA表达的影响 与假手术组比较,模型组大鼠子宫组织ERα、ERβmRNA表达均降低(P<0.01);与模型组比较,二十五味鬼臼丸组大鼠子宫组织ERαmRNA表达无明显变化(P>0.05),ERβmRNA表达升高(P<0.05),而雌二醇组两者mRNA表达均升高(P<0.01),见图1。
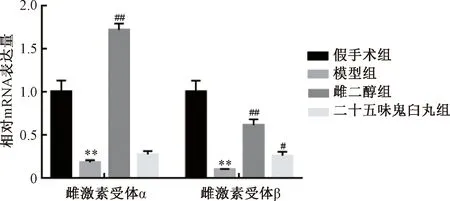
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。图1 各组大鼠子宫组织ERα、ERβ mRNA表达Fig.1 mRNA expressions of ERα and ERβ in uterine tissue of rats in various
3.4 二十五味鬼臼丸对大鼠子宫组织ERα、ERβ蛋白表达的影响 与假手术组比较,模型组ERα、ERβ蛋白表达降低(P<0.01);与模型组比较,二十五味鬼臼丸组ERα蛋白表达无明显变化(P>0.05),ERβ蛋白表达升高(P<0.01),而雌二醇组两者蛋白表达均升高(P<0.01),见图2。
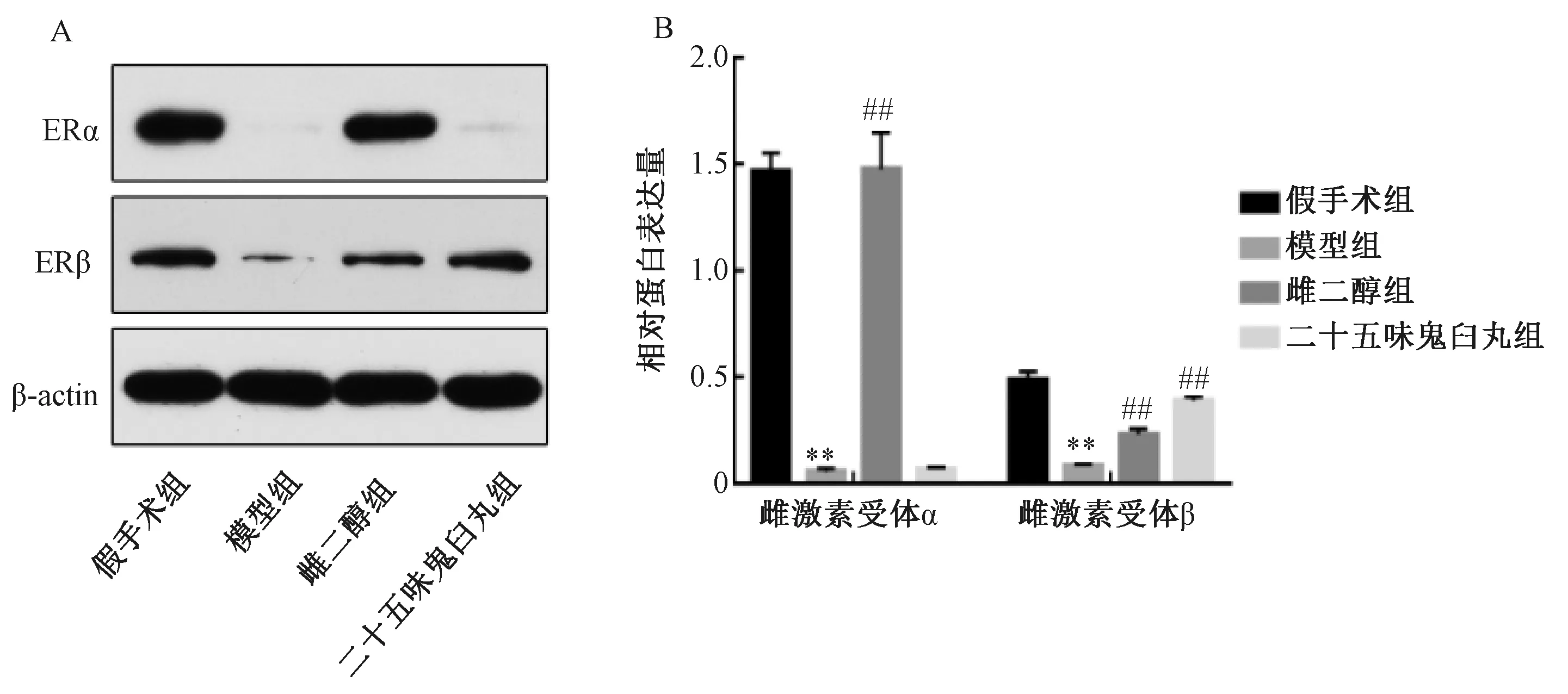
注:A为Western blot条带,B为半定量分析。与假手术组比较,**P<0.01;与模型组比较,##P<0.01。图2 各组大鼠子宫组织ERα、ERβ蛋白表达Fig.2 Protein expressions of ERα and ERβ in uterine tissue of rats in various groups
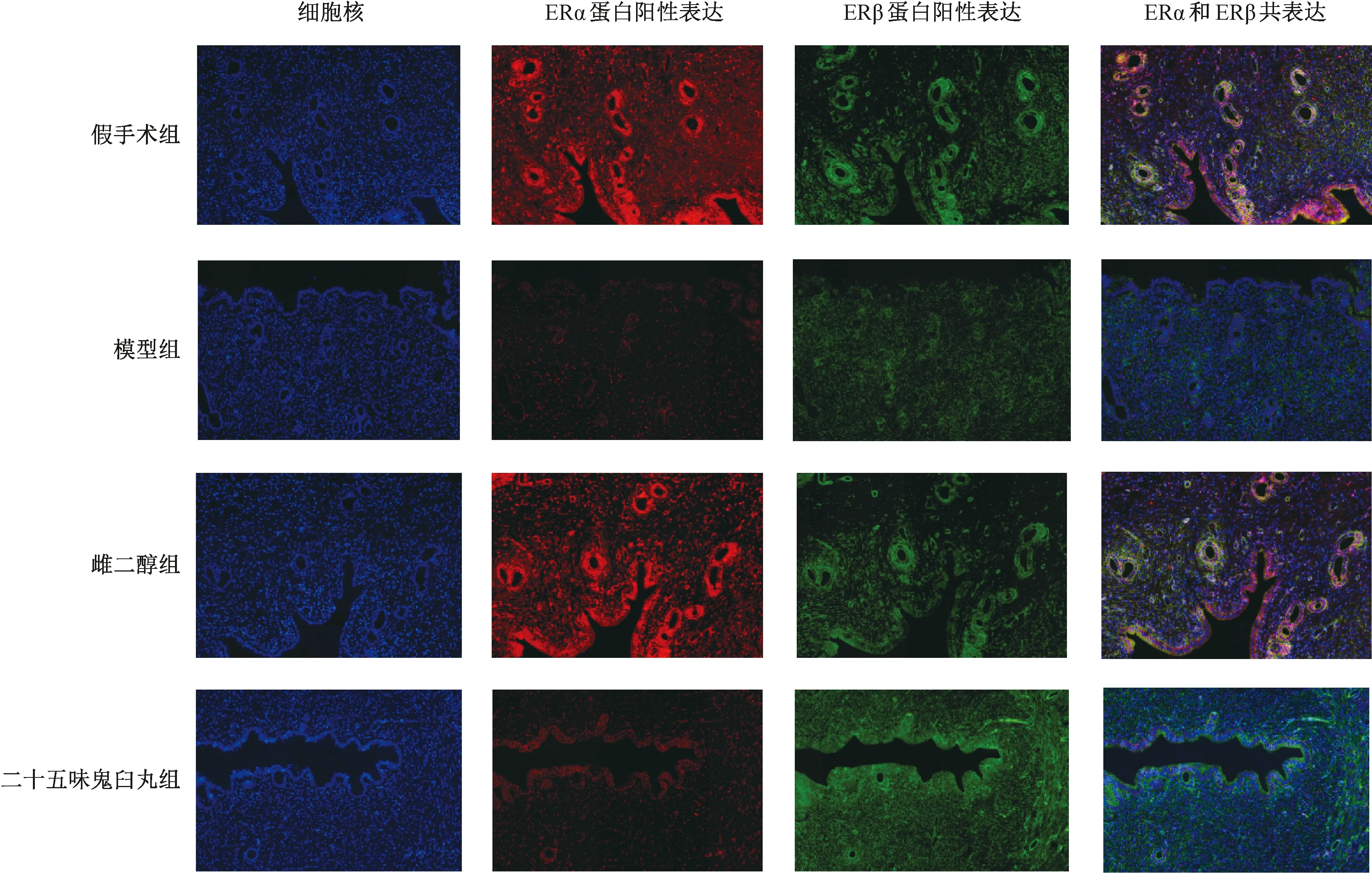
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01。图3 各组大鼠子宫组织ERα、ERβ荧光染色(×200)Fig.3 Fluorescence staining of ERα and ERβ in uterus tissues of rats in various groups (×200)
3.5 免疫荧光双标检测大鼠子宫组织ERα、ERβ蛋白表达 免疫荧光染色(图3)显示,ERα蛋白表达阳性为红色,ERβ蛋白表达阳性为绿色。ERα免疫荧光强度结果(图4)显示,与假手术组比较,模型组大鼠子宫组织ERα平均荧光强度降低(P<0.01);与模型组比较,二十五味鬼臼丸组大鼠子宫组织ERα平均荧光强度无明显变化(P>0.05),而雌二醇组其平均荧光强度升高(P<0.01)。ERβ免疫荧光强度结果(图4)显示,与假手术组比较,模型组大鼠子宫组织ERβ平均荧光强度降低(P<0.01);与模型组比较,二十五味鬼臼丸组、雌二醇组大鼠子宫组织平均荧光强度升高(P<0.01)。
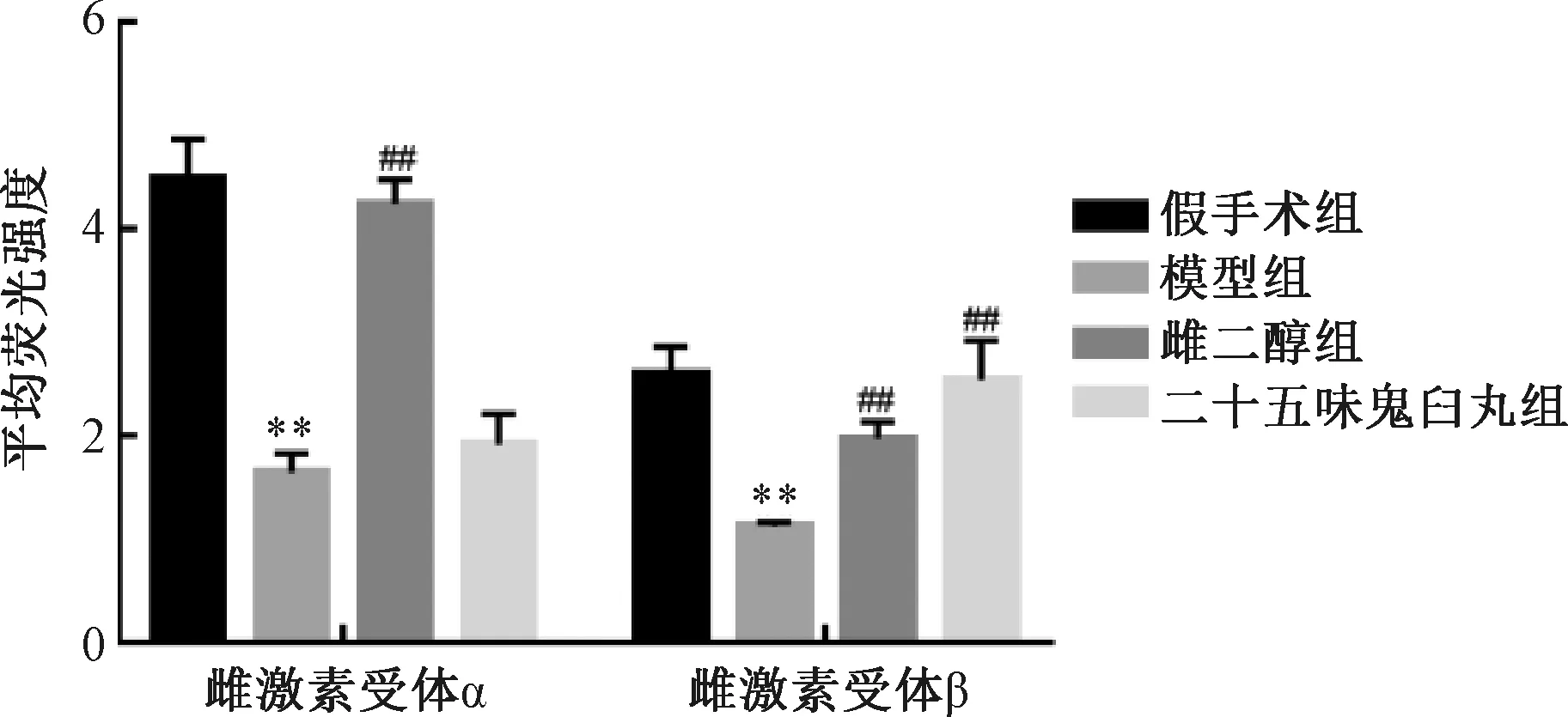
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01。图4 各组大鼠子宫组织ERα、ERβ荧光强度Fig.4 Fluorescence intensities of ERα and ERβ in uterine tissue of rats in various groups
4 讨论
雌二醇(E2)是人体内生物活性最强的雌激素,通过与ER结合在体内发挥作用,其作用与ER的类型和数量有关[10]。ER属于核受体超家族,其亚型包括经典的核受体ERα、ERβ。近年来,植物雌激素被称为“选择性雌激素受体调节剂”,其化学结构与内源性雌激素E2结构相似,也可结合体内的ER,在体内具有双重调节作用[11-12]。在体内雌激素水平较低时,其与ER结合,发挥雌激素样作用;雌激素水平较高时,其与ER竞争性结合阻止强活性的E2与ER结合,发挥拮抗雌激素的作用[13]。经典的雌激素作用通路是雌激素首先与相应的ER结合,ER被雌激素样化合物激活后,ER受体二聚化形成二聚体复合物 (ERα-α、ERα-β、ERβ-β),ER以二聚体的形式结合到靶基因的雌激素反应元件序列并激活靶基因[14-15]。
围绝经期综合征由一系列精神及躯体表现组成,其发病机理复杂,围绝经期妇女各项生理功能都会出现不同程度的异常,主要表现为月经变化、乏力、情绪易激动、多虑、抑郁、心悸、失眠等[16]。最早表现为卵巢功能衰退,继而表现为下丘脑-垂体功能退化,激素水平改变,主要表现为E2和FSH、LH,分泌抑制垂体的因子减少,导致下丘脑-垂体负反馈功能障碍,出现下丘脑-垂体-卵巢轴失衡[17-18]。
本实验通过构建围绝经期综合征大鼠模型,用二十五味鬼臼丸干预治疗,观察其对UI、子宫血清激素变化及子宫ER表达的影响。研究结果显示,与模型组比较,二十五味鬼臼丸组UI及血清E2水平升高,而LH、FSH水平降低,说明二十五味鬼臼丸有效改善围绝经期综合征所引起的激素紊乱。RT-qPCR结果显示,模型组ERα、ERβmRNA表达降低,二十五味鬼臼丸组子宫ERαmRNA表达无明显变化,而ERβmRNA表达升高;Western blot及免疫荧光双标结果显示,二十五味鬼臼丸主要通过ERβ提高ER的生物学效应,这与王婷等[19]研究发现,4种木脂素类植物雌激素与对ERβ结合亲和力均高于ERα的研究一致。陈嘉彦等[20]研究发现,正常子宫内膜组织中ERβ蛋白阳性表达率高于子宫内膜癌组织中ERβ蛋白阳性表达率,ERβ的下调可能与子宫内膜癌的发生有关。因此,与其他对ERα亲和力较高的植物雌激素相比,选择性激动ERβ不会引起相应的细胞增殖作用,二十五味鬼臼丸可通过提高大鼠子宫ERβ表达,改善大鼠血清激素水平,可能是其治疗围绝经期综合征的作用机制之一。
综上,本研究初步确定二十五味鬼臼丸对围绝经期综合征大鼠血清激素及子宫组织中ERβ具有调控作用,表现出二十五味鬼臼丸类似选择性雌激素受体调节剂作用,为藏药二十五味鬼臼丸发挥的临床应用的有效性和安全性提供了依据。
