促进裂殖壶菌发酵产二十碳五烯酸的两阶段控温和低溶氧策略
2022-01-27王永华莫舒欣肖正雷长梅
王永华 莫舒欣 肖正 雷长梅
(华南理工大学 食品科学与工程学院,广东 广州 510640)
二十碳五烯酸(EPA)是一种对人体十分重要的n3-多不饱和脂肪酸(PUFAs),在保健食品、药品、饲料等行业具有广阔的商业前景,对于心血管疾病的防治、精神分裂症、抑郁症的治疗及抗炎抗癌等方面具有重要的生理功能[1- 7]。EPA的传统来源是深海鱼油,但由于受到海洋资源日益枯竭和环境污染如核泄露等因素的影响,鱼油的质量和产量不尽如人意,无法满足人们对EPA日益增长的需求,寻找一条可持续的绿色生产途径是目前亟待解决的问题。海洋微藻是PUFAs的初级生产者,生长要求的营养相对简单,环境因素适中且容易控制,成为PUFAs的替代来源,受到人们的广泛重视。目前,常见产EPA的微藻如三角褐指藻[8- 10](Phaeodactylumtricornutum)、菱形藻[11- 13](Nitzschialaevis)、微拟球藻[14- 15](Nannochloropsissp.)等微生物生长缓慢,培养温度低,且在发酵过程中需要光照等,因而生物量往往小于5 g/L。由于生物产量和EPA产率低下且发酵成本高,大大限制了微藻来源EPA的工业化开发。
微藻油脂中的脂肪酸组成会随着环境胁迫而变化,温度和溶氧(DO)是影响生物生长和油脂积累的关键因素,显著影响产油微藻的脂肪酸组成。Chodchoey等[16]发现随着温度从30 ℃降至12 ℃,破囊壶菌Aurantiochytriummangrovei总脂肪酸(TFAs)中的二十二碳六烯酸(DHA)所占比例从28.90%上升至41.81%;Jakobsen等[17]研究了氧限制对破囊壶菌Aurantiochytriumsp.T66中DHA生成的影响,结果表明,在低溶氧条件下,DHA含量达到52.12%,而对照组仅为25.03%。然而,改善PUFAs的应激策略通常以降低生物量为代价,但这可以通过阶段控温和控氧发酵来解决。Liang等[18]通过30 ℃(发酵4 d)- 25 ℃(发酵3 d)- 20 ℃(发酵1 d)- 15 ℃(发酵4 d)的阶段控温发酵策略来提高畸雌腐霉Pythiumirregulare的EPA产量,阶段控温发酵策略与优化前相比,发酵时间从 12 d缩短至9 d,EPA产量从211.7 mg/L上升至243.1 mg/L;Ren等[19]采用阶段控氧策略发酵裂殖壶菌Schizochytriumsp.HX- 308,获得较高的生物量(71 g/L)和DHA含量(48.95%),以上研究表明,阶段控制温度或供氧的策略对微藻的细胞生长和PUFAs合成有明显影响。
裂殖壶菌(Schizochytriumsp.)是一种异养海洋真菌,具有生长速度快、发酵成本低和DHA含量高等优点,已经成为工业化生产DHA的菌株,EPA也存在其脂肪酸中[19]。Schizochytriumsp.ATCC 20888中存在两条脂肪酸合成途径,其中,短链饱和脂肪酸主要由脂肪酸合成酶(FAS)途径合成,DPA、DHA等多不饱和脂肪酸则为聚酮合成酶(PKS)途径的产物[20- 21]。EPA与DHA结构相似,为DHA的前体物质,微藻油脂中DHA可由EPA经过碳链延长和去饱和进一步合成,若在高产DHA的裂殖壶菌细胞内,通过环境胁迫阻断EPA向DHA转化的途径,则可能会大幅提高EPA的产量。所以,富含DHA的裂殖壶菌具有一定生产EPA的潜力。近年来,国内外对于裂殖壶菌的研究主要集中在诱变育种和发酵工艺优化来提高DHA产量[22- 23],而对于裂殖壶菌作为EPA的生产菌株的可行性研究较少,且产量较低,难以满足产业化的生产需求。裂殖壶菌作为我国卫生部批准为新资源食品的DHA藻油来源之一,其藻油安全性已获得确认,探究其生产EPA的可行性,并提高产量,从而实现EPA工业化生产十分必要。本研究建立了一种两阶段控温-低溶氧控制发酵工艺(TST-LDO)来促进裂殖壶菌产EPA,以期为裂殖壶菌发酵生产EPA油脂工业化提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1 菌株
本实验室从美国典型培养物保藏中心(ATCC,USA)购买获得裂殖壶菌菌株Schizochytriumsp.ATCC 20888。
1.1.2 化学试剂
葡萄糖(AR(分析纯),CAS号:58367- 01- 4)、硫酸钠(AR,CAS号:7757- 82- 6)、硫酸镁(AR,CAS号:22189- 08- 8),购自无锡市佳妮化工有限公司;谷氨酸钠(食品级,CAS号:142- 47- 2),购自上海太太乐食品有限公司;酵母浸粉(AR,CAS号:8013- 01- 2),购自广东环凯微生物科技有限公司;硫酸铵(AR,CAS号:7783- 20- 2),购自广东广试试剂科技有限公司;磷酸二氢钾(AR,CAS号:7778- 77- 0),购自福晨化学试剂有限公司;氯化钾(AR,CAS号:7447- 40- 7),购自江苏强盛功能化学股份有限公司。
1.1.3 培养基
金属离子混合液:Na2EDTA 6 g/L、FeSO4·7H2O 0.58 g/L、MnCl2·4H2O 0.86 g/L、ZnSO4·7H2O 1.42 g/L、CoCl2·6H2O 0.01 g/L、Na2MoO4·2H2O 0.01 g/L、NiSO4·6H2O 0.06 g/L、CuSO4·5H2O 0.6 g/L。
固体培养基:葡萄糖80 g/L、磷酸二氢钾 3.5 g/L、谷氨酸钠60 g/L、酵母浸粉10 g/L、硫酸铵1.5 g/L、七水硫酸镁4.48 g/L、氯化钾1 g/L、无水硫酸钠37 g/L、金属离子混合液 2 mL/L,琼脂粉18 g/L。种子培养基:葡萄糖80 g/L、磷酸二氢钾3.5 g/L、谷氨酸钠60 g/L、酵母浸粉10 g/L、硫酸铵1.5 g/L、七水硫酸镁4.48 g/L、氯化钾1 g/L、无水硫酸钠37 g/L、金属离子混合液2 mL/L。发酵培养基:葡萄糖100 g/L、磷酸二氢钾3.5 g/L、谷氨酸钠40 g/L、酵母浸粉10 g/L、硫酸铵4.8 g/L、七水硫酸镁4.48 g/L、氯化钾1 g/L、无水硫酸钠37 g/L、金属离子混合液2 mL/L。高温蒸汽灭菌:121 ℃,20 min。葡萄糖单独灭菌:115 ℃,20 min。
1.2 实验方法
1.2.1 发酵培养
菌种活化:将保藏于-80 ℃超低温冰箱中的甘油管菌株划线接种于平板固体培养基中,28 ℃静置培养2 d。
种子培养:用接种环挑取单菌落接入装有 5 mL 种子培养基的20 mL试管中,180 r/min、28 ℃培养2 d;以10%(体积分数)的接种量将上述种子液接入装有100 mL种子培养基的500 mL挡板锥形瓶中,180 r/min、28 ℃培养1 d。
摇瓶发酵培养:为了研究温度的影响,以10%的接种量将种子液接种到发酵培养基中(100 mL/500 mL挡板三角瓶),180 r/min培养120 h,0~24 h 之间,控制发酵温度为28 ℃,24 h 后分别设置发酵温度为20、25、28、32、34、36和38 ℃,72 h 时向摇瓶中补加葡萄糖至终质量浓度为50 g/L,实验重复3次。
发酵罐培养:3 L发酵培养基加入5 L发酵罐(BIOTECH- 5BG型,上海保兴生物设备工程有限公司生产)中,接种量为10%,转速为600 r/min,通气量为3 L/min,用2 mol/L NaOH溶液或HCl溶液调节pH至6.5,当发酵液中葡萄糖含量降至20 g/L 时,连续流加700 g/L的葡萄糖溶液,使发酵液中的葡萄糖含量保持在10~ 20 g/L,4个发酵批次条件设置如下:①为验证温度影响,分别设置发酵温度工艺为28 ℃(0~120 h)、28 ℃(0~24 h)→34 ℃(24~120 h);②为探究变温时间点的影响,选择24、48、72 h 3个时间点,将发酵温度由28 ℃提高到34 ℃;③为了研究两阶段控温条件下不同溶氧水平对裂殖壶菌生长及EPA合成的影响,通过控制转速和通气将DO控制在不同溶氧水平,当溶氧水平开始增加时,控制转速和通气使其维持在25%DO(高溶氧水平)、10%DO(中溶氧水平)和2%DO(低溶氧水平);④根据上述最佳实验结果,建立TST-LDO发酵工艺,每批次发酵罐发酵实验重复两次。
1.2.2 生物量、葡萄糖及谷氨酸钠含量测定
生物量用菌体干重(DCW)表示,生物量测定方法是取2 mL发酵培养液于离心管中,8 000 r/min离心5 min,将上清液和菌体分开,并用37 g/L 硫酸钠溶液将菌体洗涤离心2-3次,80 ℃ 烘干至恒重后称重。利用生物传感仪(SBA- 40C型,山东省科学院生物研究所生产)测定上清液的葡萄糖及谷氨酸钠含量。
1.2.3 油脂产量测定
取10 mL发酵液加入50 mL离心管中进行离心洗涤,得到湿菌体,之后加入10 mL浓盐酸,混匀后置于80 ℃水浴反应1 h,期间振荡混匀3-4次。反应结束后加入正庚烷萃取油脂,重复3-4次直至有机层无色,然后在旋转真空蒸发器中除去溶剂,置于烘箱干燥至恒重后称重。
1.2.4 脂肪酸组成测定
将2 mL 2%氢氧化钠-甲醇溶液加至装有0.2 g油脂和50 μL 16 g/L二十一碳烷酸(内标)的15 mL 离心管中,在60 ℃水浴中反应30 min,期间震摇3-5次,反应结束后加入2 mL 14%三氟化硼-甲醇溶液,继续在60 ℃水浴中反应2 min,取出离心管迅速冷却至室温,加入2 mL正庚烷和5 mL 饱和氯化钠溶液,混匀后静置分层,取上层有机相加入装有1 g无水硫酸钠的2 mL离心管中,混匀静置后,吸取上层溶液1 mL于气相色谱瓶中进行气相色谱分析。
气相色谱系统为安捷伦公司生产的GC- 7890B,GC系统配备毛细管柱(CP-SIL 88,60 m×0.25 mm×0.2 μm)和氢火焰离子化检测器(FID)。进样器温度为270 ℃,检测器温度为280 ℃,程序升温:初始温度为100 ℃,持续13 min;100~180 ℃,升温速率为10 ℃/min,保持6 min;180~200 ℃,升温速率为1 ℃/min,保持20 min;200~230 ℃,升温速率为4 ℃/min,保持10.5 min。载气:氮气;分流比为100:1;进样体积:1.0 μL。
1.2.5 数据处理
实验数据均用Origin 2017 软件作图,并用SPSS 24.0软件进行显著性分析,结果以平均值±标准偏差表示,采用t检验进行方差分析(P<0.05)。
2 结果与讨论
2.1 温度对裂殖壶菌产EPA发酵性能的影响
Schizochytriumsp.ATCC 20888是经过Barclay筛选的在20 ℃以上繁殖速度快的DHA高产菌株[24]。由图1可知,其最适生长温度为28 ℃,最高生物量和油脂产量分别为33.06 g/L和9.41 g/L。从28 ℃开始,无论温度升高还是降低,生物量和脂肪产量均呈下降趋势,当温度高于32 ℃时,下降趋势更明显,温度升高至34 ℃时生物量为24.96 g/L,油脂产量为4.29 g/L,与28 ℃恒温发酵时相比分别降低24.50%、45.58%。通过实验数据可以看出,温度的升高对油脂的积累有较大的影响,发酵温度通过影响细胞生物量从而影响了油脂产量,菌株在36 ℃和38 ℃下生长缓慢,生物量和油脂产量都较低。
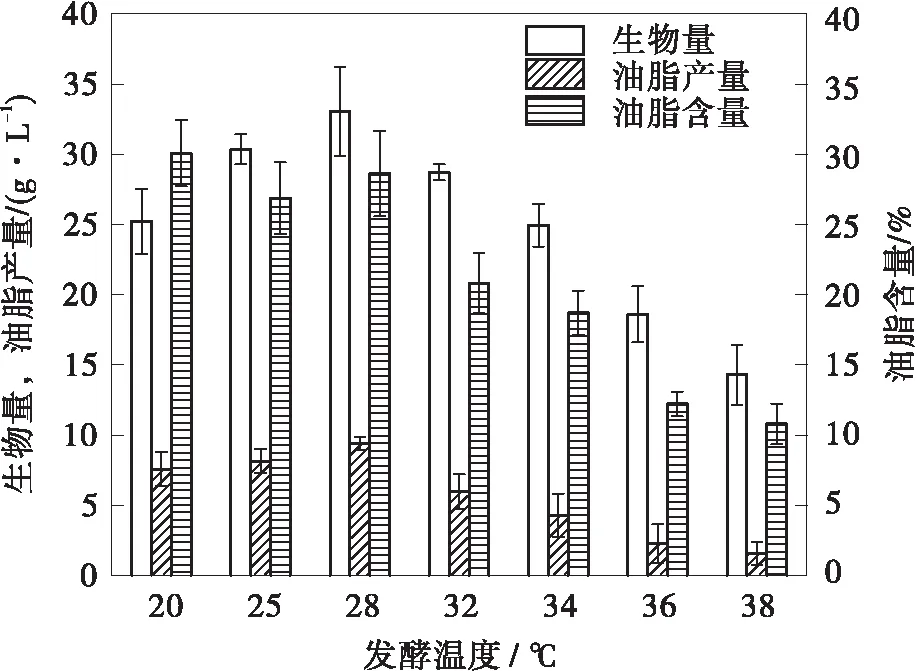
(a)生物量和油脂产量变化情况
温度的变化对脂肪酸成分的影响较大(见图1(b)),随着培养温度的升高,饱和脂肪酸(SFAs)和PUFAs含量的变化趋势几乎相反,温度从20 ℃升高至34 ℃,主要的饱和脂肪酸C16:0(棕榈酸)的含量由28.0%下降到10.57%,在38 ℃ 时又上升到26.45%;DHA和DPA n6的变化趋势相似,均呈先上升后下降的趋势,其含量峰值在32~34 ℃之间;在20~28 ℃下培养时,脂类中EPA的含量小于1%,几乎没有EPA的积累,当发酵温度升高至32 ℃时,EPA含量显著增加到3.88%,约是28 ℃时的4倍,34 ℃时EPA的含量最高,为8.35%。这种上升趋势并没有随着培养温度的升高而升高,当温度高于34 ℃时,EPA含量开始下降,特别是在38 ℃培养时,EPA含量迅速下降至0.55%,与20~28 ℃培养时相近。以上结果表明EPA和DHA在高温作用下具有不同的变化趋势,EPA含量增加的同时,DHA含量并未随之降低,而是保持不变,甚至在一定程度上有所增加,这说明在温度的影响下并没有改变EPA转化为DHA的合成效率,而是加快了C16:0向EPA的转化,却不是作用于DHA。由此推测Schizochytriumsp.ATCC 20888中EPA和DHA的代谢途径可能存在差异,并且存在一定环境胁迫时可能有助于EPA的积累。
温度对细胞膜的流动性、酶活等有显著影响,是影响微生物生长代谢及胞内生化组分的一个关键性因素。细胞膜的空间结构为脂质双分子层,是一种流动模型,生物的物质及能量合成、分解、运输等功能都需要细胞膜的参与,细胞膜通过调节脂肪酸比例从而耐受不同温度。已有大量研究表明[25- 26],在低温胁迫下,细胞膜中的PUFAs比例会增加,从而维持细胞膜的流动性和细胞生理功能,Xing等[27]利用转录组测序分析技术分析高温(32 ℃)和低温(10 ℃)两种培养温度下产油微藻AuxenochlorellaprotothecoidesUTEX 2341的脂肪酸组成变化,结果发现低温可以激活Acetyl-CoA羧化酶和Ⅱ型FAS酶的基因,从而对叶绿体内的脂肪酸代谢产生影响,提高了PUFAs的含量,高温条件下可以通过激活Acetyl-CoA羧化酶、I型多酮合酶和延长酶复合物的大量表达,来诱导PUFAs和极长链多不饱和脂肪酸(VLCFAs)的生物合成,使VLCFAs占总脂肪酸的百分含量与低温发酵时相比增加109.80%。根据这些实验结果可以推测,裂殖壶菌中PUFAs的表达量对培养温度十分敏感,这可能与膜结合的去饱和酶的活性有关。
根据生物量、油脂产量和脂肪酸组成的结果,筛选出34 ℃为诱导EPA积累的最佳培养温度。
2.2 5 L发酵罐中验证温度对裂殖壶菌产EPA发酵性能的影响
为了验证两阶段变温发酵策略能促进EPA积累的现象,是否可以应用于更大规模的发酵过程中,在5 L的发酵罐中进行了试验。表1显示了两种温度控制策略在恒定转速与通气条件下对生物量和油脂产量的影响,在变温条件下,生物量和油脂产量分别为45.28 g/L和8.41 g/L,比28 ℃恒温条件下分别降低29.50%和62.98%,结果表明高温培养对油脂产量有更明显的影响。

表1 5 L发酵罐中不同温度条件下裂殖壶菌的生物量及油脂产量Table 1 Biomass and lipid production of Schizochytrium sp. in 5 L reactors at different temperatures
从表2可以看出,两种温度策略对脂肪酸组成的影响显著。恒温发酵条件下,培养至24~48 h时,SFAs占总脂肪酸的百分含量在起始阶段快速下降,发酵至48 h后缓慢上升,DHA和DPA n6含量在发酵过程呈下降趋势,EPA和DPAn3含量在发酵过程呈上升趋势,在变温发酵条件下,SFAs含量一直呈现下降趋势,在发酵结束时其含量为14.04%,仅为恒温发酵的50.53%,EPA和DPAn3含量在发酵过程仍呈上升趋势,但增加幅度大于恒温发酵,发酵结束时EPA占总脂肪酸的百分含量增加至7.17%,是恒温条件下的8.33倍,DHA占总脂肪酸的百分含量在整个发酵周期中基本保持稳定。由于EPA和DHA在整个发酵周期中的变化趋势并不相似,由此可推测在裂殖壶菌中,EPA和DHA的积累代谢途径可能存在差异,并且存在温度胁迫时有助于EPA的积累。

表2 5 L发酵罐中不同温度条件下裂殖壶菌脂肪酸含量的变化情况
2.3 变温时间对裂殖壶菌产EPA发酵性能的影响
变温时间对裂殖菌发酵性能的影响如图2(a)所示。结果表明,与恒温发酵对照组(CT组)相比,在高温条件下裂殖壶菌的生长受到抑制,升温时间越早,生物量和油脂产量越低,与CT组相比,变温时间为24 h时,生物量和油脂产量下降幅度最大。不同的变温时间对EPA的含量和产量有很大的影响(见图2(b)),在变温时间为24 h后,EPA占总脂肪酸的百分含量变化最为显著,而在变温时间为48 h和72 h时EPA占总脂肪酸的百分含量增加幅度较小,EPA的产量分别为0.293 g/L(CT)、0.667 g/L(24 h)、0.520 g/L(48 h)和0.462 g/L(72 h)。因此,变温时间为24 h最有利于裂殖壶菌中EPA的积累。
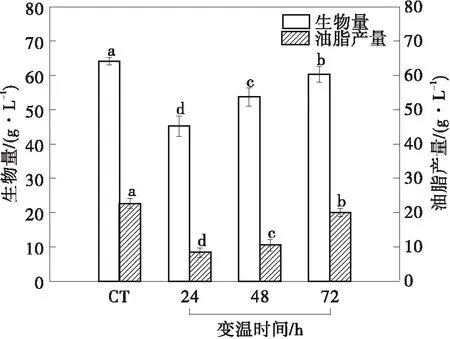
(a)生物量和油脂产量的变化情况
2.4 溶氧条件对裂殖壶菌产EPA发酵性能的影响
氧在需氧微生物的生长和代谢物积累过程中起着重要作用,裂殖壶菌两种脂肪酸的合成途径中,FAS途径需要氧分子参与,PKS途径则不依赖氧分子[28]。为探究不同溶氧水平对裂殖壶菌发酵性能的影响,分别研究在恒定条件(转速600 r/min、恒定通气量3 L/min)和3种溶氧水平下裂殖壶菌的生物量、油脂产量和EPA占总脂肪酸百分含量的变化情况。在阶段控温(28 ℃(0~24 h)→34 ℃(24~120 h))发酵条件下,5 L发酵罐的起始转速为600 r/min,起始通气量为3 L/min,当溶氧开始上升时,通过改变转速和通气量将发酵液溶氧水平分别维持于25%DO(高溶氧)、10%DO(中溶氧)和2%DO(低溶氧)(见图3)。结果表明,高溶氧水平对于裂殖壶菌的菌体生长和油脂积累有促进作用,与2% DO条件相比,10%DO和25%DO条件下的细胞生长更好(见图3(a)),在固定转速和通气条件下进行发酵时生物量在72 h时开始下降,且油脂产量低于其余各组,3种溶氧条件下,发酵至96 h后生物量都略有下降,油脂产量变化趋势与生物量一致,都在96 h后出现下降趋势,发酵结束时油脂产量分别为9.58、23.85和16.58 g/L(见图3(b));在2% DO条件下,EPA含量先快速上升至12.50%(96 h时),然后缓慢下降至12.24%(120 h时)(见图3(c));DHA占总脂肪酸的百分含量变化趋势在恒定转速及3种溶氧水平中基本保持不变,在2% DO条件下DHA占总脂肪酸的百分含量最高,达到47.45%(见图3(d))。
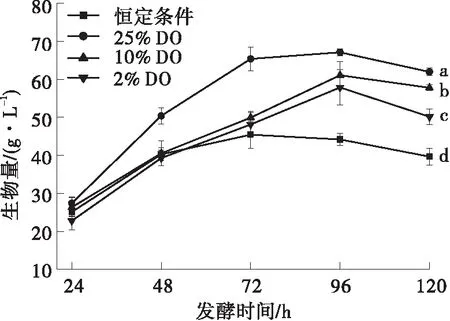
(a)生物量
2.5 TST-LDO控制条件对裂殖壶菌产EPA发酵性能的影响
基于上述分析,本研究提出了一种TST-LDO发酵策略:在发酵初期(0~24 h),将发酵温度控制在28 ℃,24 h后,温度升高至34 ℃,DO水平保持在2%以下,结果如图4所示。根据裂殖壶菌的生长变化情况可将发酵分为4个阶段:0~12 h(阶段1)为生长延滞期,该阶段细胞生长缓慢;12~48 h(阶段2)为对数生长期,在此阶段细胞迅速生长耗尽谷氨酸钠,在48 h时生物量达到51.66 g/L,油脂在24~48 h快速积累;48~84 h(阶段3)为生长平缓期,该阶段细胞缓慢生长,12~84 h葡萄糖被快速消耗,84 h时生物量和油脂产量达到最大值57.01 g/L和10.50 g/L;84~120 h(阶段4)为油脂反耗期,生物量下降到50.12 g/L,油脂产量降至9.06 g/L。在最佳工艺发酵条件下,发酵至96 h时EPA产量最高,达到1.14 g/L,此时生物量、油脂产量和EPA含量分别为56.60 g/L、9.62 g/L和12.50%。
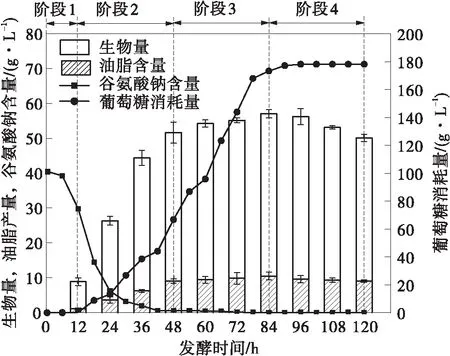
图4 裂殖壶菌在TST-LDO发酵工艺下的发酵情况Fig.4 Fermentation process of Schizochytrium sp.controlled by two-stage-temperature and low-dissolved-oxygen strategy
图5为脂肪酸组成随发酵时间的变化情况。根据脂肪酸组分的变化趋势,将主要检测到的脂肪酸分为3类(SFAs、PUFAs- 1、PUFAs- 2)。SFAs以C16:0为主,24 h到120 h之间,SFAs含量逐渐下降,由25.95%下降到5.28%。24~48 h和72~96 h为两个快速下降阶段,96 h后SFAs占总脂肪酸的百分含量基本不变;PUFAs根据变化趋势的相似性可分为两种类型:PUFAs- 1(花生四烯酸(ARA)、EPA和DPA n3)和PUFAs- 2(DHA和DPA n6)。24 h时PUFAs- 1含量低于1%,72~96 h之间迅速增加,96 h后其含量维持稳定,0~96 h之间EPA的含量随时间延长逐渐增加,96 h时含量达到最高为12.50%,之后缓慢降低,发酵结束时EPA含量为12.24%。DHA和DPA n6含量在24~48 h之间逐渐升高,然后分别维持在45%和16%左右。图5(d)显示了5种类型脂肪酸随发酵时间的变化情况,4种SFAs总量由24 h时的42.89%下降至120 h时的7.66%,PUFAs- 2总量由48.04%上升至63.23%,PUFAs- 1总量由1.25%上升至23.60%。EPA和DHA在高温和低溶氧协同作用下具有不同的变化趋势,EPA含量增加的同时,DHA含量并未随之降低,而是保持不变,甚至在一定程度上有所增加,这说明在温度和溶氧的胁迫下并没有改变EPA转化为DHA的合成效率,而是加快了SFAs向EPA、ARA和DPA n3的转化,却不是作用于DHA。由此,推测在Schizochytriumsp.ATCC20888中EPA和DHA的代谢途径可能存在差异,并且存在一定环境胁迫时可能有助于EPA的积累。

(a)饱和脂肪酸
Zhu等[29]发现将发酵温度从16 ℃增加至37 ℃时,EPA的含量有了明显的提升,EPA含量从0.72%增加至1.24%;凌雪萍等[30]通过在裂殖壶菌培养至24 h时添加50 mg/L氟啶酮使EPA占总脂肪酸的百分含量从0.45%提高至0.65%;孟彤[31]通过补料分批发酵及发酵过程中添加无机盐发酵,使EPA占总脂肪酸的百分含量从0.58%提升至0.98%。与目前研究相比,本研究中采用的TST-LDO策略可以显著促进裂殖菌发酵过程中EPA的积累,且不降低DHA的含量,获得的藻油中PUFAs含量为86.92%,具有较高的开发应用潜力。
3 结语
本文通过探究不同温度、变温时间和溶氧水平对裂殖壶菌发酵产EPA的影响,建立了一种两阶段控温-低溶氧发酵策略。在发酵起始阶段控制温度为28 ℃(0~24 h),裂殖壶菌迅速增殖,在对数生长期中点(24 h),即油脂积累阶段的起始阶段,升高发酵温度至34 ℃时促进了EPA的合成,整个发酵过程中控制溶氧水平为2%。在该策略下,发酵至96 h时生物量、油脂产量、EPA占总脂肪酸的百分含量和EPA产量分别达到56.60 g/L、9.62 g/L、12.50%和1.14 g/L,TFAs中EPA的百分含量和产量分别是优化前的14.5倍和6.1倍。该发酵策略为裂殖壶菌高产EPA提供了新的研究思路,且温度和溶氧胁迫下的脂肪酸变化情况分析为解析裂殖壶菌中脂肪酸的合成途径提供了理论依据。接下来可结合动力学分析,深入研究裂殖壶菌发酵动态变化,可进一步明确发酵过程中的原料和产物的转化率和物得率与培养条件之间的动态变化,为其产业化体系建立提供更为深入的理论依据。
