脑深部电刺激术对帕金森病病人脑神经功能、脑血管储备能力、神经电生理的影响
2022-01-27成宜舜栾丽芹张克忠
成宜舜,栾丽芹,李 奇,张克忠
帕金森病(Parkinson′s disease,PD)是以强直、运动迟缓、震颤、认知功能改变、步态姿势异常、抑郁等为主要表现的神经系统变性疾病,在我国65岁以上老年人中患病率为1.7%,目前尚缺乏特效疗法,是临床治疗难点之一[1]。经典PD病理学说认为,黑质多巴胺神经元缺失是造成PD运动迟缓等症状重要原因,故口服多巴胺类药物是治疗PD的常用方法,但长久服用可诱发运动症状波动、异动症,因此,临床期待可增强疗效、减少不良反应的新型疗法[2]。脑深部电刺激术(deep brain stimulation,DBS)是近年来神经外科发展较快的一种新技术,主要通过脑内特定靶点植入刺激电极进行高频电刺激,改变相应核团兴奋性,调节异常神经环路,以往研究已证实DBS可改善PD运动症状,但具体作用机制尚不清楚,且对脑神经功能的影响尚存在争议[3]。本研究选取180例PD病人,从脑神经功能、脑血管储备能力、神经电生理等方面分析DBS的应用价值。现报道如下。
1 资料与方法
1.1 一般资料 选取2017年3月—2019年2月南通大学附属南京江北人民医院收治的180例PD病人,随机分为观察组与对照组,各90例,两组性别、年龄、病程、体质指数、既往脑卒中史、饮酒史、吸烟史、Hoehn-Yahr分级、临床症状分型、合并疾病等比较,差异均无统计学意义(P>0.05),详见表1。本研究获得我院伦理委员会批准。

表1 两组临床资料比较
1.2 纳入标准 符合PD诊断标准[4];对多巴胺治疗有效,但随病程推进,增加药物剂量仍无法有效控制症状者;病人或家属自愿签署知情同意书;无头颅占位性病变;无痴呆;Hoehn-Yahr分级≥Ⅱ级。
1.3 排除标准 合并严重焦虑症、抑郁症;有出血倾向;不能耐受麻醉者;未控制严重高血压;PD叠加综合征;合并严重心、肺、肾疾病,不能耐受手术者。
1.4 方法
1.4.1 对照组 予以药物治疗。左旋多巴(广东闰宝药业有限公司生产,国药准字H44023907),起始剂量为每次250 mg,每日2~4次,餐后口服,后期每隔3~7 d增加1次剂量,增加量为每日125~750 mg,视病人耐受情况与疗效调整。每日最大量6 g,分4~6次服用。观察周期为3个月。
1.4.2 观察组 在对照组基础上加用DBS治疗。①仪器及设备:1.5 T核磁共振仪(德国Siemens);CRW-FN立体定向头架与定向仪(德国Siemens);Electrode Model 3389颅内植入电极(Medtronic DBS);Activa Model 7428胸部植入脉冲发生器单通道或双通道(Medtronic DBS)。②手术方法:术前12 h停服PD药物,术前1 h局部麻醉状态下安装立体定向头架,实施磁共振成像(MRI)扫描,磁共振T2加权成像(T2W-MRI)1∶1比例以图像直接定位与坐标值定位方法,确定靶点坐标。靶点选取丘脑底核背外侧部,相对于立体定向头架坐标值分别于前联合-后联合(AC-PC)平面下2 mm与4 mm横断位、垂直于AC-PC中点后2 mm冠状位、正中轴位图像上计算,最终解剖定位坐标为计算的平均值。局部麻醉,经额部中线旁3 cm做头皮切口3 cm左右,冠状缝前钻颅,探查选取脑皮层穿刺点,立体定向仪根据预计算靶点坐标调校,连接头架基座与已确定坐标值的立体定向仪,穿刺针对准穿刺点,旋紧螺丝,再次比对坐标,双人校对,确认坐标正确后根据坐标值穿刺,停止穿刺标准为带针芯外套管送入靶点上方10 mm位置,取下针芯,植入电极至靶点位置,固定电极,测试,观察微毁损效应、刺激效果、副作用,电极另一端予以保护后埋于皮下,头皮切口临时全层缝合,复查MRI,完全显示丘脑底核、电极触点间相对位置,排除颅内出血,测量电极实际位置与目标位坐标,确保与原靶点偏差<2 mm,否则重新调整定向仪、穿刺、植入、测试。确认靶点正确,初步测试效果良好,全身麻醉,经右锁骨下皮下植入脉冲发生器,并以导线皮下连接脑内植入电极(一期植入)。若遇术中无法观察效果、全身麻醉前伴有言语障碍和嗜睡等异常、术中发现刺激效果不明确时,则考虑行二期手术植入脉冲发生器和连接皮下导线,将植入电极妥善固定于头皮下,接外接导线经皮下隧道从手术切口旁戳孔引出,固定,消毒,3~7 d后开启临时脉冲发生器,刺激4~14 d,待观察到明显效果后再植入脉冲发生器。③术后处理:术后麻醉期后可即刻恢复术前药物治疗,拆线后可出院,一般于术后4周左右开机,开机时电压由低至高逐渐上升,单极刺激,脉宽60 μs,频率160 Hz,逐一测试各触点,至病人出现最初轻微头晕、闪光感、持续对侧肢体麻木等,出现副作用的最低电压与最佳刺激电压予以记录,根据记录数据综合选取治疗电压最低、效果最明显、副作用电压最高触点作为最终刺激触点,设置恰当参数,开机后再根据病人具体情况调整参数,一般术后6个月内调整3~5次。观察周期为3个月。
1.5 观察指标
1.5.1 日常生活能力、运动功能评定 分别于治疗前、治疗3个月后采用统一帕金森病评定量表(UPDRS)评定[5],主要评定病人UPDRS第2部分(UPDRS Ⅱ)日常生活活动能力(条目5~条目17,0~4分评分)、第3部分运动能力(UPDRS Ⅲ,条目18~条目31,0~4分评分)运动能力,分值越高,对应功能越差。
1.5.2 脑神经认知损害程度评定 分别于治疗前、治疗3个月后采用简易智力状态检查量表(MMSE)评价,包含视空间、语言能力、延迟回忆、计算力、时刻记忆、地点定向力、时间定向力维度,分值越高,脑神经认知功能越佳,组内相关系数为0.99,可信度良好。
1.5.3 脑血管储备能力评价 采用经颅多普勒超声检测,仰卧位,病人平静呼吸5 min后,经颞窗放置2 MHz脉冲波探头,获得大脑中动脉(MCA)信号后,记录双侧MCA多普勒频谱,固定探头位置不变,嘱病人正常呼吸后屏气10~30 s,记录屏气末MCA多普勒频谱,两侧MCA各行一次屏气试验,两侧屏气试验时间间隔>10 min,测量收缩期峰值速度(Vs)、舒张期速度(Vd),计算大脑中动脉平均血流速度(Vm)、屏气指数(BHI),Vm=(Vs+2Vd)/3,BHI=[(屏气后Vm-屏气前Vm)/屏气前Vm×100]/屏气时间。
1.5.4 神经电生理检查 应用肌电诱发电位仪,于22~25 ℃、安静环境独立检查室内进行检查,均实施双侧上下肢运动神经末梢潜伏期、波幅及感觉神经传导速度、感觉神经末梢波幅检测,各检测数据取左右两侧神经平均值[6]。
1.5.5 不良反应发生情况 比较两组治疗前、治疗3个月后应用药物剂量变化及不良反应发生率。

2 结 果
2.1 两组治疗前后日常生活活动能力、运动能力比较 治疗前,两组UPDRSⅡ、UPDRSⅢ评分比较差异均无统计学意义(P>0.05);治疗3个月后,两组UPDRSⅡ、UPDRSⅢ评分均较治疗前降低,且观察组低于对照组,差异均有统计学意义(P<0.05)。详见表2。
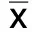
表2 两组治疗前后日常生活活动能力、运动能力比较(±s) 单位:分
2.2 两组治疗前后MMSE评分比较 两组治疗前MMSE各维度评分比较差异均无统计学意义(P>0.05);观察组治疗3个月后延迟回忆评分高于对照组(P<0.05),两组治疗3个月后视空间、语言能力、计算力、时刻记忆、地点定向力、时间定向力评分比较差异均无统计学意义(P>0.05)。详见表3。
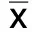
表3 两组治疗前后MMSE评分比较(±s) 单位:分
2.3 两组治疗前后脑血管储备能力比较 治疗前,两组Vm、BHI比较差异均无统计学意义(P>0.05);治疗3个月后,观察组屏气后Vm、BHI高于对照组(P<0.05)。详见表4。
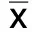
表4 两组治疗前后脑血管储备能力比较(±s)
2.4 两组治疗前后神经电生理检查指标比较 治疗前,两组运动神经末梢潜伏期、波幅及感觉神经传导速度、感觉神经末梢波幅比较差异均无统计学意义(P>0.05);治疗3个月后,两组运动神经末梢潜伏期较治疗前缩短,运动神经末梢波幅、感觉神经传导速度较治疗前升高,差异均有统计学意义(P<0.05);观察组治疗3个月后运动神经末梢潜伏期短于对照组,运动神经末梢波幅、感觉神经传导速度高于对照组,胫神经、腓总神经感觉神经末梢波幅低于对照组,差异均有统计学意义(P<0.05)。详见表5、表6。
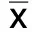
表5 两组运动神经末梢潜伏期、波幅比较(±s)
表6 两组感觉神经传导速度、感觉神经末梢波幅比较(±s)
2.5 两组左旋多巴药物剂量变化及不良反应发生率比较 两组左旋多巴初始药物剂量比较差异无统计学意义(P>0.05);观察组治疗3个月后药物剂量低于对照组(P<0.05);观察组不良反应发生率(2.22%)低于对照组(11.11%),差异有统计学意义(P<0.05)。详见表7。
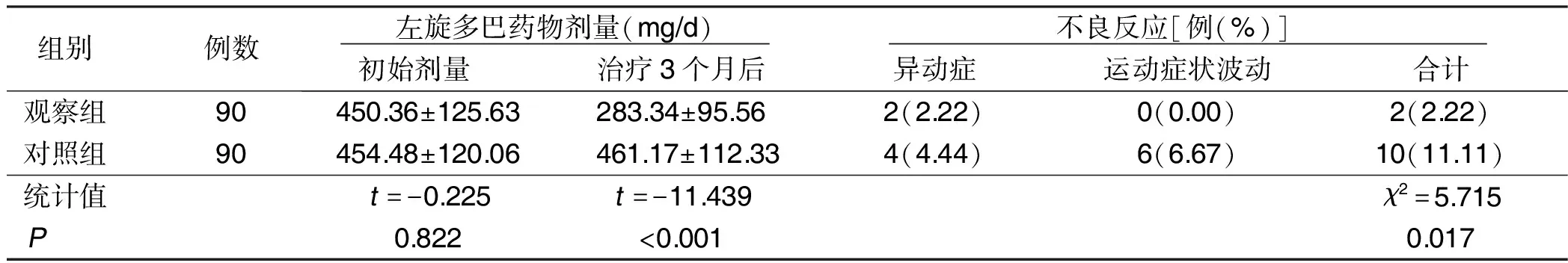
表7 两组左旋多巴药物剂量变化及不良反应发生率比较
3 讨 论
PD发病机制尚未完全明确,好发于中老年人群,随着老龄化进展,其发病人数急剧增加,调查显示,我国PD病人占世界PD病人的50%左右,且人均经济负担为7 679元/年,给社会带来沉重负担[7]。本研究结果显示,观察组治疗3个月后UPDRS Ⅱ、UPDRS Ⅲ评分低于对照组,与张学君等[8]报道相符,佐证了DBS可改善PD病人运动能力与日常生活活动能力。DBS通过立体定向方法进行准确定位,在脑内特定靶点植入刺激电极,通过刺激发生器刺激脑神经核团或神经传导束来调节异常神经环路,从而起到抗PD作用,改善病人运动能力与日常生活活动能力。一项Meta分析发现,DBS可明显减少PD病人运动障碍不良事件发生[9],本研究观点与之相似。认知障碍是PD病人最重要且最常见的非运动症状之一,但DBS术对PD病人认知功能的影响存在较大争议[10-12]。沈博等[13]研究发现,DBS可引起PD病人执行功能及言语流畅性下降,可能与病人自身疾病进展有关。黄星星等[14]指出,DBS术对病人认知功能无明显影响。本研究结果显示,DBS术不影响病人视空间、语言能力、计算力、时刻记忆、地点定向力、时间定向力评分,与黄星星等[14]报道相符,提示DBS术应用于PD病人具有可行性。本研究发现,DBS能改善PD病人延迟回忆,但这一结果仍需后续进一步验证。
脑血管储备是指脑血管通过毛细血管、小动脉代偿性扩张或收缩、开放侧支循环、调节脑血流等适应脑功能的能力。健康人群屏气后,MCA血流阻力降低,血流速度加快,血流量增加,提示脑血管储备能力良好[15-16]。既往研究认为,PD除累及蓝斑、黑质外,亦损害丘脑下部、交感神经节、迷走神经背核、肾上腺髓质,故与健康人群相比,PD病人脑血管储备功能受损[17]。且左旋多巴等抗PD药物亦可能损害自主神经功能,从而影响心血管功能,导致血流重新分布,脑动脉扩张失代偿,无法恢复至维持有效脑灌注[18-19]。本研究结果显示,DBS术可改善PD病人脑血管储备功能,有利于改善病人脑部血流灌注,这可能是DBS改善病人延迟回忆的一个机制。
传统诊断与评估PD以四大运动症状为主要依据,而近年来研究发现,在出现运动症状之前,脑内神经组织已开始出现病理变化,黑质中多巴胺神经元已开始凋亡,病人即出现非运动症状,包括感觉障碍、自主神经障碍、认知功能、神经精神症状等,这是PD病人在运动症状改善后,仍饱受疾病影响、生存质量较低的一个原因[20-23]。国外有资料显示,与健康人群相比,PD病人感觉神经传导速度减慢、波幅下降,运动神经末梢潜伏期延长、波幅降低,存在周围神经损害[24]。本研究发现,口服左旋多巴药物可一定程度损害PD病人周围神经功能,可影响运动神经末梢潜伏期等。而DBS可改善病人周围神经损害程度,减轻药物对周围神经的影响,并能降低抗PD药物应用剂量,减少不良反应的发生。本研究为回顾性研究,数据可能存在一定偏倚,有待后续多中心、随机对照研究证实。
综上所述,DBS治疗帕金森,可改善病人运动能力,提高病人日常生活活动能力、脑血管储备功能,改善周围神经损害程度,减少抗PD药物应用剂量与不良反应的发生,改善延迟回忆,对其他认知功能领域无明显影响。
