高盐废水回用于脱硫系统对脱硫性能影响的实验研究
2022-01-26马双忱龚春琴樊帅军
马双忱, 李 洋, 辜 涛, 龚春琴, 何 川, 樊帅军, 徐 昉
(1.华北电力大学 环境科学与工程系,河北保定 071003; 2.阜阳华润电力有限公司,安徽阜阳 236000)
在《水污染防治行动计划》(简称“水十条”)规定的各类高耗水行业中,电力行业排在第一位。电力行业主要用水为发电用水、脱硫用水、煤场用水、供热耗水和循环冷却水等[1]。根据“水十条”的要求,在役电厂应逐渐增大再生水比例,根据工艺特点对废水进行回收和利用,以提高水的重复利用率。火电厂脱硫系统工艺用水占全厂用水比例较大,以石灰石/石灰为脱硫吸收剂的湿法脱硫对脱硫工艺用水并无严格要求,不需要使用严格处理的高纯水。将废水经简单处理回用于脱硫系统,很大程度上能够提高电厂水资源的综合利用率,实现电厂水的梯级利用。部分电厂已有将工业废水或其他含盐废水回用于脱硫系统工艺水的应用[2],但关于含盐废水对脱硫系统性能造成的影响方面的研究却较少。溶解型盐分遇酸形成可溶性盐,影响SO2与CaCO3之间的反应,并影响石膏晶体的生成[3]。笔者从脱硫效率、石膏品质、溶液黏度和石灰石活性等角度分别阐述高盐废水回用对脱硫性能的影响,为高盐废水回用提供技术指导。
1 高盐废水对脱硫效率的影响
1.1 实验装置
为研究盐分离子对脱硫效率的影响,笔者模拟电厂脱硫系统(FGD),设计了小型鼓泡实验台进行实验。图1为实验系统图。实验系统的核心反应器为鼓泡反应瓶,采用LZB-3WBF转子流量计控制SO2和N2体积流量。利用DF-101S恒温加热磁力搅拌器维持浆液温度为50 ℃左右。混合气体进入鼓泡反应瓶内进行脱硫反应,出口烟气通过浓硫酸酸洗后,由烟气分析仪(EN2)记录其质量浓度。在线pH计实时记录浆液pH值。实验过程还会用到GM-0.20隔膜真空泵、蠕动泵驱动器、四口烧瓶(500 mL)、洗气瓶、干燥瓶、移液管、锥形瓶、烧杯等设备或器材。
1.2 结果与分析
1.2.1 不同NaCl浓度对脱硫效率的影响
为了研究NaCl浓度对脱硫效率的影响,在含有0.15 g CaCO3的150 mL去离子水中,加入浓度分别为0 mol/L、0.05 mol/L、0.5 mol/L、1 mol/L、2 mol/L的NaCl于容积为500 mL的四口烧瓶内,控制进口的SO2质量浓度为2 600 mg/m3,SO2气体体积流量为2 L/min,进行脱硫效率实验,结果如图2和图3所示。
由图2可以看出,当不添加任何盐分时,浆液pH呈现较快的下降趋势,加入NaCl后,浆液pH的下降趋势变缓,可见NaCl对酸有一定的缓冲性。
由图3可以看出,加入不同浓度的NaCl后,脱硫效率均提高。在所设计的浓度范围内,随着NaCl浓度的增加,促进效果先增强再减弱。在相同时刻,当NaCl浓度为0.5 mol/L时,出口SO2质量浓度最低,脱硫效果最好。

图2 不同NaCl浓度下浆液pH随反应时间的变化

图3 不同NaCl浓度下出口SO2质量浓度随时间的变化
1.2.2 不同盐分对脱硫效率的影响
为了研究不同盐分对脱硫效率的影响,在含有2 g CaCO3的250 mL去离子水中,分别加入1 mol/L相同浓度的NaCl、NaNO3、Na2SO4、MgCl2和CaCl2于容积为500 mL的四口烧瓶内,水浴恒温50 ℃,用做脱硫浆液,通过空气和SO2控制进口烟气SO2质量浓度为4 000 mg/m3。随着SO2不断进入反应烧瓶,实验结果如图4~图6所示。

图4 不同钠盐对石灰石浆液pH的影响
由图4可以看出,Na2SO4对石灰石浆液pH的缓冲能力优于NaCl。加入NaCl和NaNO3后,随着反应的进行,石灰石浆液pH变化接近。

图5 不同盐分对石灰石浆液pH的影响
由图5可以看出,不同盐分对石灰石浆液pH的影响不同,其中加入钠盐会使石灰石浆液pH下降过程变慢,且Na2SO4比NaCl效果更好。随着SO2的不断加入,过量钙盐会使石灰石浆液pH瞬间下降至5,这是因为溶解性的CaCl2过多,溶液中Ca2+含量饱和,抑制CaCO3离解,当浓度达到动态平衡时,石灰石浆液pH缓慢下降。整体上可以看出,除了CaCl2外,加入的其他盐分在一定程度上均能有效缓冲石灰石浆液pH值下降,增强石灰石浆液对酸的缓冲性,使石灰石浆液在一定时间内维持相对较高的pH,进而促进SO2传质吸收。实验结论与文献[4]和文献[5]中的结论一致。
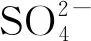

图6 不同盐分对出口SO2质量浓度的影响
(1)

(2)
同时纯水体系加入电解质盐分后,接纳质子的能力增强,其缓冲性有所提高,根据水分子微观的结构制造和结构破坏经典理论,盐分离子会对水分子的偶极矩与水分子的偶极角形成强烈的紊乱[6],由目前的研究尚不完全清楚哪个离子是更大的水结构影响者。文献[7]~文献[9]中指出钠盐和镁盐在石灰石脱硫过程中,可作为无机添加剂促进脱硫,这与本实验结果得出的结论相同,Na2SO4脱硫效果最好,其次是镁盐,最后是钙盐,1 mol/L的CaCl2与不加任何盐的除盐水的脱硫效率基本相当。
1.2.3 电厂不同废水
取某电厂三联箱加酸调质前的出水(即脱硫废水)、循环冷却排污水、除盐水与脱硫效果最佳的Na2SO4进行脱硫效率对比,结果如图7所示。

图7 不同废水对出口SO2质量浓度的影响
由图7可以看出,加入脱硫废水后,因为脱硫废水取自三联箱后加酸调质前,其pH高达12,在前15 min内,脱硫效率接近100%,随着SO2的不断加入,出口SO2质量浓度略微增加。实验表明,脱硫废水和循环冷却排污水的脱硫效率均优于不加任何盐分的石灰石浆液。由于电厂废水中盐分浓度远低于上述实验盐分浓度,因此含盐废水回用于FGD时,从SO2吸收传质的角度看基本不会抑制脱硫效率。
2 高盐废水对石膏品质的影响
石灰石/石膏湿法FGD工艺中,石灰石浆液在吸收塔内对烟气进行洗涤,烟气中的SO2与溶解的石灰石中Ca2+反应,生成的CaSO4·1/2H2O以小颗粒状转移到浆液中,利用空气将其强制氧化生成CaSO4·2H2O,即石膏晶体。石膏是石灰石-石膏湿法脱硫的主要副产物,2020年我国脱硫石膏年产量达到1亿t[10]。石膏可作为水泥缓释剂、建筑装修材料、工业原材料、土壤改性剂,也可用于食品和医疗等领域[11],因此有必要研究高盐废水回用后对石膏晶体形貌的影响。
2.1 石膏样品制备
取电厂三联箱后未加酸调质前的脱硫废水上清液进行水质含量测定,阳离子质量浓度采用ICP测出,主要阴离子质量浓度用离子色谱测出。测试结果见表1。

表1 某电厂实际脱硫废水水质
样品制备方法如下:在500 mL烧瓶内,取2 g CaCO3于500 mL除盐水中,在图1实验系统装置内进行脱硫效率实验。实验结束后,用SHD-Ⅲ型循环水式多用真空泵抽滤反应浆液,将得到的湿样品放在烘箱(45±3 ℃)内烘干至恒重,得到不加任何盐的1号脱硫石膏样品。
按表2中盐分种类和浓度,根据1号脱硫石膏样品的制备方法,分别进行脱硫实验,得到2~8号脱硫石膏样品。

表2 脱硫石膏样品
2.2 石膏品质分析
2.2.1 石膏晶体扫描电子显微镜(SEM)分析
SEM主要利用二次电子信号成像来观察样品的表面形态,理想的石膏晶体形貌为斜方晶体,其长宽比为2~3,比表面积大且脱水性能优良。石膏晶体粒径的大小对石膏的含水率有较大影响。同等情况下,石膏晶体的粒径越大,其脱水性能越好,石膏含水率越低;反之,石膏晶体的粒径越小,其脱水性能越差,石膏含水率越高。以此可以判断石膏品质好坏。
(1) 1号石膏样品分析
从图8可以观察到,1号石膏晶体形貌粒径差距较大,大颗粒粒径分布在50~100 μm,小颗粒粒径主要在5 μm左右,颗粒紧密、无规律、没有明显的晶体生长痕迹。

(a) 放大1 000倍的石膏晶体

(b) 放大10 000倍的石膏晶体
(2) 2号石膏样品分析
从图9可以观察到,2号石膏晶体有部分杂盐微小晶体,晶体形状整体较均匀,晶体形貌呈块状。

(a) 放大1 000倍的石膏晶体

(b) 放大10 000倍的石膏晶体
晶体粒径主要在40~60 μm,小的粒径主要在5 μm左右。
(3) 3号石膏样品分析
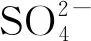

(a) 放大1 000倍的石膏晶体

(b) 放大10 000倍的石膏晶体
(4) 4号石膏样品分析
从图11可以观察到,4号石膏晶体与3号相比有较多杂盐微小晶体,晶体形状不均匀,且有大量不成形的小晶体。分析原因为溶液中加入了大量MgCl2,Mg2+的加入影响了石膏晶体的形态,降低了石膏的脱水性能,使石膏晶体由柱状的斜方体晶形转为难以脱水的微型杂晶。Mg2+会对石膏晶体形貌产生影响,文献[13]中也得出了类似结论。

(a) 放大1 000倍的石膏晶体

(b) 放大10 000倍的石膏晶体
(5) 5号石膏样品分析
从图12可以观察到,晶体粒径分布不均,大颗粒粒径主要分布在40~60 μm,小颗粒粒径主要分布在5~10 μm。无水CaCl2具有吸水特性,与水发生式(3)的反应。

(3)
加入过量CaCl2后,浆液中的Cl-与浆液中的Ca2+反应生成性质稳定的CaCl2·6H2O,锁住石膏中的水分,使石膏中水分增加。石膏晶体分子间的CaCl2阻止了游离水与石膏晶体的分离,使得石膏无法高效脱水。大量的Cl-会使大的石膏晶体在不饱和条件下较快溶解而生成大量的细小结晶体[14],所以表面有大量细晶,晶型生长受阻。

(a) 放大1 000倍的石膏晶体

(b) 放大10 000倍的石膏晶体
(6) 6号石膏样品分析
从图13可以观察到,颗粒粒径主要在50 μm以上,晶体生长趋势较好,结构紧凑,晶体与晶体之间空隙小,其表面附着了少量直径在3~5 μm的杂质颗粒。

(a) 放大1 000倍的石膏晶体

(b) 放大10 000倍的石膏晶体
(7) 7号石膏样品分析
从图14可以观察到,颗粒粒径主要在50 μm以上,晶体生长痕迹明显,以片状形式堆叠生长,结构紧凑,晶体与晶体之间空隙小,在其表面附着粒径为2~3 μm的杂质颗粒。

(a) 放大1 000倍的石膏晶体

(b) 放大10 000倍的石膏晶体
(8) 8号石膏样品分析
从图15可以观察到,8号石膏晶体粒径小、晶型致密呈晶簇状,且其晶簇呈开放多孔,受压易破碎。分析可能由于燃煤机组启动过程中没控制好浆液本体重金属等杂质含量、pH、浆液密度、吸收塔液位、氧化风量和烟气中粉尘含量等因素,导致脱硫石膏在形成过程中生成层状和针状晶体,其形貌发展成扁平、颗粒或孔洞等畸形。这样的石膏晶体难以长大,同时还含有超标CaSO3·1/2H2O晶体,导致生成的石膏黏性大且难以脱水。
2.2.2 石膏晶体X射线能谱(EDS)定量
EDS定量分析通过X射线强度来获取组成样品材料的各种元素的质量分数。通过分析不同区域的元素质量分数,希望找出杂晶、细晶中包含的元素成分以及产生这种现象的原因。
样品EDS区域对比结果:在图16中选取8号样品中杂晶较多的区域一(8-a)与3号样品中结晶较为齐整的区域二(3-b)进行EDS元素分析,结果见表3。从表3可知,元素质量分数差别较大,如S、Al、Si等。对比不规则的部分与结晶规则的部分可以得出:石膏结晶不规则与杂质元素含量有很大关系,杂质元素的包裹、覆盖导致石膏晶体难以成型、长大,最终造成石膏脱水困难。

(a) 放大1 000倍的石膏晶体

(b) 放大10 000倍的石膏晶体

(a) 8-a

(b) 3-b
2.3 石膏晶体形貌情况整体分析
3号Na2SO4石膏晶体形貌最好,晶粒大小较均匀,杂晶很少。不加任何盐的1号石膏晶体形貌细碎、杂晶多,晶体生长受阻,分析主要是CaSO3·1/2H2O过多造成的。8号石膏晶体形貌呈现碎片化,能够成形的晶体不多,最终导致成晶概率太小。6号和7号石膏晶体生长痕迹明显,以堆叠形式生长,结构紧凑,晶体与晶体之间空隙小,在其表面附

表3 石膏样品EDS元素分析结果
着少量直径为2~5 μm的杂质颗粒。
3 高盐废水对浆液黏度的影响
吸收塔浆液起泡而导致的浆液溢流是脱硫系统常见的问题。沈峥等[15]认为影响浆液起泡特性的因素有溶液浓度、表面张力和表面黏度。溶液浓度会影响起泡能力,浓度越高,越易起泡,而表面张力和表面黏度等因素会影响泡沫稳定性。曲彦平等[16]通过建立物理模型,研究表面黏度对泡沫稳定性的影响,结果表明随着表面黏度的增大,液膜破裂速度越慢,泡沫越稳定。
3.1 浆液表面黏度对传质的影响
浆液表面黏度影响扩散和传质的原因是浆液表面黏度大会导致气泡直径变大,小气泡更易聚集成大气泡,很难分散开,导致含气率下降,气液接触面积变小,即传质面积减小,传质阻力增大,导致传质效率降低。利用Wike-Chang公式(式(4))估算稀溶液(溶质A+溶剂B)的扩散系数DAB,进而分析传质阻力:
(4)
式中:T为溶液的温度,K;η为溶剂B的动力黏度,Pa·s;MB为溶剂B的摩尔质量,kg/kmol;φ为溶剂的缔合参数,水的缔合参数具体值为2.6;Vm,A为溶质A在正常沸点下的摩尔体积,cm3/mol。
由式(4)可知,扩散系数与浆液表面黏度成反比,随着浆液表面黏度的增大,其扩散系数减小。
气膜和液膜传质系数Kg、Kl分别由式(5)和式(6)计算:
Kg=Dg/δg
(5)
Kl=Dl/δl
(6)
式中:Dg、Dl分别为气膜和液膜的扩散系数;δg、δl分别为气膜和液膜厚度。
对于湿法脱硫而言,按双膜理论分析,液膜阻力是传质的主要阻力,克服液膜阻力需要增加气液接触面积,根据式(5)可知,扩散系数增大,传质系数也增大,进而影响SO2传质效率,使SO2传质系数也增大。
据此进行加入不同盐分对浆液表面黏度影响的实验,分析其对脱硫系统传质的影响。采用NDJ-5S新型数字旋转黏度计,测定牛顿型液体的绝对黏度或非牛顿型液体的表观黏度。
3.2 结果与讨论
3.2.1 加入不同氯化物对浆液表面黏度的影响
配制浓度为0.1 mol/L、0.5 mol/L、1 mol/L、2 mol/L、3 mol/L和4 mol/L的NaCl、KCl、CaCl2、MgCl2,每组浓度重复进行3组实验,结果取平均值。图17给出了浆液表面黏度与加入的氯化物浓度的关系曲线。从图17可以看出,对于加入碱金属后的浆液表面黏度,钾离子小于钠离子;对于加入碱土金属后的浆液表面黏度,钙离子小于镁离子。随着盐分离子浓度增加,加入二价镁盐后的浆液表面黏度增加趋势远大于加入一价氯盐后。此结论与文献[17]中的结论一致。

图17 浆液表面黏度随氯化物浓度的变化曲线
3.2.2 加入不同氟化物对浆液表面黏度的影响
配制浓度为0.1 mol/L、0.5 mol/L、1 mol/L、2 mol/L、3 mol/L、4 mol/L的NaF、CaF2和MgF2,重复进行3组实验,结果取平均值。图18给出了浆液表面黏度与氟化物浓度的关系曲线。从图18可以看出,加入氟化物后的浆液表面黏度总体变化趋势不大,这是因为氟化物属于易溶解盐,且其盐分溶解度大,随着浓度的增大,CaF2、NaF对浆液表面黏度改变甚小。加入MgF2的浆液表面黏度随盐分浓度的增加略微增加。氟化物对浆液表面黏度的影响总体上小于氯化物。

图18 浆液表面黏度随氟化物浓度的变化曲线
从实验结果可以看出,所研究的盐分种类中,随着盐分浓度的增加,加入镁盐的浆液表面黏度变化最大,其次是加入钙盐的溶液,加入钠盐的溶液和加入钾盐的溶液对浆液表面黏度的影响较小,对于脱硫系统回用水质,电厂应重点控制镁盐浓度低于1 mol/L。
4 高盐废水回用对石灰石活性的影响
石灰石活性表示石灰石在一种酸性条件下的转化特性,是衡量脱硫性能的一个重要指标,石灰石活性对石灰石转化率和溶解度起着决定性作用,并且会影响吸收塔pH、吸收剂利用率以及脱硫效率。许多学者在提高石灰石利用率方面开展了广泛的研究。但有关高盐废水对石灰石转化率的研究较少。根据DL/T 943—2015 《烟气湿法脱硫用石灰石粉反应速率的测定》中的测定方法,配置不同盐分浓度的浆液,判断其对石灰石溶解速率的影响。
石灰石转化率采用式(7)计算:
(7)
式中:X(t)为t时刻石灰石转化率;c(HCl)为盐酸的浓度,取0.1 mol/L;V(HCl)为滴定所消耗盐酸的体积,mL;m为石灰石粉的质量,取0.150 g;w(CaCO3)为石灰石粉中CaCO3的质量分数;w(MgCO3)为石灰石粉中MgCO3的质量分数;Mr(CaCO3)为CaCO3相对分子质量;Mr(MgCO3)为MgCO3相对分子质量。
4.1 MgCl2对石灰石溶解的影响
向石灰石浆液中加入不同浓度MgCl2,记录盐酸消耗量和pH的变化,计算不同时刻下石灰石的转化率,结果如图19所示。从图19可以看出,随着MgCl2浓度增加,盐酸消耗量呈正相关增加,石灰石转化率下降。同一反应时间条件下,如8 min时加入0.1 mol/L的MgCl2,石灰石转化率已达80%,而加入1.5 mol/L的MgCl2,石灰石转化率仅20%左右。MgCl2浓度对石灰石转化率影响较大,从实验结果看,为保证石灰石转化率达到80%,应控制MgCl2浓度不超过0.5 mol/L。
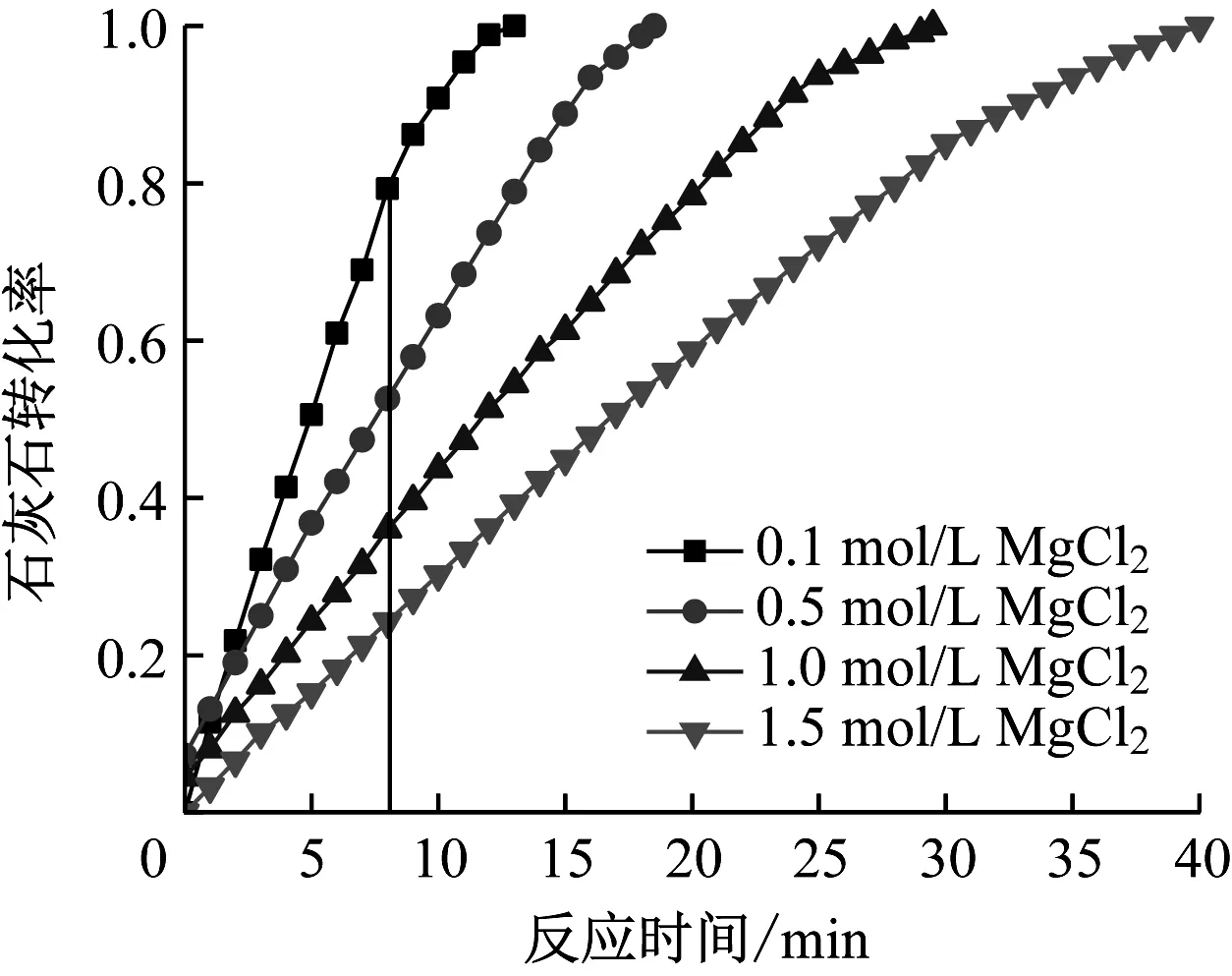
图19 不同MgCl2浓度下石灰石转化率


图20 不同MgCl2浓度下pH的变化趋势
4.2 CaCl2对石灰石溶解的影响
向石灰石浆液中加入不同浓度CaCl2,记录盐酸消耗量和pH的变化,计算不同时刻下石灰石的转化率,结果如图21所示。从图21可以看出,随着CaCl2浓度的增加,盐酸消耗量增加,石灰石转化率逐渐下降。同一反应时间条件下,如8 min时加入0.5 mol/L的CaCl2,石灰石转化率已达90%,而加入3 mol/L的CaCl2,石灰石转化率仅30%左右。

图21 不同CaCl2浓度下石灰石的转化率
为保证石灰石转化率达到80%,应控制CaCl2浓度不超过1.5 mol/L。
图22给出了不同CaCl2浓度下浆液pH的变化趋势。从图22可以看出,CaCl2浓度越高,pH到达稳定所用时间越长,分析原因可能是CaCl2浓度增加时,氯化物主要以CaCl2形式溶解于浆液中,Ca2+浓度增大,由于同离子效应,将会抑制CaCO3的溶解,降低液相碱度,从而导致石灰石转化率降低。
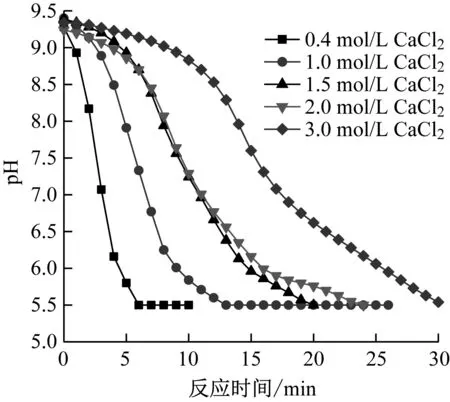
图22 不同CaCl2浓度下pH的变化趋势
4.3 NaCl对石灰石溶解的影响
加入不同浓度NaCl,盐酸消耗量和石灰石转化率随时间的变化见图23和图24。由图23和图24可以看出,随着NaCl浓度的增加,在相同时间里盐酸消耗量减少,石灰石转化率增大。同一反应时间,如8 min时加入2.5 mol/L和3 mol/L NaCl,石灰石已完全溶解;而加入0.5 mol/L的NaCl,其石灰石转化率为50%左右。从实验结果看,反应溶液中NaCl浓度越高,越能促进石灰石的溶解。分析原因可能是Na+对石灰石溶解有促进作用。


图23 不同NaCl浓度下盐酸消耗量

图24 不同NaCl浓度下石灰石转化率
5 结 论
(1) 根据实际电厂废水盐分浓度远低于实验盐分浓度,从SO2吸收传质的角度看,高盐废水回用基本不会抑制烟气脱硫效率。相反钠盐、镁盐还会促进SO2传质,提高脱硫效率。
(2) 增加单种盐分后的脱硫石膏晶体形貌品质比不加盐的更好。
(3) 从盐分黏度影响气液传质系数的角度看,脱硫系统应首先控制镁盐浓度,最好低于1 mol/L。
(4) 浆液中的盐分NaCl能够促进石灰石溶解,而MgCl2和CaCl2对石灰石的溶解具有抑制作用,不同盐分的作用效果差异较大。
