郑品麦24 号的遗传构成及重要性状功能基因组成解析
2022-01-26陈晓杰范家霖杨保安张福彦程仲杰王嘉欢白鹤峰张建伟
陈晓杰,范家霖,杨保安,杨 科,张福彦,程仲杰,王嘉欢,白鹤峰,张建伟
(1. 河南省科学院同位素研究所有限责任公司/河南省核农学重点实验室,河南 郑州 450015;2. 郑州市农业技术推广站,河南 郑州 450006;3. 河南金苑种业股份有限公司,河南 郑州 450001)
小麦(Triticum aestivumL.)是我国主要的粮食作物之一,其产量对我国粮食安全具有举足轻重的作用。在人口不断增长、耕地难以增加、水资源不足、突发性极端天气增多及病虫害频发等因素的制约下,要满足人们对小麦日益增长的需求,提高小麦单产是重要且有效的途径。小麦品种更新对于单产的提高具有重要作用,研究认为,优良品种对提高产量的贡献率超过1/3[1‐2]。因此,不断培育高产、稳产、广适小麦新品种才能为小麦持续增产提供保障。准确掌握小麦品种的特征特性、遗传构成将有助于其遗传改良和栽培推广。早期,育种家常常利用系谱、形态和生理生化性状等来分析小麦品种的亲缘关系和遗传基础[3‐4]。由于人工选择强烈参与到新品种选育的过程,亲本的遗传物质在后代育成品种中往往发生较大偏分离。因此,通过系谱分析、形态和生理生化性状分析不能完全准确地反映品种间的亲缘关系。随着分子生物学的发展,研究者开始从分子水平上研究生物之间的亲缘关系,利用各种分子标记技术对小麦亲本及衍生品种的遗传结构进行解析[5‐8]。
随着小麦参考基因组序列测定的完成和不断深入,越来越多的小麦重要性状相关基因被定位或克隆,为育种家了解各小麦品种的重要性状基因组成提供了依据,为将来分子设计育种提供了支持。KASP(Kompetitive allele‐specific PCR)技术是由英国LGC 公司开发的新一代SNP(Single nucleotide polymorphism)检测技术,具有准确性高、位点适应性强、高通量、成本低等优势[9]。目前,KASP 标记已在分子辅助育种、QTL 定位、亲本品种鉴定及大规模样本筛选等方面得到应用[10‐11]。中国农业科学院作物科学研究所何中虎研究员团队开发的小麦50K SNP育种芯片不仅标记数量多、分布较均匀,而且包括上百个株高、粒质量、品质、春化、光周期、开花、抗病、抗逆等相关基因等位变异的KASP 功能标记,在遗传改良和育种上具有更高的利用价值[12‐14]。
目前,已经开发了准确鉴定降低株高(Reduced height,Rht)基因Rht-B1b和Rht-D1b的功能标记。Rht-B1a为野生高秆基因型,Rht-B1a+197、Rht-B1a+160、Rht-B1b为矮秆等位基因;Rht-D1a为高秆基因型,Rht-D1b为半矮秆基因型[15‐16]。普通小麦粒质量相关功能基因如细胞壁转化酶(Cell wall invertase)基因TaCwi-A1,蔗糖合成酶(Sucrose synthase)基因TaSus2-2A、TaSus2-2B和谷氨酰胺合成酶(Glutamine synthase)基因TaGS-D1等10 多个功能基因标记已经被开发和验证,这些基因单个的效应均较小,但聚合多个有利基因位点能增加粒质量和粒大小[17‐20]。此外,小穗发育相关基因TaMoc-A1(Monoculm A1)不仅影响粒数,还与抗旱相关[21]。
小麦高分子质量谷蛋白亚基(High‐molecular‐weight glutenin subunits)和低分子质量谷蛋白亚基是面筋的主要成分,影响面团强度和弹性[22]。Glu-A1位点中1和2∗是优质亚基基因,与面团的强度和面包的烘烤质量显著相关[23];Glu-D1位点的5+10亚基基因对小麦面粉烘烤品质的贡献最大,对制作面包最有利[24]。籽粒硬度(Puroindoline)是小麦重要品质指标之一,也是小麦分类和定价的依据之一,主要受Pina和Pinb控制,Pina-D1a和Pinb-D1a为野生软质基因型,其他为硬质基因型[25‐26]。面粉色泽是小麦重要的品质性状之一,直接影响面条、馒头等面制品的外观品质,色泽越白的面粉越受喜爱。多酚氧化酶(Polyphenol oxidase)基因Ppo-A1、Ppo-D1。胡萝卜素脱氢酶(ζ‐carotene desaturase)基因TaZds-D及八氢番茄红素合成酶(Phytoene synthase)基因Psy-A1和Psy-B1等都对面粉色泽有影响[27‐29],育种家可根据品种所含等位基因类型辅助选择。
根据小麦品种对春化时间长短和最适低温要求的不同,可分为冬性小麦、弱(半)冬性小麦和春性小麦3 种类型,春化基因Vrn(Vernalization)不仅调控春化反应而且调控光周期反应中长日条件下的开花过程,影响小麦生育期长短。对春化基因研究利用较多的是Vrn1的3 个等位基因Vrn-A1、Vrn-B1和Vrn-D1,它们对春化作用的效应不同,Vrn-A1的春化效应最强,且对Vrn-B1、Vrn-D1有上位性效应。这3 个基因中的任何一个为显性,小麦即表现为春性;当这3个基因全为隐性时,小麦则表现为冬性[30‐31]。光周期是影响植物开花的另一个重要环境因素,根据植物对光照长度的敏感性,可将植物分为光周期敏感型和不敏感型,控制小麦光周期(Photoperiod)的基因主要有Ppd-A1、Ppd-B1和Ppd-D1。含显性基因Ppd-D1a、Ppd-B1a和Ppd-A1a的小麦材料对光照长度不敏感,为光周期不敏感型;含隐性基因Ppd-D1b、Ppd-B1b和Ppd-A1b的小麦材料需要长日照才能开花,为光周期敏感型[31‐32]。含有相同的春化基因和光周期基因组合的材料在开花时间上仍表现一定差异,这种差异由早熟性基因引起,包括早开花(Early flowering)基因TaELF3-A1、TaELF3-B1和TaELF3-D1,其中TaELF3-B1和TaELF3-D1起主要作用[33‐34]。此外,多个抗秆锈病(Stem rust)基因Sr2、Sr25、Sr36[35],抗叶锈病(Leaf rust)基因Lr34、Lr67[36],抗旱相关的果聚糖外切水解酶(Fructan exohydrolase)基因1-fehw3、Avenin-like 蛋白基因ALPb7A、咖啡酸-O-甲基转移酶(Caffeic acid O‐methyltransferase)基因COMT3B、脱水反应元件结合蛋白(Dehydration responsive element binding protein)基因DREB-B1等[37‐39],抗穗发芽相关基因如种子休眠(Seed dormancy) 基 因TaSdr-A1、TaSdr-B1、Vp1B1(Viviparous 1 B1)等[40‐41]的功能标记也被开发整合到育种芯片中[14]。
郑品麦24号是以弱春性、优质、强筋、广适小麦品种豫麦34-6 为母本,以半冬性、高产、稳产、广适小麦品种周麦18 的矮秆高产突变体豫同194 为父本,杂交选育而成的半冬性、矮秆抗倒、高产稳产、广适小麦新品种,2018 年通过河南省审定(豫审麦20180031),2019 年和2020 年分别通过安徽省和陕西省引种备案(皖引麦2019009,陕引麦2020014号),具有较大推广潜力[42],研究其遗传构成及重要性状基因组成具有重要意义。为此,利用小麦50K SNP 育种芯片,对郑品麦24 号及其父母本进行分子标记检测,明确该品种遗传构成、重要性状功能基因组成,为其遗传改良和生产应用提供参考。
1 材料和方法
1.1 供试材料
供试小麦品种郑品麦24号,由河南省科学院同位素研究所有限责任公司选育,其母本34-6、父本豫同194均由河南省科学院同位素研究所核农学实验室小麦诱变育种团队提供。
1.2 产量性状及品质分析
供试小麦材料于2019—2020 年种植于河南省科学院新郑试验基地,条沟点播,每个材料种5 行,行长2 m,行距20 cm,株距3 cm。成熟期,取样考种,测量株高、穗粒数、成穗数;收获中间3行测定千粒质量,并用波通近红外分析仪DA7200 快速测定籽粒蛋白质含量和湿面筋含量等品质指标。2015—2016 年和2016—2017 年区域试验品质分析由河南省种子管理站统一在安阳、新乡、洛阳、周口、漯河市5 个试验点分别取样1 kg,多点混样后送农业部谷物品质监督检验测试中心(郑州)分析。
1.3 遗传构成及重要性状功能基因组成分析
委托博奥晶典生物技术有限公司利用小麦50K SNP育种芯片对郑品麦24号及其双亲进行SNP分析及功能基因KASP 标记分析。首先剔除杂合或缺失的SNP 位点,保留亲本和子代中纯合SNP 位点用于遗传贡献率和相似系数分析。根据双亲间纯合差异SNP位点数计算双亲遗传物质对子代的遗传贡献率,某一亲本对后代的遗传贡献率为后代中同该亲本相同的特异位点数与双亲特异位点总数的百分比。将所有纯合SNP 位点数据转换为1(纯合AA)和2(纯合BB),建立原始矩阵,用NTSYS-PC ver.2.1软件计算品种间遗传相似系数。利用GGT 2.0 软件,根据有确切染色体位置信息的SNP 标记绘制郑品麦24号及其亲本的SNP基因型图谱。
对郑品麦24 号及其亲本的株高、千粒质量、粒数、籽粒大小、高分子质量谷蛋白亚基、低分子质量谷蛋白亚基、硬度、面团色泽、光周期、春化、开花、抗旱、抗穗发芽、抗条锈病、抗叶锈病等重要性状相关基因进行基因型分析。
2 结果与分析
2.1 郑品麦24号及其亲本的系谱分析
郑品麦24 号的母本豫麦34-6 是优质强筋小麦豫麦34 号的选优系,豫麦34-6 是以冬性矮秆、多抗、高产、稳产小麦骨干亲本矮孟牛为母本,以弱冬性、高产、稳产、广适、优质小麦骨干品种豫麦2号为父本杂交选育而成的(图1)。郑品麦24 号的父本豫同194是利用60Co-γ辐射诱变高产稳产小麦品种周麦18 获得的能够稳定遗传的矮秆抗倒、高产、稳产突变体。周麦18为黄淮南片麦区典型品种,其高产、稳产、抗逆、广适性突出。周麦18 的母本为春性、大穗、早熟、抗锈小麦品种内乡185,父本为半冬性、中晚熟、高产黄淮南片主栽品种周麦9 号。周麦9号是以百农791/豫麦2号F1为母本、以鲁麦1号/偃师4 号F1为父本复合杂交选育而成的,鲁麦1 号为矮孟牛姊妹系。系谱分析发现,郑品麦24号含有小麦骨干亲本豫麦2 号、矮孟牛、百农791 和主栽品种周麦9 号、周麦18 及豫麦34-6 的血缘,郑品麦24号父母本均含有骨干亲本豫麦2号和矮孟牛的遗传物质。

图1 郑品麦24号及其亲本系谱图Fig.1 Pedigree of Zhengpinmai 24 and its parents
2.2 郑品麦24号及其亲本的株高、产量性状、品质指标比较
由表1 可以看出,在2015—2017 年2 a 区试中,郑品麦24 号株高分别为73.5、77.2 cm,成穗数分别为544.5万、606.0万穗/hm2,穗粒数分别为35.7、35.4粒,千粒质量分别为46.4、44.6 g,与主要亲本周麦18 相比,在同年试验中郑品麦24 号株高分别降低5.2%、6.1%,成穗数分别提高6.5%、8.4%,穗粒数和千粒质量与周麦18 相当,分别增产5.29%、5.54%。在2019—2020 年试验中,郑品麦24 号株高与父本豫同194 接近,低于母本豫麦34-6 和亲本周麦18;成穗数略高于父本豫同194,高于母本豫麦34-6 及亲本周麦18;穗粒数和千粒质量略低于父本豫同194 及亲本周麦18,高于母本豫麦34-6。测定的蛋白质和湿面筋含量结果表明,郑品麦24号的蛋白质含量为14.45%,湿面筋含量为32.83%,2 个指标均与父本豫同194 接近,低于母本豫麦34-6。2015—2017 年2 a 区试混合样品质分析结果显示,郑品麦24 号蛋白质(干基)含量分别为14.07%、15.00%,湿面筋含量分别为32.1%、29.4%。
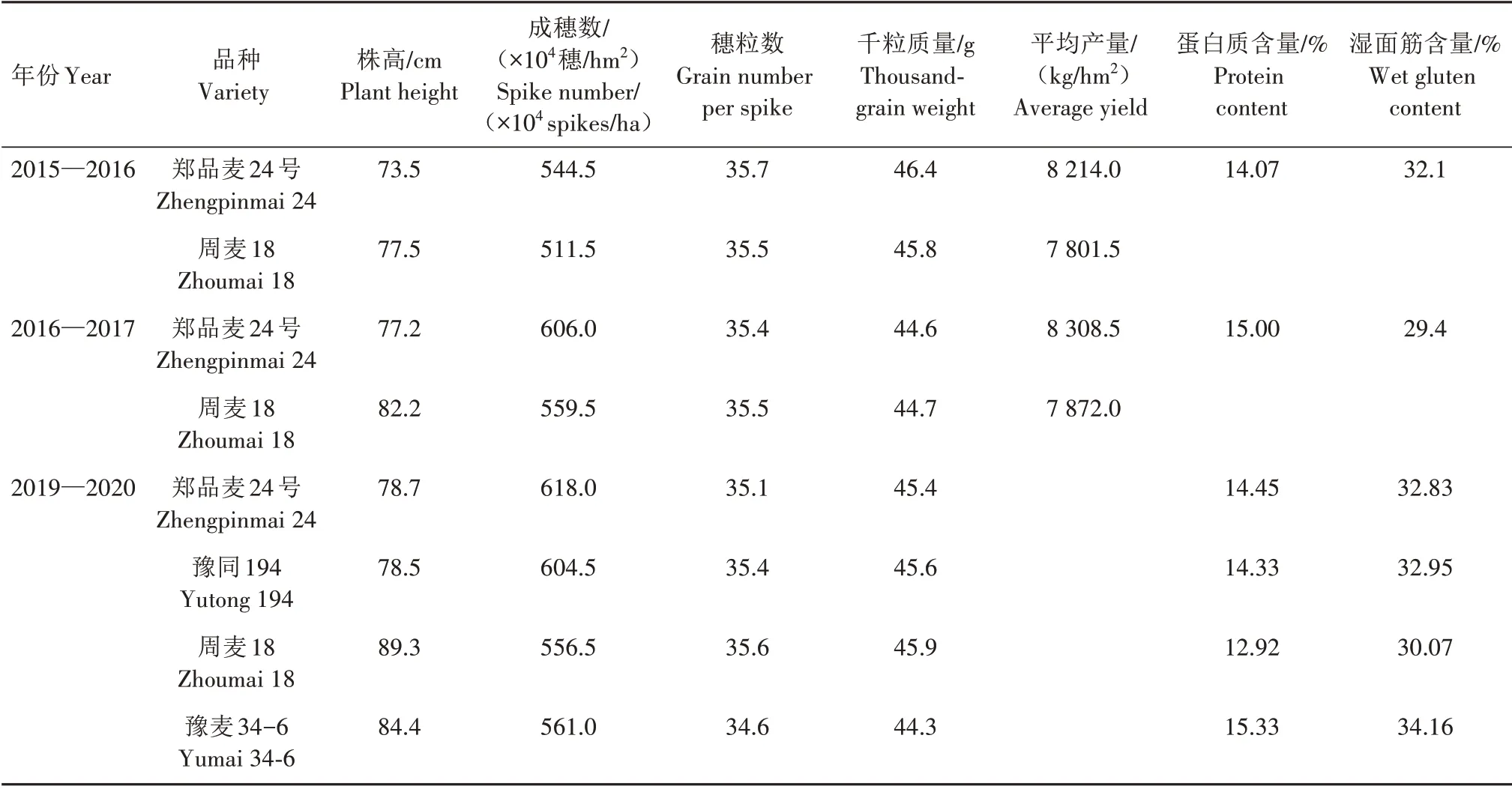
表1 郑品麦24号及其亲本的株高、产量性状、品质指标Tab.1 The plant height,yield traits and quality indexes of Zhengpinmai 24 and its parents
此外,2016、2017 年郑品麦24 号经河南省农业科学院植物保护研究所接种鉴定,对条锈病分别表现为高抗、中抗,对叶锈病均表现为中感,对白粉病均表现为中感,对纹枯病均表现为中感,对赤霉病均表现为高感。
2.3 郑品麦24号的遗传构成
通过小麦50K SNP 育种芯片共检测到41 382个纯合SNP 位点,在双亲豫麦34-6 和豫同194 间共检测到8 322 个纯合差异SNP 位点。利用双亲间纯合差异SNP位点分析子代的遗传构成,郑品麦24号与母本的SNP 位点相同且与父本SNP 位点不同时,认为该SNP 位点由母本提供,反之由父本提供。在8 322 个SNP 位点中,6 857 个SNP 位点来源于父本豫同194,1 465 个SNP 位点来源于母本豫麦34-6(表2)。豫同194 和豫麦34-6 对郑品麦24 号的遗传贡献率分别是82.40%和17.60%,表明郑品麦24号更多地继承了豫同194 的遗传物质。对郑品麦24号及其双亲的遗传相似系数进行分析,发现郑品麦24 号与豫同194 的遗传相似系数为0.907,与豫麦34-6 的遗传相似系数为0.701,表明郑品麦24 号与父本豫同194的亲缘关系更近。
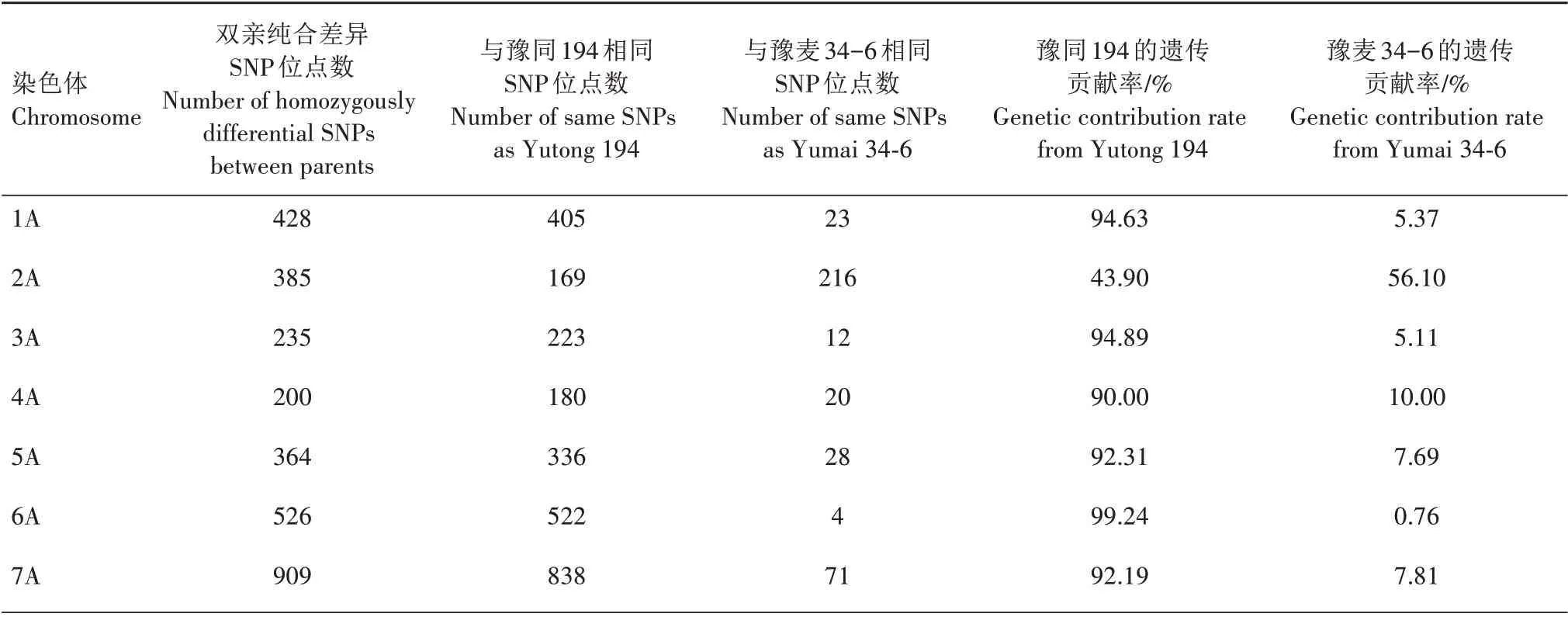
表2 双亲对郑品麦24号的遗传贡献Tab.2 The genetic contribution from parents to Zhengpinmai 24

续表2 双亲对郑品麦24号的遗传贡献率Tab.2(Continued) The genetic contribution from parents to Zhengpinmai 24
双亲在基因组和染色体水平上对郑品麦24 号的遗传贡献率分析结果(表2)显示,在A 基因组,豫同194 和豫麦34-6 对郑品麦24 号的遗传贡献率分别为87.73%和12.27%;在B 基因组,豫同194 和豫麦34-6对郑品麦24号的遗传贡献率分别为83.00%和17.00%,与整体遗传贡献率接近;在D 基因组,豫同194 和豫麦34-6 对郑品麦24 号的遗传贡献率分别为72.66%和27.34%。不同染色体间双亲对郑品麦24 号的遗传贡献率变化较大,豫同194 在不同染色体上对郑品麦24 号的遗传贡献率为29.02%~99.24%,除2A 和3D 染色体外,在其他染色体上对郑品麦24 号的遗传贡献率均超过60%;豫麦34-6在不同染色体上对郑品麦24 号的遗传贡献率为0.76%~70.98%。
在检测到的41 382 个纯合SNP 位点中,有33 703 个SNP 位点有确切染色体位置信息,24 905个SNP 位点在郑品麦24 号及双亲间无差异,7 809个SNP 位点在双亲中存在差异;郑品麦24 号有989个SNP 位点与双亲均不一致,占总数(33 703)的2.93%。依据这些SNP 位点信息,利用GGT 2.0软件绘制了郑品麦24 号及双亲的SNP 基因型图谱(图2)。双亲在染色体上的差异呈区段分布,其中6A、7A、1B、5B、6B、7B、1D、6D 染色体差异较多且差异区段较大,1A、2A、3A、3B、4B、2D、4D、5D、7D 染色体上差异也较多但以小区段分布,其余染色体差异区段较少。在2A 染色体上,郑品麦24 号继承较多的豫麦34-6遗传区段,在5B、7B、3D、4D、5D、6D、7D 染色体上郑品麦24 号继承双亲的遗传区段较接近,在其他染色体上郑品麦24 号主要继承了豫同194 的遗传区段。遗传贡献率分析结果与SNP 基因型图谱分析结果有较好的一致性。

图2 郑品麦24号及其亲本21条染色体上SNP 基因型图谱Fig.2 SNP genotype map on 21 chromosomes of Zhengpinmai 24 and its parents
2.4 郑品麦24号及其亲本重要性状功能基因分析
利用小麦50K SNP 育种芯片上的纯合KASP 标记对郑品麦24 号及其亲本的株高、芒、粒质量、粒数、籽粒大小等产量相关基因,高、低分子质量谷蛋白亚基,硬度,面团色泽等品质相关基因,光周期、春化、开花等适应性相关基因,抗旱、穗发芽、条锈病、叶锈病等抗逆相关基因进行分析(表3—4)。
2.4.1 产量相关基因 对郑品麦24 号及其亲本的产量相关基因进行分析(表3),发现郑品麦24 号及其双亲均含有矮秆基因Rht-D1b、芒基因AWN,在郑品麦24 号及其双亲间共检测到14 个粒质量、粒数、籽粒大小相关基因。郑品麦24 号与父本豫同194 在这14 个基因的组成上完全一致,均含有谷氨酰胺合成酶基因TaGS5-A1b、TaGS2B1-Hap-H、TaGS-D1a,粒质量(Grain weight)基因GW2-6BHap-1,千粒质量(Thousand grain weight)基因TaTGW6-A1a、TaTGW-7Aa,蔗糖合成酶基因TaSus1-7B-Hap-T、TaSus2-2A-Hap-A、TaSus2-2BHap-H,共9 个高粒质量等位基因;郑品麦24 号与豫麦34-6 有4 个基因存在差异,分别是GW2-6B、TaGS2B1、TGW7、TaMoc-A1基因,豫麦34-6基因型分 别 为GW2-6B-Hap-2、TaGS2B1-Hap-L、TaTGW-7Ab低粒质量等位基因和TaMoc-A1-Hap-H高粒数等位基因;此外,3 个小麦品种都携带3 个低粒质量等位基因(TaCwi-A1b、TaGS2-A1a和
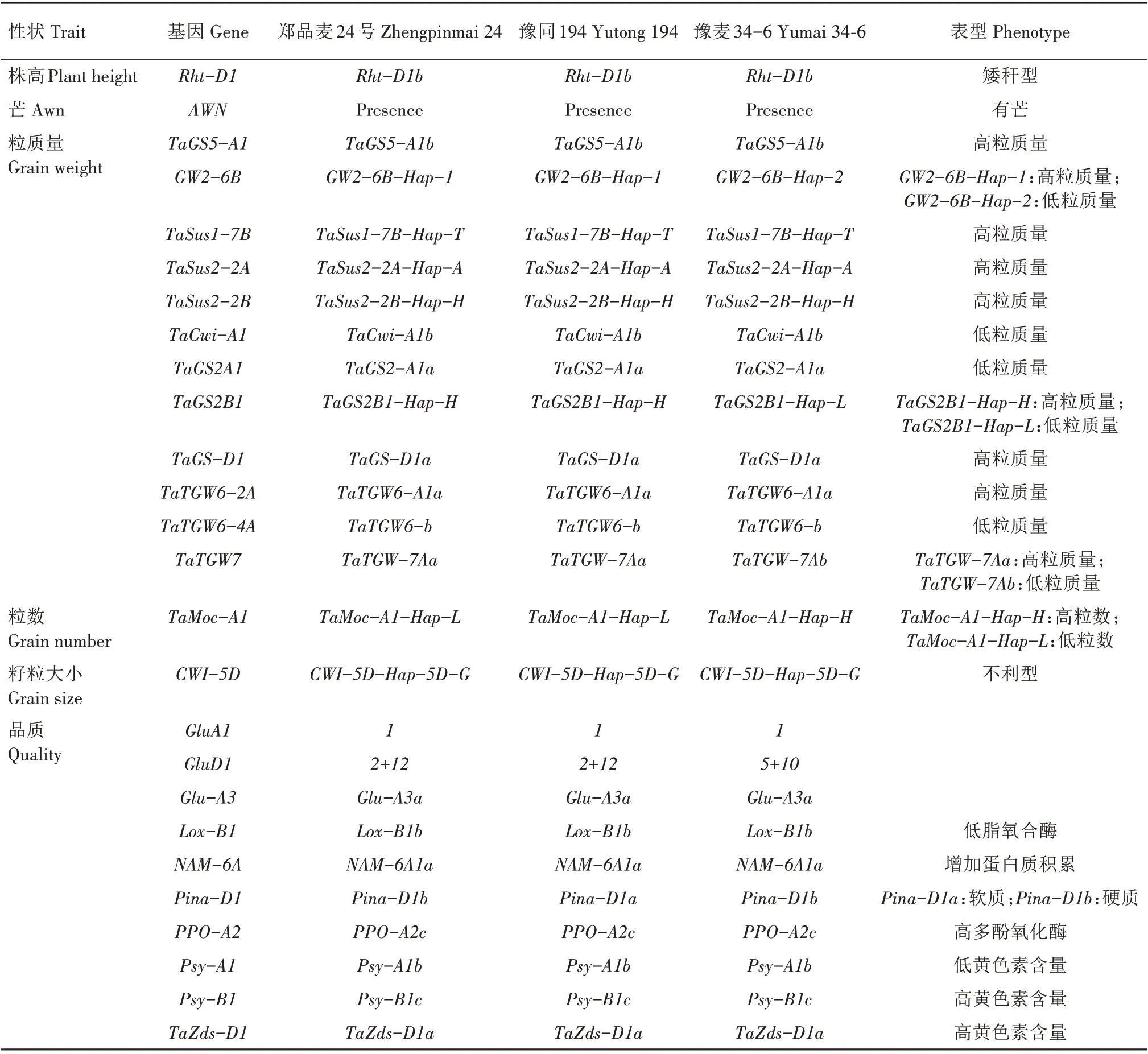
表3 郑品麦24号及其亲本株高、产量、品质相关基因分型Tab.3 Genotyping of plant height,yield and quality related traits in Zhengpinmai 24 and its parents
TaTGW6-b)。
2.4.2 品质相关基因 在郑品麦24 号及其双亲中共检测到11 个品质性状相关基因(表3)。郑品麦24 号和豫同194Glu-A1和Glu-D1位点都是1和2+12,豫麦34-6Glu-D1位点为优质亚基基因5+10。郑品麦24 号和豫麦34-6 均含有硬质主效等位基因Pina-D1b,豫同194 含有软质基因Pina-D1a。郑品麦24号及其双亲其余8个品质相关基因组成完全一致,均含有低分子质量谷蛋白亚基基因Glu-A3a,低脂氧合酶活性(Lipoxygenase activity)基因Lox-B1b,能增加籽粒蛋白质积累及促进锌、铁等微量元素吸收的基因NAM-6A1a(No apical meristem 6 A1a),高多酚氧化酶活性基因PPO-A2c,高黄色素含量基因Psy-B1c、TaZds-D1a、Psy1Da-g(表4),低黄色素含量基因Psy-A1b。
2.4.3 春化、开花、光周期等相关基因 在郑品麦24 号及其双亲中共检测到3 个春化基因、2个开花基因和5 个光周期基因(表4)。其中,郑品麦24 号上述10 个基因与父本豫同194 完全一致,与豫麦34-6仅Vrn-B1基因存在差异。郑品麦24号含有冬性春化等位基因Vrn-A1b、vrn-B1和VrnD3-2174,而豫麦34-6 含有春性等位基因Vrn-B1b。郑品麦24 号及其双亲均含有晚花等位基因TaELF3-B1Cadenza类型、TaELF3-D1Wild类型,光周期敏感等位基因Ppd-A1Wild 类型、TaPpdDD002Wild 类型、TaPpdDI001Insertion 类型以及光周期不敏感等位基因Ppd-B1Paragon 类型、TaPpdDD001Deletion类型。

表4 郑品麦24号及其亲本春化、开花、光周期、抗逆相关性状基因分型Tab.4 Genotyping of vernalization,flowering,photoperiod and resistance related traits in Zhengpinmai 24 and its parents
2.4.4 抗逆相关基因 郑品麦24 号与其母本豫麦34-6 均含有3 个抗锈病基因Lr67、Sr2和Sr25,豫同194无Sr2基因;郑品麦24号与其双亲均含有1个抗旱等位基因TaDREB-B1a、1 个低穗发芽等位基因TaSdr-A1a、2 个不利抗旱等位基因COMT-3Bb和ALPb7A-AL3、2 个易发芽等位基因Vp1Ba和TaSdr-B1b。
3 结论与讨论
随着分子生物学技术的迅速发展,近年来采用高通量DNA芯片替代早期的RAPD、RFLP和SSR等分子标记来研究小麦品种的遗传差异、亲缘关系和遗传物质传递。前人利用20 对SSR 标记在矮孟牛及其衍生品种(系)间共检测到120 个多态性标记[43];利用63 个SSR 引物在小偃6 号及其80 个衍生品种(系)间共检测到175 个等位变异[44];利用覆盖小麦21 条染色体的340 个SSR 标记在周麦23 号及双亲间筛选到146 个多态性标记[45];利用覆盖小麦21 条染色体的625 个SSR 标记在淮麦33 及其双亲间共发现364 个多态性标记[8]。而利用高通量DNA芯片能检测到更多的多态性位点,利用90K SNP 芯片在周麦16及其亲本间共检测到7 780个有位置信息的差异性标记[7];利用小麦55K SNP 芯片在周麦22 及其80 份衍生材料间共检测到32 895 个多态性SNP 位点[46];利用90K SNP 芯片在河南省96 个审定品种中共检测到38 661个多态性SNP位点[47]。本研究利用小麦50K SNP 育种芯片在郑品麦24 号双亲间检测到8 322 个纯合多态性SNP 位点,高通量的SNP芯片能够在分子水平快速检测到成千上万个多态性位点,10 倍于其他分子标记。因此,采用基因组覆盖度高、检测通量水平高的SNP 芯片开展群体遗传学研究,能够更加客观全面地从基因组水平解析品种遗传组成和亲本遗传贡献[48]。
理论上,单交品种的所有等位变异应都来源于双亲,但实际研究发现杂交后代会出现一些不同于亲本的特异位点。研究发现,淮麦33的特异位点比例为10.4%[8],周麦23 的特异位点比例为5.0%[45]。本研究同样发现郑品麦24 号存在2.93%的特异位点。这些特异位点产生的原因可能是在品种选育过程中,来自双亲的遗传物质在每个世代都存在基因重组及小概率的自然突变,产生了碱基突变、插入、缺失或多个碱基的颠倒和置换等变异,从而形成一些不同于双亲的遗传变异。现代小麦育种是育种家有目的、有计划的定向改良的过程,人工选择在品种形成过程中起到决定性作用。因此,常常出现子代遗传物质偏向于某一亲本的现象。前人利用分子标记对多个小麦骨干亲本在后代中的遗传情况进行分析,均发现偏亲现象,周麦13 号对周麦23 号的遗传贡献率(63.04%)远高于另一亲本新麦9号[45];青农2号的基因组大部分遗传信息来自鲁麦14(SSR 标记:54.11%;SNP 标记:72.55%)[48];淮麦33 73.9%的遗传物质来源于母本烟农19[8]。在品种选育的过程中,育种家往往选择当地主栽品种作为杂交亲本之一,选择符合当地生态区域育种目标的优良变异类型,从而保留了更多的主栽品种遗传物质。河南省是我国小麦主产区、高产区,其高产育种成绩显著。周麦18 是高产、稳产代表品种,其矮秆突变系豫同194降低了株高、提高了成穗数,在大田种植下能获得比周麦18更高的产量,很好地继承了周麦18 的高产特性,并改良了周麦18 株高偏高、株型较松散的问题。豫麦34-6是优质强筋小麦品种,但产量水平一般。因此,在郑品麦24 号选育过程中,高产选择压力下保留了豫同194 大部分遗传物质。
矮秆抗倒是小麦育种的重要目标性状之一,郑品麦24 号及其双亲均含有相同的广泛应用的矮秆基因Rht-D1b,但它们的株高并不相同,豫同194 和郑品麦24号的株高均比豫麦34-6和周麦18低。郑品麦24 号的矮秆性状可能来自于豫同194,豫同194是周麦18的矮秆突变体,周麦18同样含有Rht-D1b基因,表明豫同194 可能含有控制株高的QTL,需要进一步研究。粒质量是小麦产量构成的重要因素,是遗传相对稳定的性状,也是我国小麦育种中遗传改良最显著的产量性状,对我国小麦单产水平的提高做出了较大贡献[49]。几乎所有的小麦染色体上都已经鉴定出了控制粒质量的QTL,部分粒质量基因已被克隆,很多粒质量形成相关基因的功能标记已被开发[17,50]。本研究发现,郑品麦24 号与豫同194 的粒质量相关基因组成一致,均聚合9 个高粒质量等位基因,高产性状突出,但仍有提升的空间。豫麦34-6 是经过长期检验的品质稳定的强筋小麦品种,在郑品麦24号选育过程中过于注重高产性状的选择,没有对优质亚基进行选择,郑品麦24号不含5+10 优质亚基,品质也没有达到强筋水平,品质改良是其今后遗传改良目标之一。同时发现郑品麦24 号及其双亲均含有多个面粉高黄色素含量等位基因,如PPO-A2c、Psy-B1c、Psy1Da-g和TaZds-D1a。随着人们对面粉品质的要求越来越高,降低黄色素含量也是品质改良的目标。
郑品麦24 号含有冬性春化等位基因Vrn-A1b、vrn-B1和Vrn-D3-2174,晚花型等位基因TaELF3-B1Cadenza 类型、TaELF3-D1Wild 类型,光周期敏感等位基因Ppd-A1Wild 类型、TaPpdDD002Wild 类型和TaPpdDI001Insertion 类型,与其半冬性、中晚熟特性一致。目前,生产上大面积推广的品种均属中等偏晚熟类型,这类品种更抗寒、抗倒春寒、耐旱、抗干热风,适应性好,产量更高[51]。郑品麦24 号含有3 个抗锈病基因Lr67、Sr2和Sr25,1 个有利抗旱等位基因TaDREB-B1a,1 个低穗发芽等位基因TaSdr-A1a,具备较好的抗病性和一定的抗旱性。河南省小麦锈病常年较重,且河南省小麦品种审定对高感条锈病品种一票否决。因此,河南省生产主导小麦品种均具备不同程度的抗锈性,携带的抗锈病基因频率较高。
冬春干旱、春季倒春寒冻害,灌浆后期高温、干热风灾害以及条锈病、叶锈病、纹枯病等各种病虫害是影响黄淮南片区小麦生产的主要因素。通过重要性状基因KASP 标记分析,明确郑品麦24 号部分重要性状基因组成,在基因水平上郑品麦24号具有如下特征:半冬性、晚熟、矮秆抗倒、高产稳产、较好的抗病性和一定的抗旱性,与审定报告一致,这为其遗传改良和生产应用提供了理论依据。
