基于免疫基因的胶质母细胞瘤预后预测模型的构建和验证
2022-01-26潘强程伟进陈建军卢晔芬
潘强,程伟进,陈建军,卢晔芬
胶质母细胞瘤(GBM)是常见的一种极具侵袭性的颅内恶性肿瘤[1],1 年生存率约为25%,2 年生存率不到5%[2]。多组学研究表明,GBM是一种在分子水平和临床上异质性明显的疾病。癌症基因组图谱计划(TCGA)于2010年构建了类似的GBM 分型系统,基于对转录组数据的无监督聚类,将GBM 分为经典型、神经原型、神经型和间充质型,其中间充质型GBM 的预后最差,复发率和病死率最高[3]。肿瘤微环境(TME)广泛参与癌症的发生发展等过程,TME的免疫细胞组成常常决定其对治疗的响应,而GBM 的TME 处于明显的免疫抑制状态[4]。因此,有必要对GBM 肿瘤异质性特征整合TME进行研究,以期从新的视角对GBM进行风险评估和靶向治疗。本研究基于GBM 的分子亚型和免疫标志基因,通过网络分析,构建基于免疫基因的GBM预后模型(IPSGBM),结合免疫特征基因和肿瘤异质性,纳入不同亚型进行风险评估,现将结果报道如下。
1 资料与方法
1.1 数据准备和预处理 本研究纳入3个独立数据集,共包含1 067 例GBM患者。选取中国胶质母细胞瘤基因组图谱(CGGA)中的388 例GBM患者RNA测序数据作为训练队列,TCGA(HGUG133A)(525 例),GEO(Genome Expression Omnibus)数据库中的GSE16011(154 例)作为验证队列。从GlioVis(http://gliovis.bioinfo.cnio.es/)数据库获取GBM 患者的标准化表达数据及相应的临床和分子分型信息,见表1。
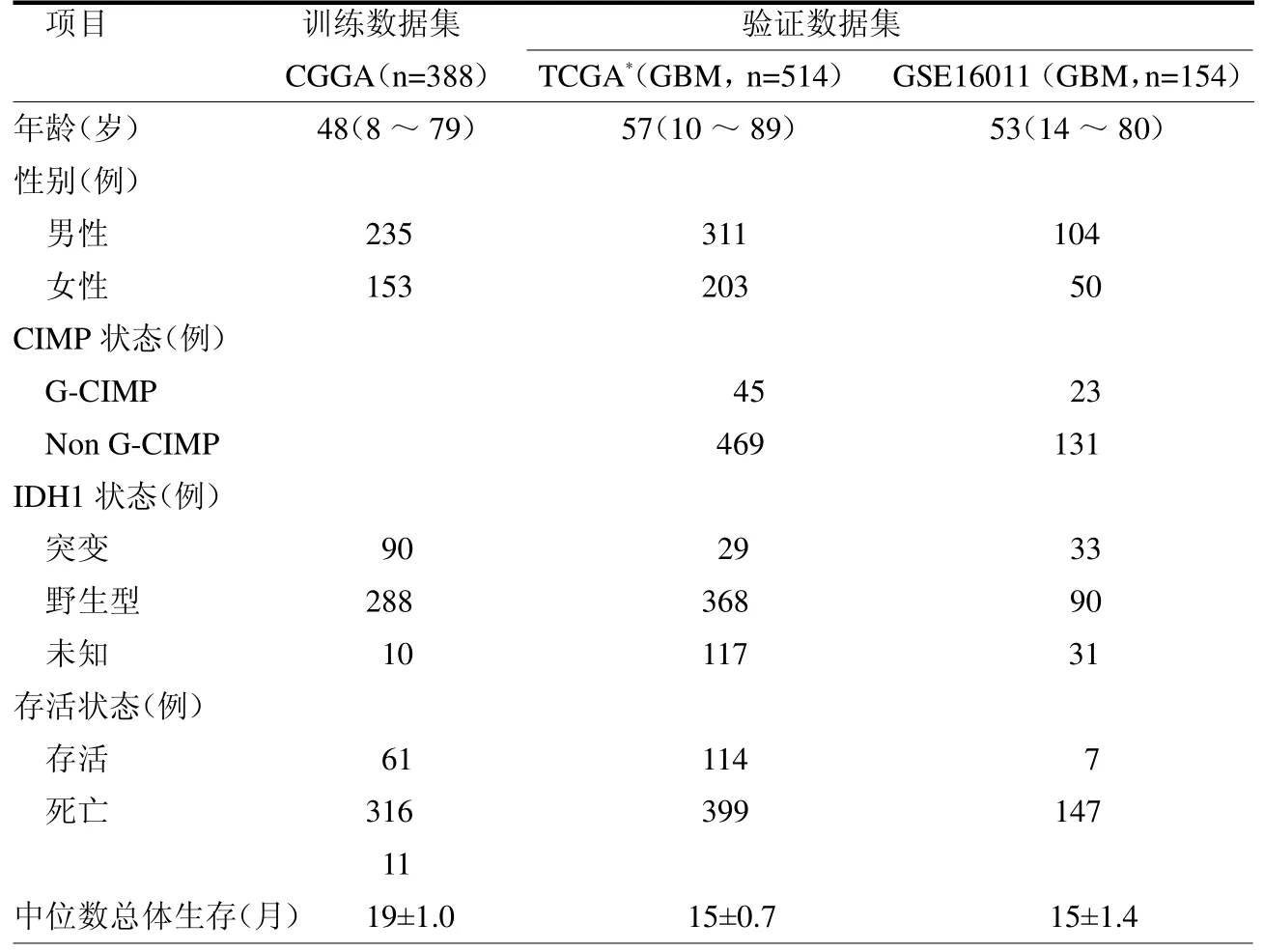
表1 队列的临床资料
1.2 整合网络分析 从Immport 数据库获取免疫基因列表。使用“RTN”包构建免疫基因和靶基因间的调控网络,发现与非间充质型GBM 相比,有34 个免疫基因(|log2 FC|>1.5,BH-adjusted P<0.05)和726 个靶基因(log2 FC>0.75,BH-adjusted P<0.01)在间充质型GBM 中差异表达。借助主调控分析(MRA)方法,通过超几何检验测定了每个免疫基因调控单元中上皮间充质转化(EMT)相关基因的表达情况。
1.3 构建和验证基于免疫基因的GBM预后模型 通过MRA 筛选出的免疫基因为间充质型GBM 的关键调控因子。结合这些免疫基因的表达情况和患者总体生存期,通过Cox 比例风险回归分析构建了一种基于免疫基因的GBM 预后模型(IPSGBM),并对CGGA 队列中的患者进行风险赋分,以平均值为界将患者分为高风险组和低风险组。该模型的计分方程:风险评分=(0.060 8×STC1)+(0.011 2×PLAU)+(0.000 3×PLAUR)。随后,通过Kaplan-Meier 分析在其他两个独立数据集中检验IPSGBM的预测效能。
1.4 功能分析 为比较不同风险组间的免疫生物学差异,从MSigDB 数据库下载获取kegg基因集,设定运行参数为1 000 次随机排列,P<0.05,使用“fgsea”R包进行基因集富集分析(GSEA)。
1.5 统计方法 采用R 统计软件进行分析。使用“limma”包完成差异基因分析,比较间充质型GBM 和非间充质型GBM 间差异表达的免疫基因和相应的靶基因;使用“survivla”包采用对数秩检验方法,通过Kaplan-Meier 分析比较高风险组和低风险组间的生存差异;相关性使用Pearson 相关分析。P<0.05 为差异有统计学意义。
2 结果
2.1 整合网络分析 经过MRA,确定STC1、PLAU 和PLAUR 3 个免疫特征基因为间充质型GBM 的主调控基因。相关分析发现STC1、PLAU 和PLAUR基因和上皮间充质转化通路中的关键基因TGFB1 有关(r=0.36、0.59、0.59,均P<0.05),见彩图3。
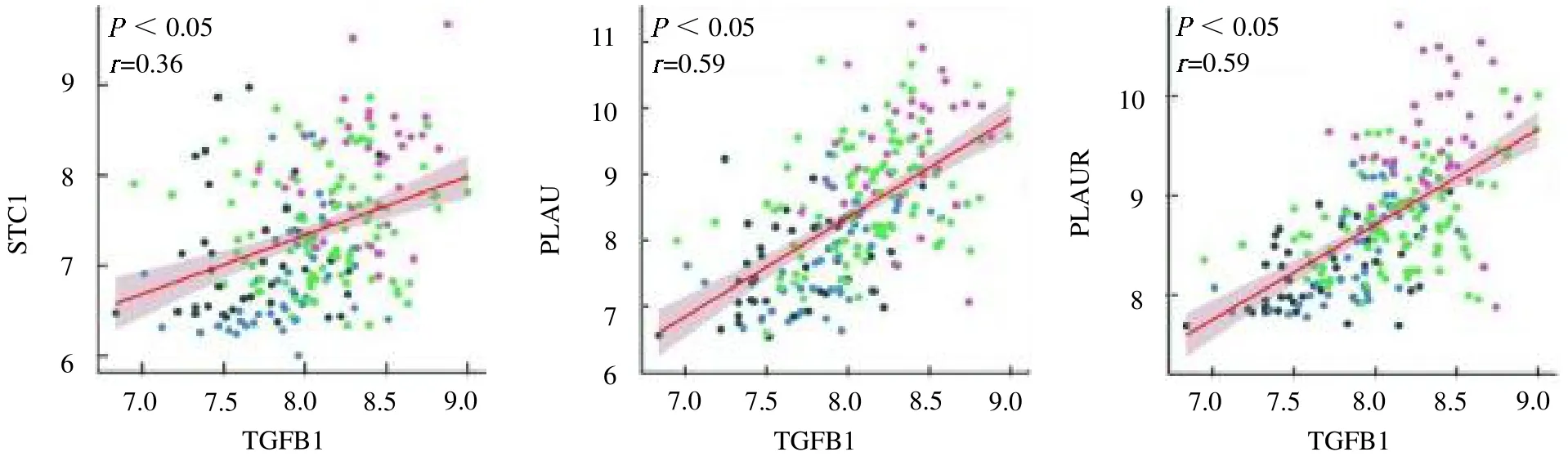
图3 STC1、PLAU 和PLAUR 免疫特征基因与TGFB1 的相关分析
2.2 IPSGBM 的构建和评估 依据IPSGBM 的赋分方程,计算了CGGA 队列和验证队列中患者的风险评分。在每个队列中,以风险评分的平均数为阈值,将患者分为高危组和低危组。在CGGA队列和验证队列中,高危组的总体生存期低于低危组(风险比=1.36、1.42、1.55,均P<0.05),见彩图4。

图4 不同风险组的生存差异
2.3 功能分析 GSEA结果显示,TGF-、EMT、黏着斑激酶等信号通路在高危组中显著上调,见彩图5。
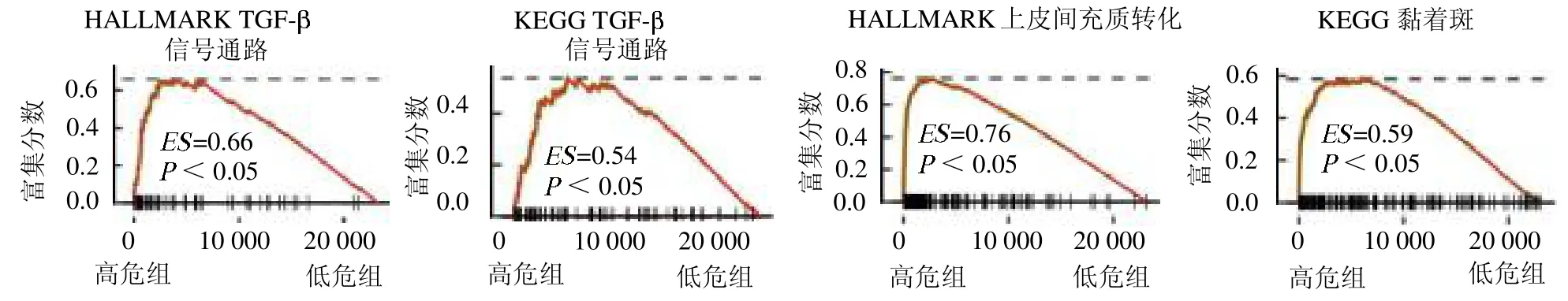
图5 集富集分析结果
3 讨论
GBM 是一种难治性中枢神经系统肿瘤,极具侵袭性且预后较差,中位生存期仅15 个月[5]。GBM 可分为4 种分子亚型(神经原型、神经型、经典型和间充质型),其中间充质型GBM 富含巨噬细胞和肿瘤浸润淋巴细胞,炎症反应活跃,与其他亚型相比,临床预后最差[3]。大量证据表明,免疫特征基因可作为评估患者临床转归和治疗反应的生物标志物[6-8]。本研究通过整合间充质亚型GBM 的免疫特征基因和分子模式进行网络分析,构建基于免疫基因的GBM 预后模型。
本研究发现间充质型GBM 的3 个主调控免疫基因(STC1、PLAU、PLAUR),单个基因即有较好的预后预测价值。这3 个基因广泛参与免疫应答,如STC1 涉及TME 的调节,在肺腺癌中肿瘤相关成纤维细胞表达的STC1 产物调控肿瘤相关巨噬细胞的分化[9]。有研究表明,在食道鳞状细胞癌[10]、结直肠癌[11]及肝细胞癌[12]中STC1 高表达水平与患者较差的生存期相关。据报道,PLAU 抑制辅助性T细胞[13],且在肿瘤转移中发挥重要作用[14],PLAU高表达与肺鳞癌较差的预后相关[15]。PLAUR 影响肿瘤细胞的增殖和侵袭,是恶性肿瘤预后的不良因素[16]。
IPSGBM 是一种可靠的GBM 预后模型,由此定义的低危组患者相对高危组患者总体生存率显著改善。本研究GSEA 结果发现,在高危组中间充质特征相关的如TGF、EMT、黏着斑等信号通路显著上调。
尽管构建的IPSGBM 能在GBM 患者预后预测中发挥较好作用,但本研究尚存一些局限性。首先,本研究是一项回顾性分析,纳入的数据集来源于公共数据库中高通量测序产生的转录组数据,价测序费用昂贵、数据前处理繁琐,不利于其在临床一线的推广应用,而队列中的某些患者可能罹患基础性疾病、急慢性感染或服用抗炎药物,对研究产生干扰,因此有待更多的前瞻性队列验证。其次,本研究中的所有数据集都来自单个测序平台,提出的IPSGBM 是否也适用于其他测序平台解析出的表达谱数据仍未清楚。最后,需要设立统一的风险阈值以促进该模型的临床应用。未来需要纳入多中心的临床样本,进一步探究该模型的内在生物学功能。
