贝莱斯芽孢杆菌对甜樱桃软腐病生防效果的研究
2022-01-26郗良卿李睿琪
郗良卿,吴 澎*,李睿琪
(1.山东农业大学食品科学与工程学院,山东泰安 271000;2.山东农业大学动物科学与技术学院,山东泰安 271000)
甜樱桃为蔷薇科李属木本植物,原产欧洲[1],在我国引种食用已有100 多年的历史。樱桃品种繁多[2],在我国种植广泛,分布于山东、新疆、河北等地[3],且产量居世界第一位[4]。甜樱桃果实呈球形[5],皮薄光泽[6],肉质柔软,多汁味酸甜,可直接食用[7],具有抗癌、预防心脑血管疾病等功效,被誉为“生命之果”[8]。甜樱桃富含多种营养素[9],有益于人体健康[10],且有抗氧化和保健功效,大量研究发现它们具有显著的药理作用[11]。
在甜樱桃种植过程中,病害是影响其产量和品质的主要原因[12],包括非侵染性病害和侵染性病害[13]。非侵染性病害主要由冻害及缺素[14]所致;侵染性病害主要包括病毒性病害,穿孔病、根癌病等细菌性病害[15]以及软腐病、根腐病、褐腐病、青霉病、灰霉病等真菌性病害[16]。导致甜樱桃发生真菌性病害的病原菌[17]主要有扩展青霉菌(Penicillium expansum)[18]、美澳型核果褐腐病菌(Monilinia fructicola)[19]、葡萄孢霉菌(Botrytis cinerea)[20]、根霉菌(Rhizopussp.)[21]、毛霉菌(Mucorsp.)[22]、链格孢霉(Alternaria alternata)[23]及炭疽菌(Colletotrichumsp.)[24]、黑曲霉(Aspergillus niger)[25]等。软腐病为樱桃的常见病,主要发生在运输、销售及在树上成熟过度的果实上,匍枝根霉(Rhizopus stolonifer)[26]是导致软腐病的病原菌之一,该病发病迅速,果实感染2~3 d 后,被感染的果实发生变软和水样[27],释放出带有发酵或酸性的气味[28]。
生产上对甜樱桃软腐病等真菌性病害的防治大多采用化学药剂,但其降解性差,易造成环境污染,不利于我国农业的绿色可持续发展[29];且长期单一的使用同类化学药剂,易使抗体药性问题凸显[30],而通过微生物拮抗作用[31]来控制软腐病,毒性低,药物残留少,是保障食品安全的有效措施。在甜樱桃采后保鲜[32]的拮抗微生物中,国内已报道的主要有罗伦隐球酵母(Cryptococcus laurentii)[33]、芽孢杆菌属(Bacillusspp.)[34]等外源拮抗菌株。芽孢杆菌是应用最为广泛的生防菌,具有抗逆性强、生物安全性好等优点。通过樱桃体内的贝莱斯芽孢杆菌(B.velezensis)[35],产生具有抗菌性的代谢物质,与匍枝根霉竞争生活空间和营养物质并大量繁殖,使匍枝根霉得不到充足的营养物质,抑制其生长,从而抑制软腐病的发生[36];并且贝莱斯芽孢杆菌有一定的促生效果[37],有利于樱桃果实的发育。目前对于樱桃软腐病具体生物防治措施的研究较少,且对贝莱斯芽孢杆菌拮抗作用的报道也不多,研究贝莱斯芽孢杆菌拮抗菌的拮抗作用,以便采取生物措施对甜樱桃软腐病进行防治,是一条安全、有效的防治途径[38]。本文分析了贝莱斯芽孢杆菌对导致甜樱桃软腐病的匍枝根霉(Rhizopus stolonifer)的拮抗作用,并运用活体实验验证了贝莱斯芽孢杆菌对匍枝根霉的抑菌效果,为解决当前甜樱桃的软腐病问题,以及甜樱桃的采后保鲜防腐技术提供理论依据。
1 材料与方法
1.1 材料与试剂
甜樱桃:2019 年6 月自山东省果树研究所天平湖基地(泰安)采集无病害、无畸形、个体大小均等的‘美早’甜樱桃。
肉膏蛋白胨培养基(LB):蛋白胨10 g,酵母膏5 g,氯化钠10 g,琼脂20 g,水1 000 mL,pH=7,在大气压0.1~0.15 MPa 下,121 ℃灭菌20 min。NB 培养基:蛋白胨10.0 g、酵母膏5.0 g、氯化钠10.0 g,蒸馏水1 000 mL,pH 调至7.0~7.3。
试剂:无水乙醇、乙酸异戊酯、氯化钠,天津市凯通化学试剂有限公司,分析纯;蛋白胨、酵母膏,生化试剂,北京奥博星生物有限公司。
1.2 仪器与设备
电热恒温恒湿生化培养箱,303-00A 型,天津赛得利斯实验分仪器制造厂;高压蒸汽灭菌锅,XFC-100CA 型,浙江新丰医疗器械有限公司;荧光显微镜,XSP-63A 型,上海光学仪器一厂;电泳仪,HT-300,北京市六一仪器有限公司;PCR 仪,MA-6000 型,德国Biometra 公司;全自动凝胶成像分析系统,ChamlGel6000 型,北京赛智创业科技有限公司;扫描电镜,JCM-7000 型,苏州沃弗本精密机械有限责任公司;涡旋振荡器,QL-901 型,海门市其林贝尔仪器制造有限公司。
1.3 试验方法
1.3.1 拮抗菌发酵条件的优化
(1)生长曲线的绘制
将菌株的活化液分别接种在LB 液体培养基中,30℃、180 r/min 摇床培养。于接种后的第0、2、4、6、8、10、12、14、16、18、20、24、26 h 取菌液于1 cm 比色杯,利用分光光度计测定600 nm 处的吸光度,以未接种的LB 液体培养基为空白,3 个平行,绘制菌株的生长曲线。
(2)发酵液抑菌温度的优化
取拮抗菌种子培养液,2%接种量接种,分别于25、30、37 ℃下180 r/min 振荡培养72 h,以病原菌为指示菌,采用平板对峙法测定菌液的抑菌率。每个梯度设置3 个平行。
(3)发酵液抑菌时间的优化
取拮抗菌种子培养液,2%接种量接种,在37 ℃下180 r/min 振荡培养,发酵时间分别为24、48、72、96、120 h,以病原菌为指示菌,采用平板对峙法测定菌液的抑菌率。每个梯度设置3 个平行。
(4)发酵液抑菌pH 的优化
取拮抗菌种子培养液,按2%接种量接种到pH 值分别为5、6、7、8、9 的菌液中,在37 ℃下180 r/min 振荡培养,发酵96 h,以病原菌为指示菌,采用平板对峙法测定菌液的抑菌率。每个梯度设置3 个平行。
1.3.2 拮抗菌体内验证试验
(1)3 种拮抗菌处理液拮抗效果的筛选
大小一致、成熟度均一的甜樱桃果实经100 mg/L 次氯酸钠消毒2 min,自然晾干后,用接种针在赤道部位刺3 mm×3 mm×3 mm 伤口。用移液枪吸取20 μL 不同处理液接种至果实伤口部位,每个处理组30 颗果实,设3组平行。处理液如下:A 发酵液(拮抗菌在最佳发酵条件下获得)、B 菌悬液(发酵液经12 000 r/min 离心10 min取菌体,加无菌水获得)、C 上清液(发酵液经12 000 r/min 离心10 min 取上清液),4 h 后每个处理组接种10 μL 浓度为104CFU/mL 的病原孢子悬浮液,以无菌水为对照,然后将果实自然风干,并放入塑料托盘中,该托盘用高密度聚乙烯套筒包裹,以保持高湿度。28 ℃下每12 h观察发病情况,并测量病斑直径。
(2)拮抗菌处理液浓度的筛选
配置109、108、107、106CFU/mL 拮抗菌菌悬液,甜樱桃果实经100 mg/L 次氯酸钠消毒2 min,自然晾干后,用接种针在赤道部位刺3 mm×3 mm×3 mm 伤口,移液枪吸取20 μL 不同浓度菌悬液,4 h 后分别接种10 μL 浓度为104CFU/mL 的病原孢子悬浮液,以无菌水为对照,果实自然风干,并放入塑料托盘中,该托盘用高密度聚乙烯套筒包裹,以保持高湿度。28 ℃下每12 h 观察发病情况,并测量病斑直径。
(3)有伤接种
将果实用4×10-5mol/L 二氧化氯消毒2 min,用无菌水冲洗两次,自然晾干,用灭菌的黄枪头在果实赤道部位插3 mm×3 mm×3 mm 左右的伤口。
试验共设5 个处理组,每个处理组100 颗果实。处理如下:
CK(果实+病原菌):接种10 μL 浓度为104CFU/mL的病原菌孢悬液。
处理1(果实+109CFU/mL 发酵液+病原菌):先接种20 μL、109CFU/mL 发酵液,在无菌环境下固定4 h 后,再接10 μL、104CFU/mL 的病原菌孢子悬浮液。
处理2(果实+稀释5 倍的109CFU/mL 发酵液+病原菌):先接种20 μL 稀释5 倍的108CFU/mL 发酵液,在无菌环境下固定4 h 后,再接10 μL、104CFU/mL 的病原菌孢子悬浮液。
处理3(果实+108CFU/mL 发酵液+病原菌):先接种20 μL、108CFU/mL 发酵液,在无菌环境下固定4 h 后,再接10 μL、104CFU/mL 的病原菌孢子悬浮液。
处理4(果实+纳他霉素+病原菌):先接种10 μL、104CFU/mL 的病原菌孢子悬浮液,再接种20 μL 的纳他霉素溶液。
每12 h 观察记录病斑直径、腐败率和病情指数。病斑直径用游标卡尺测量。

表1 病情指数分级标准Table 1 Classification criteria of disease index
腐败率和病情指数公式见式(1)(2)[38-39]。

1.3.3 贝莱斯芽孢杆菌与病原菌相互作用
(1)贝莱斯芽孢杆菌与病原菌体外相互作用
将拮抗菌和病原菌进行平板对峙,28 ℃恒温培养60 h,用无菌牙签挑取抑菌圈周围的菌丝置于小玻璃瓶中,将其标号为处理组,正常生长培养的病原菌菌丝作为对照组,两组均用2.5%戊二醛溶液4 ℃固定24 h,依次放入不同浓度(45%、55%、65%、75%、85%、95%、100%)的乙醇各脱水20 min,采用临界点干燥法进行样品干燥,喷金处理。在扫描电镜下观察并进行拍照。
(2)贝莱斯芽孢杆菌与病原菌体内相互作用
用灭过菌的接种针在樱桃赤道部位上刺一个3 mm×3 mm×3 mm 的伤口。立即接种20 μL 浓度为104CFU/mL 的拮抗菌。4 h 以后再接种10 μL 浓度为104CFU/mL 的病原菌,装入聚乙烯袋中以保持95%左右的湿度。
处理24 h 以后,切下1~2 mm2的伤口组织,立即转移到FAA 固定液(50%乙醇89 mL,冰乙酸6 mL,甲醛5 mL),固定至少4 h。在固定液中的材料,依次经过95%无水乙醇、100%无水乙醇、75%无水乙醇+25%乙酸异戊酯、50%无水乙醇+50%乙酸异戊酯、25%无水乙醇+75%乙酸异戊酯、100%乙酸异戊酯系列脱水,每级15 min。干燥的材料在解剖镜下用双面胶带粘在金属台上,用离子溅射仪上对金属台进行喷金镀膜。采用扫描电镜进行扫描。
1.4 数据处理
试验数据用Excel 2013 与Origin 2021 软件进行计算和作图,SPSS 软件进行方差分析和显著性分析。试验数据用“平均值±标准差”表示。
2 结果与分析
2.1 拮抗菌的生长曲线
图1 显示了贝莱斯芽孢杆菌的生长曲线,由图知,贝莱斯芽孢杆菌在4 h 时进入对数生长期,此时菌体生长速率最快,代谢旺盛;12 h 时进入稳定生长期,此时总菌落数最大,代谢物质积累最多,重要的次级代谢产物产生较多;当生长到18 h 之后菌体浊度开始降低,细胞出现凋亡。
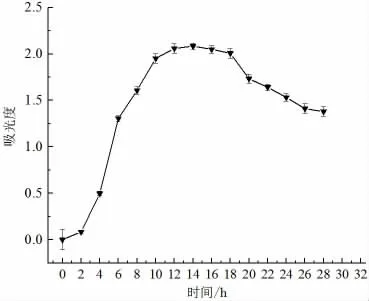
图1 拮抗菌贝莱斯芽孢杆菌的生长曲线Fig.1 Antagonistic bacteria growth curve of B. velezensis
2.2 贝莱斯芽孢杆菌发酵条件的优化
2.2.1 贝莱斯芽孢杆菌的菌悬液、发酵液、发酵上清液对病原菌的抑制效果
通过对不同处理组病斑直径的测定发现,拮抗菌贝莱斯芽孢杆菌的菌悬液、发酵液和发酵上清液对病原菌的抑制效果不同(见表2)。菌悬液与对照组无显著性差异,对软腐病病原菌抑菌效果不明显,而发酵液和发酵上清液抑菌效果显著(P<0.05),抑菌率达到(69.82±1.43)%和(59.14±0.85)%。
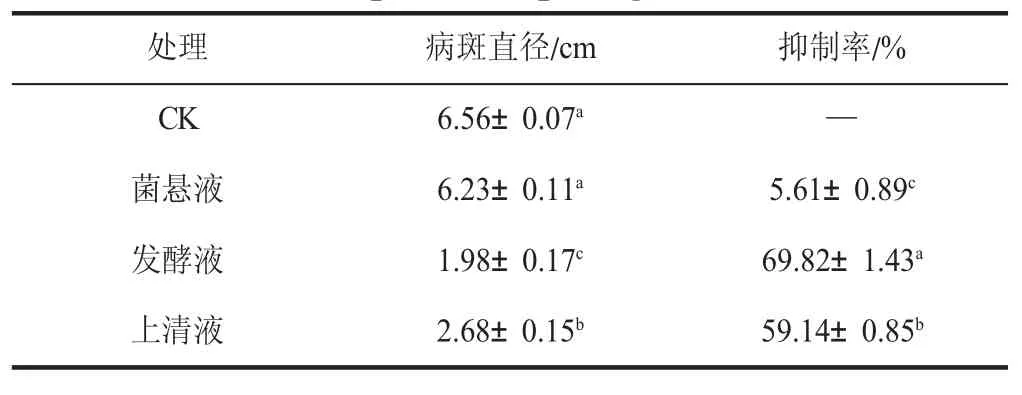
表2 贝莱斯芽孢杆菌的菌悬液、发酵液、发酵上清液对病原菌的抑制效果Table 2 The effect of B. velezensis strain of the bacterial suspension,the fermentation broth,the fermentation supernatant pathogen
2.2.2 贝莱斯芽孢杆菌发酵液抑菌温度的优化
拮抗细菌培养温度影响其代谢产物的积累和利用,温度过低影响细菌生长,使发酵效率降低,温度过高则会导致体内酶失活,细菌衰亡。因此适合的温度可以使细菌快速增长,提升代谢产物的积累[1-2]。由图2 可知,贝莱斯芽孢杆菌菌株在37 ℃下抑菌效果最好,抑菌率达到58.22%,30 ℃次之,25 ℃最低;且3 个处理组呈差异显著(P<0.05),因此37 ℃是菌株贝莱斯芽孢杆菌产生抑菌物质的最佳发酵温度。

图2 发酵液抑菌温度的优化Fig.2 Optimization of fermentation temperature conditions
2.2.3 贝莱斯芽孢杆菌发酵液抑菌时间的优化
如图3 所示,菌株贝莱斯芽孢杆菌在不同的发酵时间下抑菌效果不同,拮抗物质的产量总体呈现先上升后下降的趋势,在0~96 h 抑菌物质逐渐积累,在96 h 抑菌效果最好,抑菌率为62.98%,且96 h 与其他处理时间成显著性差异(P<0.05),在120 h 抑菌率下降,说明抑菌物质不能长时间保持活性,因此96 h 为菌株贝莱斯芽孢杆菌产生抑菌物质的最佳发酵时间。

图3 发酵时间的优化Fig.3 Optimization of fermentation time
2.2.4 贝莱斯芽孢杆菌发酵液抑菌pH 的优化
发酵培养基pH 对菌体的生长及代谢产物的产生有较大的影响[3-5]。如图4 所示,菌株贝莱斯芽孢杆菌在酸性和碱性条件下的抑菌效果均不如中性条件下的,pH 6.5时菌株贝莱斯芽孢杆菌的抑制效果最佳,抑制率为63.33%,与其他处理组均呈显著性差异(P<0.05),因此,pH 6.5 是菌株贝莱斯芽孢杆菌产生抑菌物质的最佳pH。综上所述,在发酵温度37 ℃、发酵pH 6.5 及发酵时间96 h 的条件下,贝莱斯芽孢杆菌对匍枝根霉的抑制效果最好,对甜樱桃软腐病有较好的抑制作用。

图4 发酵pH 的优化Fig.4 Optimization of fermentation pH
2.3 贝莱斯芽孢杆菌体内验证试验
2.3.1 不同拮抗菌处理液的抑菌效果
如图5(见下页)所示,菌悬液、发酵液及上清液对软腐病都有一定的抑制作用,其中发酵液处理组病斑直径和腐败率均较小,抑制效果较好,上清液效果较差。在28℃培养48 h 后,水处理组和NB 培养基处理组均已全部发病,病斑直径分别为(23.54±1.56)mm 和(22.87±1.24)mm,而此时发酵液处理组的腐败率仅20.58%,病斑直径(6.77±1.41)mm,与其他处理组均呈显著性差异(P<0.05)。菌悬液处理组和发酵上清液处理组对软腐病的腐败率和病斑直径差异不显著(P<0.05)。因此选用拮抗菌贝莱斯芽孢杆菌发酵液用于后续实验。
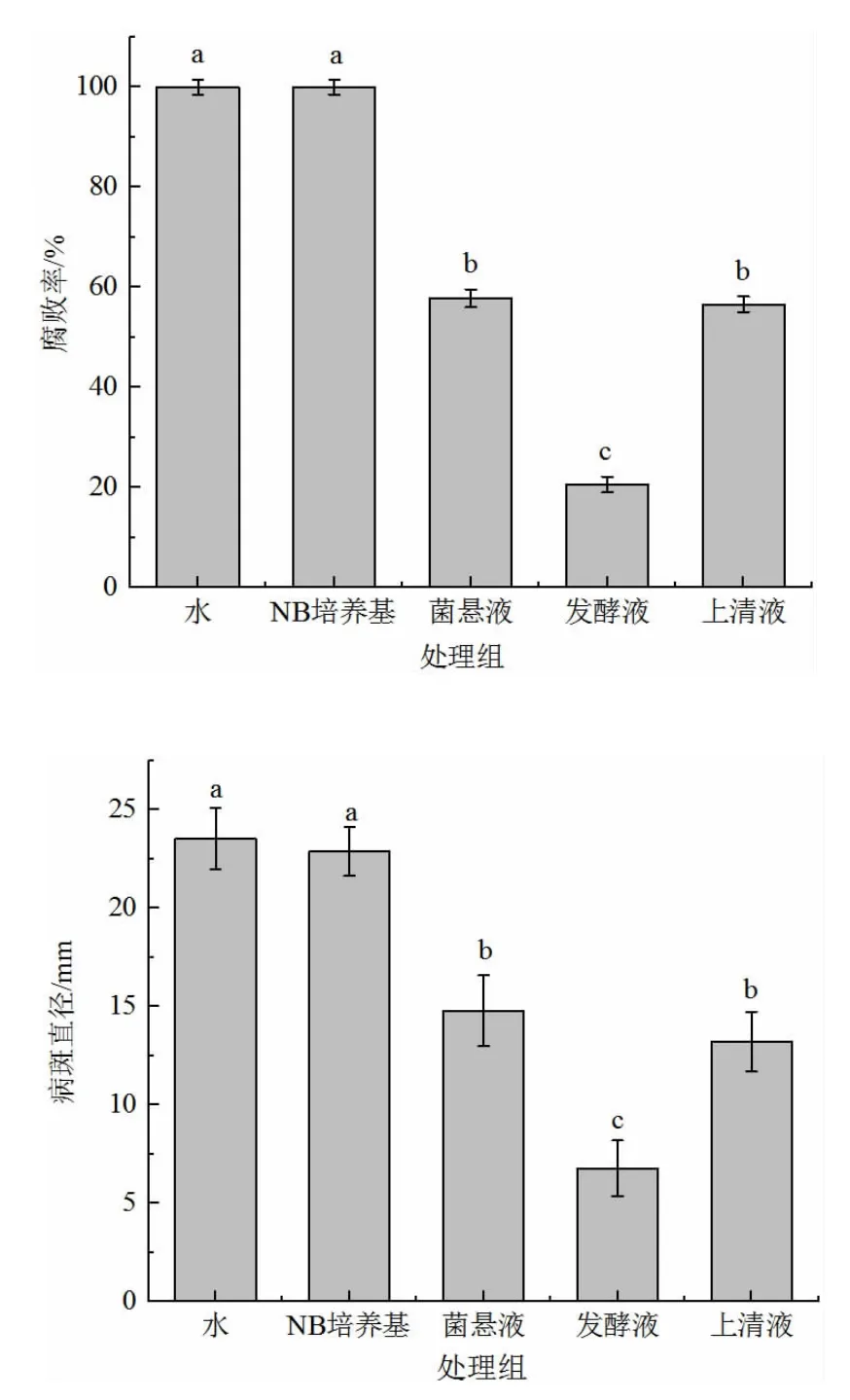
图5 不同处理对甜樱桃腐败率和病斑直径的影响Fig.5 Effects of different treatments on the rot rate and lesion diameter of sweet cherry
2.3.2 拮抗菌发酵液浓度的筛选
由图6 可以看出,不同浓度的贝莱斯芽孢杆菌发酵液对甜樱桃软腐病的抑制效果不同,随着浓度的变化,抑制作用显著变化。处理组A(果实+病原菌+1×109CFU/mL 发酵液)的抑制效果最好,软腐病的腐败率仅为20.58%,病斑直径为(6.77±1.41)mm,且与其他处理组均成显著性差异(P<0.05)。此时CK 处理组发病率已达100%。随着发酵液浓度的降低,对软腐病效果越弱。当菌悬液浓度为1×107CFU/mL,抑制效果不显著。因此拮抗菌发酵液的最佳抑菌浓度为1×109CFU/mL。

图6 不同浓度的拮抗菌发酵液对甜樱桃腐败率和病斑直径的影响Fig.6 Effects of different concentrations of antagonistic fermentation broth on the rot rate and lesion diameter of sweet cherry
2.3.3 拮抗菌发酵液对甜樱桃果实的抑菌效果
由图7 可以看出,图7A、B 为甜樱桃处理组在28 ℃放置24 h 和48 h 的结果。由图可知,当24 h 时,各处理组均无腐败现象。在48 h 时,对照组(果实+病原菌)完全腐败,处理组1~3(果实+发酵液+病原菌)和处理4(果实+纳他霉素+病原菌)腐败不明显。

图7 甜樱桃不同时间的腐败情况Fig.7 Spoilage of sweet cherry at different time
图8 是接种病原菌12、24、36、48 h 后调查的果实发病率和病斑直径。结果发现,贝莱斯芽孢杆菌对采后甜樱桃软腐病具有一定的防治效果。在36 h 时,CK 组(果实+病原菌)开始发病,腐败率达到88.75%,处理2(果实+稀释5 倍的109CFU/mL 发酵液+病原菌)和处理3(果实+108CFU/mL 发酵液+病原菌)腐败率达到6.25%和10%,处理1(果实+109CFU/mL 发酵液+病原菌)和处理4(果实+纳他霉素+病原菌)均未发病。在48 h 时,所有处理组均有果实发病,CK 组腐败率达到100%,处理2 和处理3 的腐败率分别达到50%、55.07%。其中处理1 腐败率最低,仅20.58%,防治效果能达到79.42%。在48 h 的贮藏期间,4 个处理组的病斑直径均有所降低,其中处理1 效果更佳,差异显著性均有所降低。

图8 不同处理对甜樱桃腐败率、病斑直径及病情指数的影响Fig.8 Effects of different treatments on the decay rate,lesion diameter and disease index of sweet cherry
从病情指数看,36 h 时CK 组病情指数较大,达到64.58%,处理2(果实+稀释5 倍的109CFU/mL 发酵液+病原菌)和处理3(果实+108CFU/mL 发酵液+病原菌)病情指数为3.75%和6.25%,处理1 和处理4 的病情指数为0;在48 h 时,CK 组病情指数较大,达到97.82%,处理2 和处理3 的病情指数为44.93%和46.87%,处理1 和处理4 的病情指数为13.97%和2.69%。
2.4 贝莱斯芽孢杆菌与病原菌的相互作用
2.4.1 贝莱斯芽孢杆菌与病原菌体外相互作用
从图9 可以看出,对照组和处理组菌丝微观结构上有较大不同。由图A 和D 可知,对照组(A)菌丝较长,孢子囊柄直立,不分枝;处理组(D)孢子囊柄断裂;由图B和E 可知,对照组(B)孢子囊健康饱满,呈近球形,有疣状突起;处理组(E)孢子囊呈畸形并伴有表面凹陷、褶皱、粗糙、不平整现象。由图C 和F 可知,对照组(C)表面有黑色点状物质,表面不光滑;处理组(F)有裂痕产生。由此可见,拮抗菌能够破坏病原菌的菌丝结构,从而杀死病原菌。

图9 病原菌菌丝受拮抗菌发酵液处理后的扫描电镜Fig.9 Scanning electron microscope of pathogenic mycelium after treatment with antagonistic antibacterial fermentation broth
2.4.2 贝莱斯芽孢杆菌与病原菌体内相互作用
贝莱斯芽孢杆菌与病原菌RF 在甜樱桃伤口处共同培养36 h 以后,采用扫描电镜(SEM)观察,如图10 所示,由图知,图A 和图B 显示对照组病原菌在甜樱桃伤口处大量繁殖,产生菌丝,造成果实腐败;图C 和图D 显示处理组拮贝莱斯芽孢杆菌在甜樱桃果实伤口部位迅速繁殖,与病原菌进行营养和空间竞争,并且可以观察出病原菌菌丝体聚集着很多拮抗菌,同时拮抗菌贝莱斯芽孢杆菌能够紧密地吸附在病原菌RF 的菌丝体上。
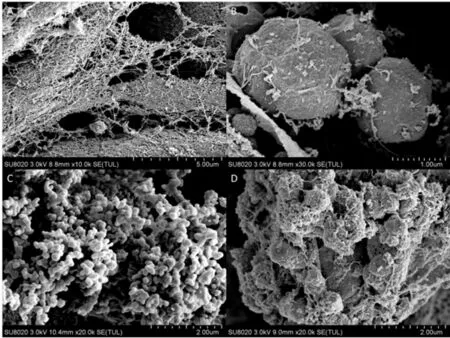
图10 果实经拮抗菌处理后的扫描电镜Fig.10 Scanning electron microscope of fruits after antagonistic treatment
3 结论与讨论
软腐病是一种在贮藏期危害最严重的病害,发病迅速且难于防治[40],因此对于此病的研究较少。虽然该病在多个国家被相继报道,但是具体的防治措施以及引起该病的主要病原菌方面还存在争议[41]。本实验研究了拮抗菌贝莱斯芽孢杆菌对软腐病病原菌的拮抗作用,结果发现其有一定的抑菌效果,对软腐病也有较好的防治作用,为甜樱桃的防腐保鲜研究提供了新方向。
生防菌株的研发与应用对防治果蔬微生物病害具有重要意义。用来抑制甜樱桃软腐病的生防菌株为贝莱斯芽孢杆菌(B.velezensis)[42]。贝莱斯芽孢杆菌用于生防抑制真菌腐败已有较多研究,如杨胜清等[43]研究表明贝莱斯芽孢杆菌的粗蛋白提取液对番茄早疫病菌(Alternaria solani)具有明显的抑制效果;王雨等[44]研究表明贝莱斯芽孢杆菌HN-2 的主要活性物质为脂肽类物质,其对植物病原真菌有较好的防治效果;孙旺旺等[45]发现贝莱斯芽孢杆菌是一株对生菜软腐病和菌核病具有拮抗作用的潜在生防菌;谭峥等[46]发现莱斯芽胞杆菌HN-2正丁醇提取物具有开发成为生物源农药的潜力。
贝莱斯芽孢杆菌具有生长快、易培养、抗逆、抑菌等特点,在自然界广泛分布,绝大多数菌株对人畜无害且不会污染环境,是开发生防菌的主要来源之一[47]。在本实验的贝莱斯芽孢杆菌发酵液抑菌条件的优化中,得出发酵温度37 ℃、发酵pH 6.5 及发酵时间96 h 的条件下,对引起甜樱桃软腐病的匍枝根霉有较好的抑菌效果。目前对于樱桃软腐病的防治措施多为化学药剂防治,如樱桃树发芽前喷3~5°Be 石硫合剂,初花期、落花后喷洒47%加瑞农可湿性粉剂700 倍液、53.8%可杀得干悬浮剂1 000 倍液、12%松酯酸铜乳油600 倍液、50%百菌清可湿性粉剂700 倍液或25%多菌灵可湿性粉剂800 倍液[48]等,这些方法不仅污染环境,有药剂残留,且防治效果也在逐年降低[49]。本实验采用的贝莱斯芽孢杆菌抗逆性强,生物安全性好,比化学防治更安全,防治效果和抑菌效果更好,并且具有促生作用,比其他的拮抗菌更有利于甜樱桃的生长[50]。
在研究贝莱斯芽孢杆菌与病原菌RF 的相互作用时,体外实验中,通过扫描电镜(SEM)得出拮抗菌处理会导致病原菌菌丝破裂,孢子囊发生畸形和凹陷;体内实验中,通过扫描电镜(SEM)得出拮抗菌会在伤口部位大量繁殖,紧紧依附病原菌菌丝,可能是营养与空间竞争作用,起到抑菌效果。
总之,拮抗菌贝莱斯芽孢杆菌,对匍枝根霉有较好的抑菌效果,对甜樱桃软腐病的防治效果能达到79.42%,有较明显的拮抗作用,为甜樱桃软腐病的生物防治提供了理论依据。由相关实验得知[51],拮抗菌贝莱斯芽孢杆菌产生的抑菌物质初步判断为蛋白类,但是具体抑菌物质和作用机制仍未可知,后续本实验室将继续研究抑菌成分和作用机制,为贝莱斯芽孢杆菌的生防利用奠定基础。
