术前TACE治疗对肝癌患者黏着斑激酶、核因子-κBp65表达及术后生存率的影响
2022-01-26蔡越飞洗重杨马艳华舒安康
原发性肝癌是世界上发病率最高的恶性肿瘤之一,在我国是排第4位 的常见恶性肿瘤,肿瘤致死病因排第2位,严重威胁人民的健康和生命
。肝细胞癌(HCC)占原发性肝癌的85%~90%
,手术切除是肝癌的首选治疗方法,但由于本病起病隐匿,发现时多为中晚期,80%~90%的患者就诊时就已失去了手术切除的机会
。即使可以手术的患者,其远期疗效差,患者3年复发率高达50%、5年复发率高达70%
。经导管肝动脉化疗栓塞术(TACE)是目前公认的中晚期肝癌的首选治疗方法,能够有效延长患者的生存时间,提高生命质量
。黏着斑激酶( FAK)是蛋白质酪氨酸激酶中的一个家族,近年来大量研究表明,FAK在多数肿瘤中高表达,尤其是在消化道肿瘤中,其活性与肿瘤的转移、 侵袭密切相关,可作为肿瘤诊疗、预后的评价指标
。激活核因子-κB(NF-κB)是一种广泛存在于哺乳动物中的转录因子,有研究表明,NF-κBp65的持续活化可促进肿瘤细胞的增殖,减弱肿瘤细胞的凋亡,在肿瘤的发生、发展过程中发挥重要作用
。本研究选择在原发性肝癌患者手术切除治疗前行TACE治疗的患者作为研究对象,收集患者术后病理标本,检测癌组织中FAK和NF-κBp65的表达,探究FAK、NF-κBp65表达与患者3年生存率间的关联。
1 资料与方法
1.1 一般资料 收集2015年6月至2017年6月我院收治的在手术切除治疗前行TACE治疗的原发性肝癌患者56例作为研究对象。术前接受TCAE治疗的患者均因病灶位置及大小、肺功能障碍或高龄等原因不能直接手术切除。所有患者接受TACE治疗后行手术切除治疗,收集患者手术切除的癌组织及癌旁组织,癌旁组织距离肿瘤边缘2~5 cm。出院后对所有患者进行3年的随访,记录患者的生存状况。本研究已经本院医学伦理委员会审查通过。
1.2 方法 所有患者入院后均行TACE治疗,TACE治疗后2个月内行手术切除治疗。手术中收集患者癌组织标本,检测标本中FAK、NF-κBp65蛋白的表达。
1.3 结果判断 FAK、NF-κBp65主要位于细胞质,出现棕黄色颗粒为阳性细胞。每张切片随机观察5个高倍镜(×400)视野,根据阳性细胞数的百分数进行判定,阳性细胞<10%为阴性,阳性细胞数10%~50%为弱阳性,阳性细胞数>50%为强阳性。
1.4 统计学方法 采用SPSS 22.0进行统计学处理,计量资料采用(均数±标准差)表示,组间差异采用
检验;计数资料用率表示,组间差异采用χ
检验。随访结束,以患者是否死亡作为试验终点,采用Cox回归分析影响患者3年死亡的独立危险因素。
<0.05表示差异具有统计学意义。
2 结果
2.1 免疫组织化学结果 FAK在癌组织、癌旁组织以及正常肝组织的阳性率分别为75.0%(42/56)、41.07%(23/56)、10.71%(6/56);NF-κBp65在癌组织、癌旁组织以及正常肝组织的阳性率分别为78.57%(44/56)、33.93%(19/56)、12.5%(7/56),癌组织中FAK、NF-κBp65阳性表达率均显著高于癌旁组织。
2.3 癌组织NF-κBp65表达与一般临床资料间的关系 根据NF-kBp65表达情况,NF-kBp65表达阳性的患者,肝内转移、门静脉癌栓者所占比例显著高于NF-kBp65表达阴性患者;NF-kBp65表达阳性患者中,Edmondson分级Ⅲ~Ⅳ、TNM分级Ⅲ~Ⅳ所占比例显著大于NF-kBp65表达阴性患者,差异具有统计学意义。NF-kBp65表达与患者的年龄、性别无关,见表2。
本次检测期间,天气晴朗,气温35℃左右,由于混凝土中钢筋吸收探地雷达电磁波脉冲信号,返回信息较弱,对测量数据造成一定干扰。
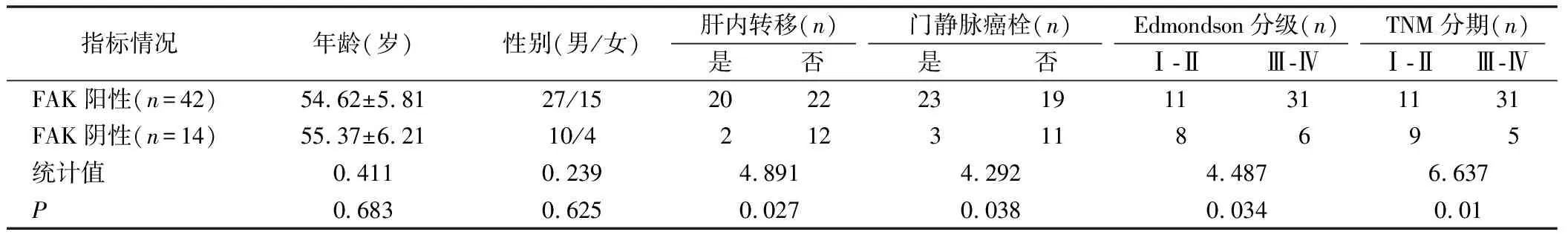
2.2 癌组织FAK表达与一般临床资料间的关系 根据FAK表达情况,FAK表达阳性患者,肝内转移、门静脉癌栓所占比例显著显著高于FAK表达阴性患者;FAK表达阳性患者中,Edmondson 分级Ⅲ~Ⅳ、TNM分级Ⅲ~Ⅳ所占比例显著大于FAK表达阴性患者,差异具有统计学意义。FAK表达与患者的年龄、性别比无关,见表1。
科恩于1922年出生在纽约市。他的父母均为法律专业人士,然而科恩在纽约市立学院求学时却选择了物理,并于1940年毕业。他在哥伦比亚大学获得了硕士学位,之后在1943年应召入伍,在医疗部队做研究工作。1945年,他被派往广岛,研究这座城市被投放原子弹后遭受的影响。
后期疫情防治工作的重点。商品活猪调运仍旧严格限制,严格管理调运车辆,查处生猪违规交易和违规跨省外调;防控境外疫情再次传入;保障区域猪肉供给;完善问责制度。

肝癌患者在行手术切除治疗前进行TACE治疗可有效提高患者的生存率,有研究表明,术前行TACE治疗后手术切除的原发性肝癌患者,癌组织中FAK、NF-κBp65表达阳性率显著提高,但FAK、NF-κBp65表达与患者的生存预后间的关联目前尚缺乏相关研究证明
。本研究通过检测癌组织FAK、NF-κBp65的表达情况,进一步分析了其与患者3年生存率间的关联。
政府认为20%~22%的核电份额目标是能够实现的,但需要满足三个前提条件:30台机组重启,2台在建机组按计划投运,以及允许在运机组延寿20年,即将运行寿期从最初的40年延长到60年。
3 讨论
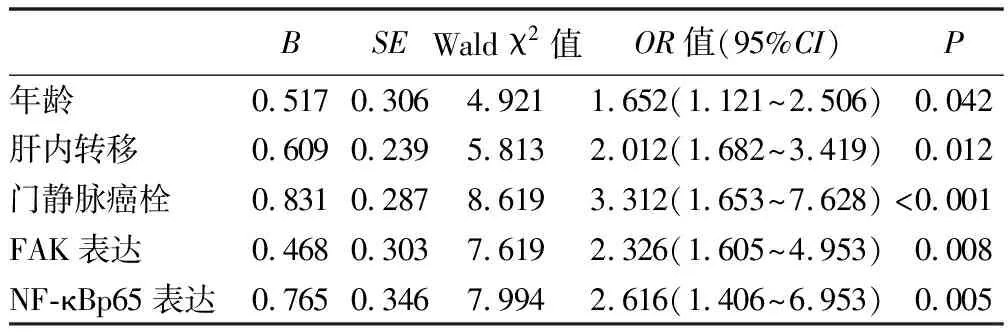
2.4 影响患者3年生存率的独立危险因素 根据患者术后3年是否存活,采用多因素Cox回归分析影响患者3年生存率的独立相关因素。其中,年龄、肝内转移、门静脉瘤栓、FAK表达以及NF-kBp65表达均是影响患者术后3年生存的独立危险因素,见表3。
人FAK基因全长4285碱基,分子质量125 ku,FAK作为生长因子受体信号通路的下游分子,使得Caspase-3失活从而抑制细胞的凋亡
;FAK参与P130cas-Crk-JNK-C-Jun通路使得金属基质蛋白酶(MMP-2、MMP-9)活化,增强肿瘤的侵袭力
;FAK还可激活RAS-MAPK-ERK、PI3K-AKT等信号通路,促进肿瘤细胞的增殖
,FAK的过表达可改变细胞的局部粘附能力,促进细胞的增殖、转移和侵袭,与肝癌的发生、发展密切相关。目前研究发现,FAK核酸及蛋白水平在乳腺癌、前列腺癌、大肠癌以及卵巢癌等多种组织中处于过度激活和高表达的状态
。本研究结果表明,FAK在肝癌组织中的阳性表达率显著高于癌旁组织以及正常肝组织。有研究表明,人肝癌细胞株在缺氧环境中,侵袭能力增强且FAK表达水平显著升高
。TACE治疗过程中,阻断肿瘤供血,造成环境缺氧,促进癌组织FAK表达阳性。FAK表达阳性与患者肿瘤病理分化程度、TNM分期、转移等因素存在相关性
。本研究中,术前行TACE的患者,肝癌组织FAK表达阳性与患者的肝内转移、门静脉癌栓Edmondson分级Ⅲ~Ⅳ以及TNM分级等有关,与文献报道的结论一致。
p50和p65是人NF-κB家族中重要的核转录因子,NF-κB p65可诱导细胞表达大量的抗凋亡基因,抑制肿瘤细胞凋亡,并激活原癌基因
,研究表明,其表达与食管癌、胃癌、肝癌等恶性肿瘤密切相关
。本研究结果表明,癌组织NF-κB p65表达阳性率显著高于癌旁组织及正常肝组织,与文献报道的结论一致。肿瘤耐药机制研究表明,多种耐药细胞系中存在着异常的NF-κB表达,可能是化疗导致的DNA损伤激活NF-κB阻止细胞凋亡,从而导致NF-κB阳性表达
。有研究表明,肝细胞癌中NF-κB p65蛋白高表达,肿瘤的分化程度、存在淋巴结转移等与其高表达有关
。本研究结果表明,NF-κB p65蛋白表达阳性与患者肿瘤病理分化程度、TNM分期、存在门静脉癌栓、转移等因素存在相关性。有研究表明,NF-κB p65的阳性表达率在Edmondson分级Ⅲ~Ⅳ的癌细胞显著高于Edmondson分级Ⅰ~Ⅱ的患者
,与本研究结论一致。
本研究结果表明,年龄、肝内转移、门静脉瘤栓以及FAK和NF-kBp65表达阳性均是影响患者术后3年生存的独立危险因素。存在门静脉癌栓易造成肝内外转移,加速门静脉高压的形成引起食管静脉曲张破裂出血,是目前统一认可的影响患者生存率的一大主要因素
。肿瘤转移是目前公认的影响预后的又一指标之一,原发性肝癌患者中,无转移、肝内转移、腹腔淋巴结转移患者的中位生存时间依次下降
。原发性肝癌患者中FAK、NF-κBp65表达阳性患者生存率显著小于表达阴性的患者,是影响患者生存的显著相关因素
。
综上所述,肝癌患者手术切除前行TACE治疗后癌细胞中FAK、NF-κBp65表达阳性是影响患者3年生存率的独立危险因素。本研究初步探究了FAK、NF-κBp65表达与手术切除前行TACE治疗原发性肝癌患者的3年生存率间的相关性,但样本量有限,未进一步探究TACE化疗药物及化疗次数、时间等对FAK、NF-κBp65蛋白及患者生存率的影响,肝癌细胞中FAK、NF-κBp65与患者生存预后间的确切关系尚需进一步扩大样本量进行探究。
[1] 中华人民共和国国家卫生健康委员会医政医管局.原发性肝癌诊疗规范(2019年版)[J]. 中华肝脏病杂志, 2020, 28(2):112-128.
[2] Likhitsup A, Razumilava N, Parikh ND. Treatment for advanced hepatocellular carcinoma: current standard and the future[J]. Clin Liver Dis (Hoboken), 2019,13(1): 13-19.
[3] Ponziani FR, Nicoletti A, Gasbarrini A,
. Diagnostic and therapeutic potential of the gut microbiota in patients with early hepatocellular carcinoma[J]. Ther Adv Med Oncol, 2019,11: 1758835919848184.
[4] Thylur RP, Roy SK, Shrivastava A,
. Assessment of risk factors, and racial and ethnic differences in hepatocellular carcino-ma[J]. JGH Open, 2020,4(3): 351-359.
[5] Moawad AW, Szklaruk J, Lall C,
. Angiogenesis in hepatocellular carcinoma; pathophysiology, targeted therapy, and role of imaging[J]. J Hepatocell Carcinoma, 2020,7: 77-89.
[6] Francalanci P, Giovannoni I, De Stefanis C,
. Focal Adhesion Kinase (FAK) over-expression and prognostic implication in pediatric hepatocellular carcinoma[J]. Int J Mol Sci, 2020,21(16).
[7] Xia L, Zhang B, Yan Q,
. Effects of saponins of patrinia villosa against invasion and metastasis in colorectal cancer cell through NF-kappaB signaling pathway and EMT[J]. Biochem Biophys Res Commun, 2018,503(3): 2152-2159.
[8] 王惠文, 刘瑞宝, 刘岩,等.原发性肝癌TACE后FAK、NF-κBp65表达及意义[J]. 介入放射学杂志, 2011, 20(8):621-624.
[9] Kanteti R, Mirzapoiazova T, Riehm JJ,
. Focal adhesion kinase a potential therapeutic target for pancreatic cancer and malignant pleural mesothelioma[J]. Cancer Biol Ther, 2018,19(4): 316-327.
[10] Almstedt K, Sicking I, Battista MJ,
. Prognostic significance of focal adhesion kinase in node-negative breast cancer[J]. Breast Care (Basel), 2017,12(5): 329-333.
[11] Zhang J, Chen Y, Lin J,
. Cyclovirobuxine d exerts anticancer effects by suppressing the EGFR-FAK-AKT/ERK1/2-Slug signaling pathway in human hepatocellular carcinoma[J]. DNA Cell Biol, 2020,39(3): 355-367.
[12] Zhou J, Yi Q, Tang L. The roles of nuclear focal adhesion kinase (FAK) on Cancer: a focused review[J]. J Exp Clin Cancer Res, 2019,38(1): 250.
[13] Fang Y, Wang D, Xu X,
. Synthesis, biological evaluation, and molecular dynamics (MD) simulation studies of three novel F-18 labeled and focal adhesion kinase (FAK) targeted 5-bromo pyrimidines as radiotracers for tumor[J]. Eur J Med Chem, 2017,127: 493-508.
[14] Wang R, Yu Z, Chen F,
. miR-300 regulates the epithelial-mesenchymal transition and invasion of hepatocellular carcinoma by targeting the FAK/PI3K/AKT signaling pathway[J]. Biomed Pharmacother, 2018,103: 1632-1642.
[15] Awah CU, Tamm S, Hedtfeld S,
. Mechanism of allele specific assembly and disruption of master regulator transcription factor complexes of NF-KBp50, NF-KBp65 and HIF1a on a non-coding FAS SNP[J]. Biochim Biophys Acta, 2016,1859(11): 1411-1428.
[16] Torrealba N, Vera R, Fraile B,
. TGF-beta/PI3K/AKT/mTOR/NF-kB pathway. Clinicopathological features in prostate cancer[J]. Aging Male, 2019: 1-11.
[17] Zhang CN, Zhang JL, Huang Y,
. Dibutyltin depressed immune functions via NF-kappaB, and JAK/STAT signaling pathways in zebrafish (Danio rerio)[J]. Environ Toxicol, 2018,33(1):104-111.
[18] 于营. AEG-1、NF-κBp65在人原发性肝细胞癌中的表达及临床意义[D]. 贵州医科大学, 2016:1-52.
[19] Kang D, Shim S, Cho J,
. Systematic review of studies assessing the health-related quality of life of hepatocellular carcinoma patients from 2009 to 2018[J]. Korean J Radiol, 2020,21(6): 633-646.
[20] Liu A, Wu Q, Peng D,
. A novel strategy for the diagnosis, prognosis, treatment, and chemoresistance of hepatocellular carcinoma: DNA methylation[J]. Med Res Rev, 2020,40(5): 1973-2018.
