REV感染对SPF雏鸡胸腺细胞凋亡及BCL-2的影响
2022-01-25吴文杰赵晨辉高雪丽刘超男吕晓萍顾先哲郑世民
吴文杰,赵晨辉,边 洋,高雪丽,刘超男,吕晓萍,顾先哲,郑世民
(东北农业大学 动物医学学院 黑龙江省实验动物与比较医学重点实验室,黑龙江 哈尔滨 150030)
禽网状内皮组织增生病(RE)是由禽网状内皮组织增生病病毒(reticuloendotheliosis virus,REV)感染多种禽类引起的病理综合征,其症状包括免疫抑制、急性网状细胞瘤、矮小综合征等。REV的宿主限于禽类,包括火鸡、鸡、日本鹌鹑、鸭等,主要侵害并损伤禽免疫器官(胸腺、脾脏、法氏囊等),引起免疫抑制。感染REV的禽类免疫机能下降,除导致病禽对其他禽病疫苗的应答机能减弱、甚至丧失外,常常出现继发感染和混合感染,对禽类养殖业造成较大经济损失。目前报道的REV主要有2种类型的毒株:REV-T株为复制缺陷型,分离自疑似淋巴细胞白血病的成年火鸡[1];REV-A株为复制辅助型,无致瘤作用,但可辅助T株进行复制[2]。
REV自身能够调控感染细胞的凋亡[3],有研究认为[4],REV感染动物后激活了宿主细胞的凋亡基因。细胞凋亡由3种途径所介导,即外源性途径、内源性途径和内质网途径。其中,内源性途径主要受BCL-2家族调节。BCL-2是内源性途径的重要元件,能维持线粒体膜的完整,发挥抑凋亡作用[5-7]。REV或RE的国内外现有研究资料主要集中在该病的流行病学、病原的分子生物学、特异性诊断等方面。有关该病的确切发生机制,尤其是分子发生机制研究相对较少。BCL-2与REV感染所致SPF雏鸡胸腺细胞凋亡之间的内在联系也少有研究。故本研究检测了REV感染SPF雏鸡后1,7,14,21,28,42 d,其胸腺细胞凋亡以及BCL-2的mRNA表达和蛋白含量的动态变化,探讨REV感染雏鸡引起的胸腺细胞凋亡与BCL-2的关系,为进一步阐明REV的致病机制提供重要的试验依据。
1 材料与方法
1.1 实验动物1日龄SPF雏鸡60只,购自中国农业科学院哈尔滨兽医研究所SPF实验动物中心,按照SPF鸡饲养标准严格隔离饲养。
1.2 REV毒株REV-T株,购自中国兽医微生物菌种保藏管理中心,菌种号:CVCC NO.CACCAV107。经9~11胚龄SPF鸡胚増毒后,测定该毒株的TCID50为10-5.64/0.1 mL,使用时将之稀释105倍。
1.3 主要试剂及仪器设备TUNEL细胞凋亡检测试剂盒(南京凯基生物有限公司);TRIzol LS Reagent和M-MLV Reverse Transcriptase(美国英杰生命技术有限公司);pMD18-T Vector(大连宝生物工程有限公司);Platinum SYBR Green qPCR SuperMix-UDG(美国赛默飞世尔科技公司);Axy Prep质粒DNA小量试剂盒和Axy Prep DNA凝胶回收试剂盒(杭州爱思进生物技术有限公司);兔抗鼠BCL-2多克隆抗体和辣根过氧化酶(HRP)标记的山羊抗兔IgG(英国艾博抗公司);H600L显微病理成像系统(日本尼康映像仪器公司);ELx808酶标仪(美国伯腾仪器有限公司);LightCycler 2.0荧光定量PCR仪(美国罗氏公司);DYY-6C型电泳仪(北京六一仪器厂)。
1.4 试验设计和检测指标及方法
1.4.1实验动物分组及处理 将60只1日龄SPF雏鸡随机分为REV感染组和对照组,每组30只雏鸡。在1日龄时,REV感染组每只雏鸡经腹腔注射REV稀释液500 μL,对照组雏鸡经腹腔注射等量灭菌生理盐水。在病毒感染后1,7,14,21,28,42 d,每组随机抽取5只雏鸡,心脏采血处死,快速采集胸腺,进行后续试验。
1.4.2REV感染的SPF雏鸡胸腺凋亡细胞数量检测——TUNEL细胞凋亡检测试剂盒法 将采集的胸腺固定于4℃冰箱预冷的10%中性福尔马林溶液中,制成石蜡切片并常规脱蜡至水。参照TUNEL试剂盒说明书进行染色,随后脱水、透明、中性树胶封片,并于油镜下检查。每张切片随机选取5个视野,计数凋亡细胞数量。
1.4.3REV感染的SPF雏鸡胸腺BCL-2阳性细胞检测——免疫组织化学法 将采集的胸腺固定于4℃冰箱预冷的10%中性福尔马林溶液中,制成石蜡切片并常规脱蜡至水。使用二步法进行免疫组织化学染色、脱水、透明、中性树胶封片,并于油镜下检查。每张切片随机选取5个视野,计BCL-2阳性细胞数。同时设一抗(1∶50稀释的兔抗鼠BCL-2抗体)和二抗(1∶2 000稀释的HRP标记山羊抗兔IgG)对照。
1.4.4REV感染的SPF雏鸡胸腺BCL-2蛋白含量检测——间接ELISA法 将胸腺与裂解液按1∶9混合并充分研磨、离心,取上清并用包被缓冲液1∶800稀释,4℃冰箱过夜包被。次日,PBST洗涤3次,5 min/次。加封闭液于37℃恒温箱内封闭2 h。PBST洗涤3次,5 min/次。加一抗(1∶4 000稀释的兔抗鼠BCL-2多克隆抗体)并于37℃恒温箱内孵育1 h,PBST洗涤3次,5 min/次;加二抗(1∶5 000稀释的HRP标记山羊抗兔IgG)并于37℃恒温箱内孵育1 h。PBST洗涤3次,5 min/次。加入联苯二胺(OPD),37℃恒温箱内避光显色15 min。PBST洗涤3次,加入2 mol/L H2SO4终止显色,于酶标仪上测每孔的D490 nm值。每个样品设3个重复,并设置空白对照、一抗和二抗对照。
1.4.5REV感染的SPF雏鸡胸腺BCL-2 mRNA表达的检测—Quantitative real-time PCR法 (1)鸡胸腺BCL-2 mRNA表达qRT-PCR检测方法的建立:参考GenBank中已发表序列,利用软件DNAStar、Oligo 6.0设计bcl-2、β-actin基因引物(表1)。
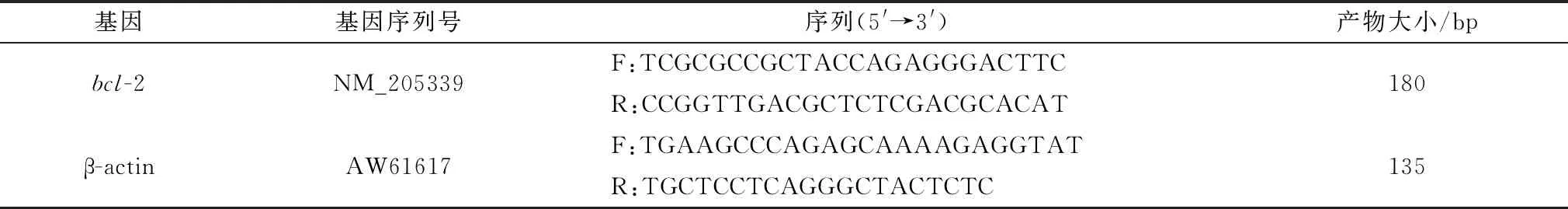
表1 引物序列及产物大小
用TRIzol法提取胸腺的总RNA,应用Oligo(dT)合成cDNA,并扩增目的片段bcl-2、β-actin。每次设阴性对照和空白对照。PCR反应体系:ddH2O 36.5 μL,10×PCR Buffer 5.0 μL,dNTP Mixture(2.5 mmol/L) 5.0 μL,cDNA 1.0 μL,上、下游引物(10 μmol/L)各1.0 μL,rTaq(5 000 U/L)0.5 μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,共30个循环;72℃终延伸10 min。经1.5%琼脂糖凝胶电泳验证PCR产物,回收目的条带并纯化。将纯化的目的片段与pMD18-T载体连接并转化于DH5α感受态细胞,经PCR及1.5%琼脂糖凝胶电泳鉴定阳性克隆,然后提取、扩增重组质粒,测序并检测其D260 nm/D280 nm值。当D260 nm/D280 nm值偏离1.8,则进一步纯化样品。并对引物浓度、模板用量、退火温度进行了优化。将bcl-2、β-actin阳性重组质粒进行梯度稀释(10-1,10-2,10-3,10-4,10-5,10-6,10-7,10-8),以此为模板进行qRT-PCR扩增。RT-PCR反应体系:Platinum SYBR Green qPCR SuperMix-UDG(2×) 10.0 μL,ddH2O 6.4 μL,模板2.0 μL,上、下游引物(10 μmol/L)各0.8 μL。qRT-PCR反应程序:95℃预变性2 min;95℃变性20 s,58℃退火20 s,72℃延伸10 s,45个循环。设阴性对照。确认引物熔解曲线、扩增曲线,并制作标准曲线,采用自动分析软件进行数据分析。
(2)REV感染雏鸡胸腺BCL-2 mRNA表达的检测采用RT-PCR法(2-△△Ct法):利用本部分(1)中的RT-PCR反应体系和反应程序对(1)中合成的胸腺cDNA进行扩增,每个样品设3个重复,并设阴性对照。内参基因为β-actin,由仪器输出Ct值。根据公式:△△Ct=待测样本(Ct目的基因-Ct内参基因)-校准样本(Ct目的基因-Ct内参基因),计算目的基因差异倍数=2-△△Ct,分析基因表达的相对差异。
2 结果
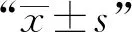
2.1 REV感染的SPF雏鸡胸腺中凋亡细胞数量变化根据图1可知,SPF雏鸡感染REV后,其胸腺中凋亡细胞的数量在整个试验期间始终高于对照雏鸡,且在感染后21,28 d出现显著(0.01
注:比较同一时间不同组别,*表示差异显著(P<0.05);**表示差异极显著(P<0.01);无标号则差异不显著(P>0.05)。下同
2.2 REV感染的SPF雏鸡胸腺中BCL-2阳性细胞数量变化由图2可见,与对照雏鸡相比,病毒感染雏鸡胸腺中BCL-2阳性细胞数量均有所增多,并在感染后21,28 d时明显增多(0.01
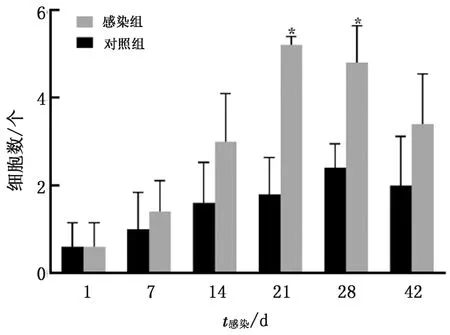
图2 REV感染的SPF雏鸡胸腺中BCL-2阳性细胞数量变化
2.3 REV感染的SPF雏鸡胸腺中BCL-2蛋白含量变化根据图3可知,SPF雏鸡感染REV后1~42 d,其胸腺中BCL-2蛋白含量均高于对照雏鸡。在21,28 d,病毒感染雏鸡胸腺的BCL-2蛋白含量较对照雏鸡显著升高(P<0.05),其余时间点未见统计学差异(P>0.05)。
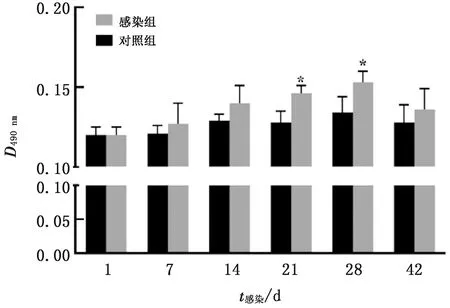
图3 REV感染的SPF雏鸡胸腺中BCL-2蛋白含量变化
2.4 qRT-PCR检测鸡胸腺BCL-2 mRNA表达方法的建立提取胸腺的总RNA(图4),可见5S、18S、28S的3条电泳带清晰,表明提取的RNA质量高,完整性好,可用于下一步试验。合成cDNA后扩增目的片段bcl-2、β-actin,条带大小分别为180,135 bp(图5A、C)。
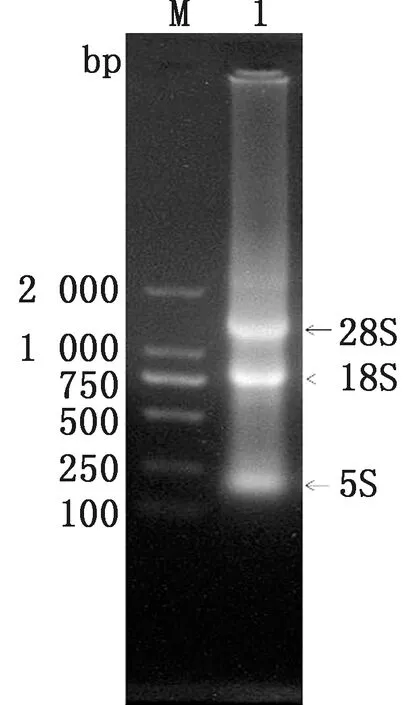
M.DL2000 DNA Marker;1.胸腺样品的总RNA
回收目的条带并纯化,与pMD18-T载体连接并转化于DH5α感受态细胞,鉴定阳性克隆,结果见图5B、D,条带大小与之前回收条带一致。对阳性克隆进行测序,将测序结果与GenBank中已收录的序列NM_205339、AW61617分别进行比对,发现序列一致,无核苷酸缺失或突变,此重组质粒可用于后续试验。
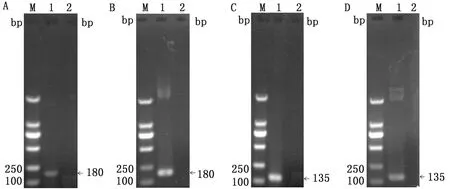
A. bcl-2基因扩增结果;B.重组质粒pMD18-T-bcl-2的鉴定结果;C.β-actin基因扩增结果;D.重组质粒pMD18-T-β-actin鉴定结果。M.DL2000 DNA Marker;1.PCR扩增产物;2.阴性对照
梯度稀释pMD18-T-bcl-2重组质粒和pMD18-T-β-actin重组质粒(10-1,10-2,10-3,10-4,10-5,10-6,10-7,10-8)并进行qPCR扩增,SDS软件生成扩增曲线(图6A、B)、引物熔解曲线(图6C、D)和标准曲线(图6E、F)。pMD18-T-bcl-2重组质粒和pMD18-T-β-actin重组质粒分别在91℃左右和86℃左右显示单峰,同时阴性对照曲线平直,说明引物特异性高,扩增产物单一。
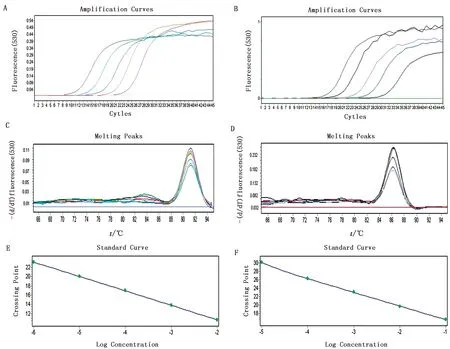
A.重组质粒pMD18-T-bcl-2标准品扩增曲线;B.重组质粒pMD18-T-β-actin标准品扩增曲线;C.重组质粒pMD18-T-bcl-2标准品引物熔解曲线;D.重组质粒pMD18-T-β-actin标准品引物熔解曲线;E.重组质粒pMD18-T-bcl-2扩增标准曲线;F.重组质粒pMD18-T-β-actin扩增标准曲线
2.5 REV感染的SPF雏鸡胸腺中BCL-2 mRNA表达变化由图7可知,SPF雏鸡感染REV后,其胸腺中BCL-2 mRNA表达均出现上升,而且在处理后21,28 d,病毒感染组的BCL-2 mRNA表达显著高于对照组(P<0.05)。其余时间点未见统计学差异(P>0.05)。
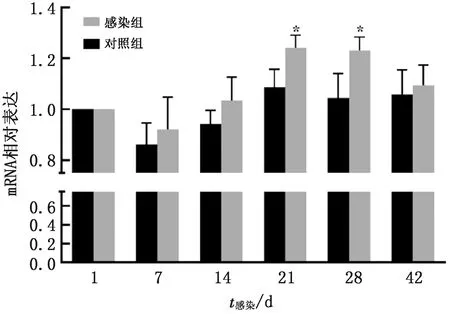
图7 REV感染的SPF雏鸡胸腺中BCL-2 mRNA表达变化
3 讨论
禽网状内皮组织增生病病毒(REV)可引起病禽的免疫抑制,使病禽对其他生物性致病因素,如禽白血病病毒(ALV-J)、马立克病病毒(MDV)等的易感性提高,更易出现继发感染、混合感染[8-12]。有研究报道[13-14],在REV与ALV-J共感染的鸡胚成纤维细胞中,上述2种病毒的复制均得到促进,并且在与REV混合感染时,ALV-J诱导的胸腺细胞凋亡也更加显著[15],而REV与MDV混合感染可使患病动物病情加重,MDV疫苗的免疫保护力显著降低[10];因此对REV感染引起的免疫抑制机制的研究尤为重要。
免疫器官的损伤、萎缩是REV引发禽类免疫抑制的主要原因。其中胸腺作为T细胞分化、发育和成熟的主要场所,其发育状态与禽免疫功能息息相关[16-17]。刘丹华等[18]发现,REV感染雏鸡的局部淋巴组织中T细胞的数量降低。在FU等[19]的研究中,REV感染造成雏鸡的胸腺细胞凋亡先增多后减少,这与感染雏鸡胸腺先萎缩后恢复的组织学变化相互印证。本研究中,在整个试验期间,REV感染的SPF雏鸡胸腺的细胞凋亡始终增多,其中感染后21~28 d尤为明显(P<0.05),说明REV感染引起的免疫器官细胞凋亡与机体免疫机能障碍有直接关联。在内源性凋亡途径发挥重要作用的BCL-2蛋白,其家族成员包括多结构域抑凋亡蛋白(BCL-2、BCL-xL等)、多结构域促凋亡蛋白(BAX、BAK)和促凋亡BH3-only蛋白(BID、BAD等)[20]。这3种类型的蛋白在接收到细胞凋亡信号后发挥不同的生物学作用[21-22]。本研究发现,REV感染SPF雏鸡后,其胸腺BCL-2阳性细胞数量增加,BCL-2 mRNA表达和蛋白含量也升高,说明REV感染激活了机体细胞的内源性凋亡途径。在抑凋亡蛋白BCL-2增多的情况下,细胞凋亡仍然增多。这可能是因为凋亡与否是由促凋亡蛋白和抑凋亡蛋白共同决定,而非只受单一因子控制[23]。现有研究证实,在REV感染介导的免疫器官细胞凋亡中,有1条以上凋亡调节通路发挥了作用。党盛源[24]在REV感染雏鸡胸腺细胞的研究中,除细胞凋亡增加外,还检测到半胱天冬氨酸蛋白酶家族成员Caspase-3、Caspase-8 mRNA表达和蛋白含量的升高,认为Caspase-3、Caspase-8参与了细胞凋亡的调节。于志强等[25-26]发现,REV感染雏鸡后21~28 d,C-myc、Caspase-6和Caspase-7 mRNA表达均显著升高。据此推测,在多条凋亡相关通路的共同作用下,促凋亡作用大于BCL-2的抑凋亡作用。凋亡是机体消除损伤细胞和衰老细胞的基本生理过程。REV诱导无需凋亡的细胞凋亡,引起机体免疫器官损伤和免疫机能衰竭。为了拮抗较高的细胞凋亡水平,机体可能促进抑凋亡因子的产生。因此本研究中REV感染雏鸡后,其胸腺的BCL-2 mRNA表达和蛋白含量虽然均出现增多,但胸腺细胞总体上仍呈现为凋亡细胞的增多。这可能是REV感染的雏鸡免疫机能低下的根本原因所在。本研究从BCL-2入手,探究了在REV感染的SPF雏鸡胸腺中的细胞凋亡情况、BCL-2 mRNA表达和蛋白含量及BCL-2阳性细胞数量的动态变化。REV感染SPF雏鸡后,虽然其胸腺细胞中BCL-2 mRNA表达和蛋白含量及阳性细胞数量均有所增加,但细胞凋亡增加更加明显,表明REV感染导致的雏鸡胸腺细胞凋亡与病毒所致的感染雏鸡免疫机能低下密切相关。REV感染引起的细胞凋亡,特别是BCL-2家族在REV感染所致胸腺细胞凋亡中的作用及其详细机制仍有待进一步深入探讨。
