表达猪δ冠状病毒S1蛋白植物乳杆菌的构建及验证
2022-01-25郝嘉翼李乐天张和平陈永福金宁一王茂鹏
郝嘉翼,李乐天,张和平,陈永福,金宁一,王茂鹏,李 昌*
(1.吉林农业大学 动物科技学院/动物医学院,吉林 长春130118;2.中国农业科学院 长春兽医研究所 中国医学科学院人兽共患病毒病防控关键技术研究创新单元,吉林 长春 130122;3.内蒙古农业大学 乳品生物技术与工程教育部重点实验室,内蒙古 呼和浩特 010018;4.温州大学 病毒学研究所,浙江 温州 325035)
猪δ冠状病毒(porcine deltacoronavirus,PDCoV)又称为猪丁型冠状病毒,是近年来新出现的一种可引起仔猪肠道疾病的猪肠道冠状病毒。该病于2012年首次在中国香港被报道,2014年,PDCoV疫情在美国的俄亥俄州暴发,随后在世界多个国家,如亚洲的中国、日本、韩国、泰国等,北美洲的加拿大、墨西哥等地区相继被报道[1]。PDCoV可感染不同日龄猪,新生仔猪更为易感,其临床症状与猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)和猪传染性胃肠炎病毒(porcine transmissible gastroenteritis virus,TGEV)相似,主要表现为腹泻、呕吐和脱水,严重时出现死亡,对于新生仔猪的致死率可达到30%~40%[2]。此外,PDCoV目前被证明还可以感染犊牛[3]、家禽[4],并引起家禽腹泻症状[5]。最近发现,PDCoV利用宿主氨基肽酶N(aminopeptidase N,APN)作为受体,通过S蛋白介导与允许APN同源介导进入的种间保守结构域相互作用,从而感染人源细胞[6],提示PDCoV具有跨物种传播的内在潜力,是一种潜在的高风险新型冠状病毒病原体,研发其疫苗具有重要的公共卫生意义。
PDCoV 是具有囊膜的单股正链RNA病毒,电镜下病毒粒子呈球形或椭圆形,其囊膜上有冠状纤突,整体形状类似“皇冠”,直径为 60~180 nm,基因组大约为25.4 kb,在目前已知冠状病毒中,PDCoV基因组长度最小。PDCoV编码4种结构蛋白,分别是刺突蛋白(spike protein,S)、包膜蛋白(envelope protein,E)、膜蛋白 (membrane protein,M)、核衣壳蛋白(nuecleocapsid protein,N)。其中,S蛋白是位于PDCoV病毒囊膜表面能够与宿主细胞表面特异性受体结合使病毒穿入细胞的重要结构蛋白,能够诱导宿主产生抵抗PDCoV的中和抗体[7]。PDCoV S蛋白含有蛋白酶水解位点,蛋白酶可将其水解为N-末端S1结构域和C-末端的S2结构域。S1结构域主要负责受体识别,含有中和抗体表位,特别是S1区包括受体结合域(receptor-binding domain,RBD),是与APN结合的主要区域,具有良好的免疫原性,是研发PDCoV疫苗的首选区域[8]。
乳酸菌(lactic acid bacteria,LAB)是一类能利用可发酵的碳水化合物产生大量乳酸的细菌。如果宿主体内可以提供充足的乳酸菌,就可以阻止致病菌的定植,并且可以降低胆固醇含量,制造营养物质,控制内毒素,诱发肠道黏膜免疫[9]。由此可见,益生乳酸菌与人和动物生命活动密切相关。而乳杆菌可以耐受胃酸和胆盐等极端环境,具有较强的黏附定植肠道上皮的能力,所以利用乳杆菌作为基因工程菌表达异源蛋白已经得到广泛验证,如利用植物乳杆菌表达新型冠状冠病毒(SARS-CoV-2)RBD蛋白,同时诱导机体产生大量特异性sIgA,促进T淋巴细胞活化,进而提高体液免疫和细胞免疫[10];利用干酪乳杆菌表达PEDV S蛋白和TGEV S蛋白D抗原联合的二价口服疫苗可产生较高的中和抗体[11]。
本试验选用植物乳杆菌LP18表达含1320信号肽和DCpep优化的PDCoV S1蛋白基因,以乳酸乳球菌NZ3900作为克隆宿主,获得较高含量的重组质粒,最终使PDCoV S1基因在植物乳杆菌LP18中表达,并建立了有效的制备及鉴定方法,优化了蛋白表达量,为开发PDCoV口服疫苗奠定基础。
1 材料与方法
1.1 质粒及菌株含1320信号肽和DCpep优化的PDCoV S1基因的质粒由南京金斯瑞公司合成并保存;pSIP 411载体、乳酸乳球菌NZ3900、植物乳杆菌LP18由中国农业科学院长春兽医研究所保存。
1.2 主要试剂质粒小量提取试剂盒、胶回收试剂盒购自苏州康宁生命科技有限公司;MRS、M17培养基购自海博生物公司;HA Tag Rabbit Polyclonal antibody购自Proteintech公司;羊Anti-Rabbit IgG 购自北京碧云天有限公司;Clone Express Multis One Step Cloning Kit 和Phanta Max Super-Fidelity DNA Polymerase 购自南京诺唯赞生物科技股份有限公司;诱导肽SppIP由南京金斯瑞生物科技公司合成。
1.3 目的基因的设计根据PDCoV S蛋白氨基酸序列(GenBank:QAA06990.1),选择其S1区域, 在N端插入1320信号肽,C端插入DCpep短肽,并在其后添加HA-Tag,上下游分别添加XhoⅠ和NcoⅠ酶切位点,密码子优化后交由金斯瑞公司合成。
1.4 引物的设计及合成利用NCBI网站设计引物LPS1-F和LPS1-R,用于扩增PDCoV S1基因序列,片段长度为1 939 bp;通用引物TF01和TR01用于扩增pSIP411及其衍生物,长度为2 407 bp。引物由吉林省库美生物科技有限公司合成,引物信息见表1。
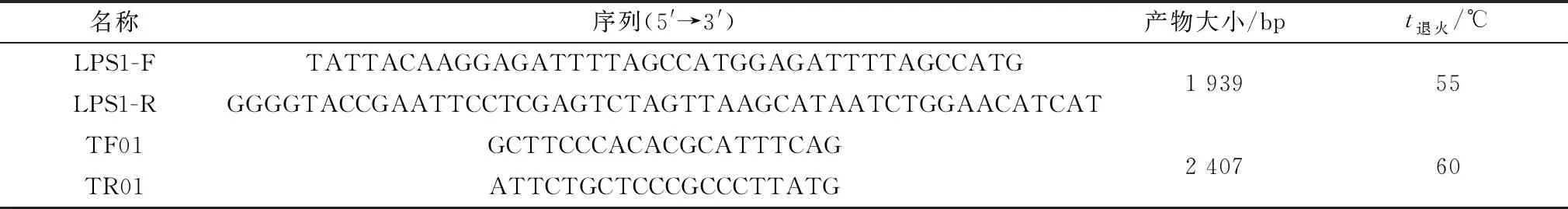
表1 引物序列及相关信息
1.5 PDCoV S1基因扩增以合成的PDCoV S1质粒为模板,进行PCR扩增。反应体系:2×Phanta Max Buffer 25 μL,dNTP Mix(10 mmol/L each)1 μL, LPS1-F、LPS1-R各1 μL,Phanta Max Supper-Fidelity DNA Polymerase 1 μL,模板1 μL,ddH2O补足至50 μL。反应条件:95℃ 2 min;95℃ 15 s,55℃ 30 s,72℃ 1 min,共30个循环;72℃延伸5 min。将扩增产物进行琼脂糖凝胶电泳,并将产物进行胶回收。
1.6 重组乳杆菌表达质粒的构建及鉴定利用无缝克隆技术将1.5中的胶回收片段连接到pSIP411载体,然后将其电转化到中间克隆宿主乳酸乳球菌NZ3900。将菌液涂布于含20 mg/L红霉素的G-M17固体培养基上,30℃培养12 h后挑取单克隆进行菌液PCR,待验证无误后提取质粒并测序。将验证正确的质粒电转入植物乳杆菌LP18,涂布于含20 mg/L红霉素的固体MRS培养基上,过夜培养后挑取单个菌落,用引物TF01和TR01进行菌液PCR鉴定。
1.7 重组乳杆菌的诱导表达挑取鉴定为阳性的单克隆菌落,按1%接种于新配制的MRS液体培养基(红霉素含量为20 mg/L),37℃培养至D值为0.3~0.5时,加入诱导肽SppIP(50 μg/L),继续培养8 h。8 000 r/min离心3 min收菌,用无菌PBS洗重组菌3遍,去除MRS培养基,再用PBS将重组菌重悬,加入等量玻璃珠于研磨机研磨,收集上清用于下一步蛋白表达验证。
1.8 外源基因表达的Western blot鉴定取100 μL上述蛋白,加入25 μL 5×Loading Buffer 充分混匀后沸水中煮7 min,进行10% SDS-PAGE。通过半干法转膜,用于Western blot分析:5%脱脂乳室温封闭2 h,用PBST配制1∶1 000的兔源Anti-HA抗体在室温下孵育2 h,PBST洗3次;用1∶5 000 HRP标记的山羊抗兔二抗在室温下孵育40 min,用PBST洗3次后ECL法显影。
1.9 外源基因表达的间接免疫荧光检测将重组菌按1%接种于含有红霉素(20 mg/L)的MRS培养基,加入诱导肽诱导8 h后收菌;用PBS洗3遍,加入兔源Anti-HA抗体(1∶1 000),孵育过夜;用PBS洗3遍,于FITC标记的二抗(1∶5 000)中孵育2 h;PBS洗3遍,在油镜下观察。
1.10 外源基因表达的流式细胞分析将重组菌诱导8 h,用HA兔源多抗(1∶1 000)孵育过夜,PBS清洗3次,用FITC标记二抗(1∶5 000)孵育2 h,PBS洗3次后用于流式细胞分析。
1.11 重组乳杆菌表达PDCoV S1蛋白优化按1.8所述方法进行表达条件优化。诱导时间点分别为4,6,8,10,12,16,20,24 h。诱导肽质量浓度分别为50,100,150,200 μg/L。诱导温度分别为33,37,42℃。诱导表达后,通过Western blot对目的蛋白进行检测。
2 结果
2.1 目的基因的设计与合成以PDCoV流行株(GenBank:QAA06990.1)S蛋白为基础,选取S1结构域(1~530)(图1A),同时,在N端添加1320信号肽、在C端添加DCpep和HA标签,得到重组序列PDCoV S1(图1B)。

图1 PDCoV S1基因结构示意图
2.2 目的基因的扩增利用无缝克隆引物,通过PCR从含有PDCoV S1的质粒中扩增获得1条长度为1 939 bp 的特异性条带,与预期大小符合(图2),经测序验证为PDCoV S1序列,未发生突变。
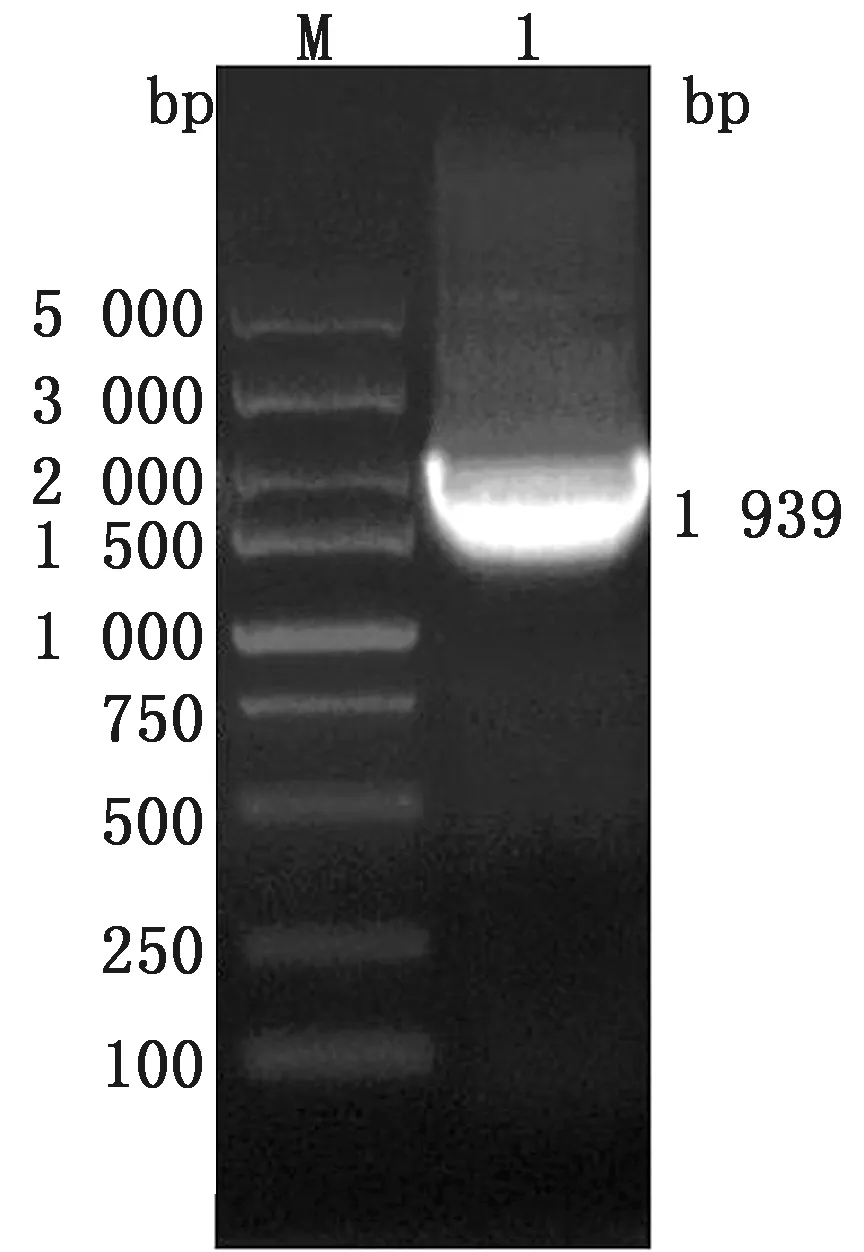
M.DL5000 DNA Marker;1.PDCoV S1基因扩增产物
2.3 重组表达质粒的构建与鉴定用无缝克隆技术将获得的目的基因片段克隆入植物乳杆菌表达载体pSIP411,并将重组质粒电转入克隆宿主乳酸乳球菌NZ3900,菌液PCR与测序验证显示其序列正确,提取质粒,即为构建的重组表达质粒pSIP411-PDCoV S1(图3A)。再次将重组质粒电转入植物乳杆菌LP18中,进行菌液PCR鉴定,结果如图3B所示,在2 407 bp有特异性条带,与预期相符,测序进一步表明目的基因正确。上述结果表明已经成功将阳性质粒转入至植物乳杆菌LP18中,将验证正确的重组乳杆菌命名为LP18:pSIP411-PDCoV S1。
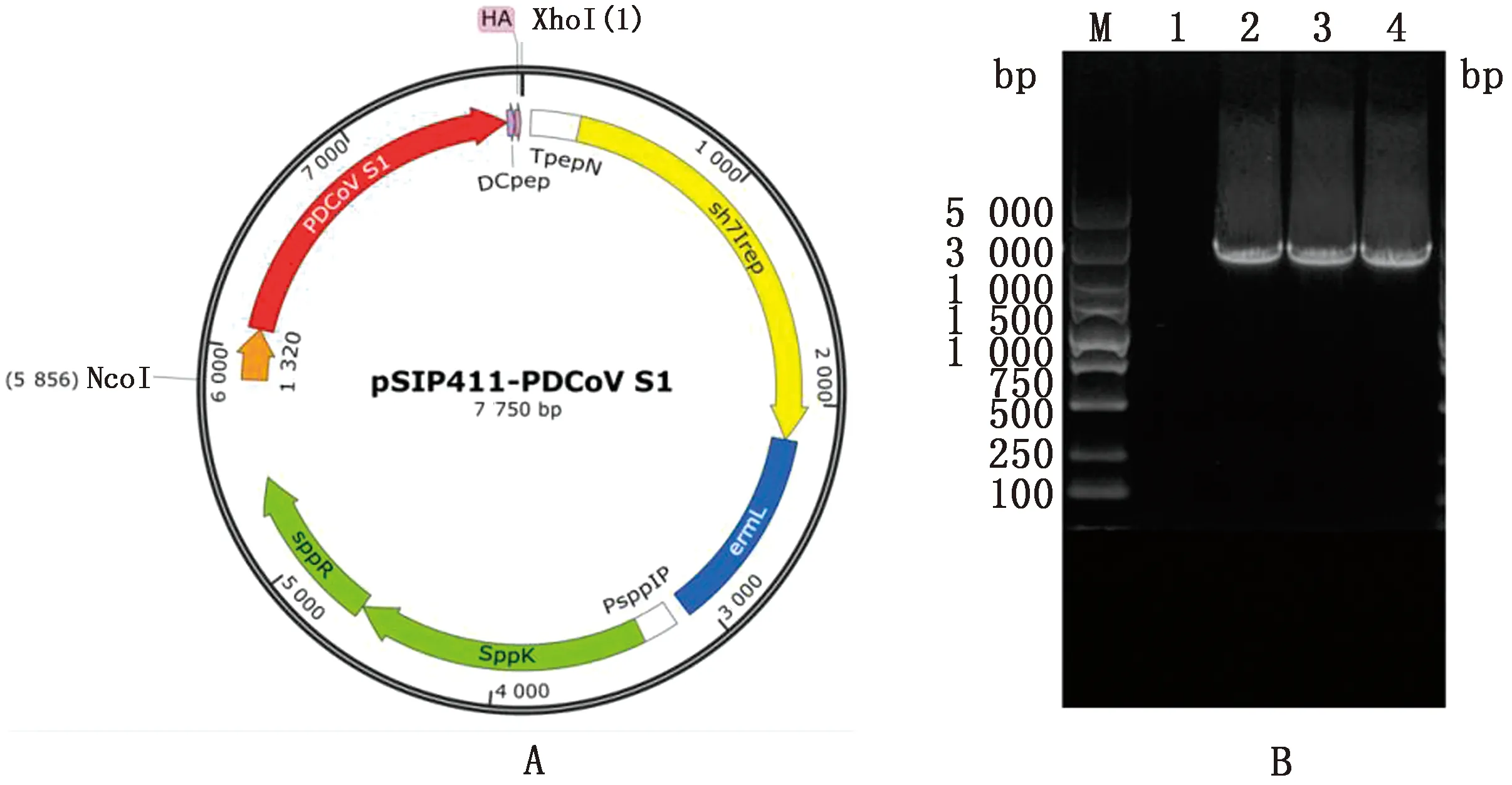
A.pSIP411-PDCoV S1 质粒结构示意图(RepA和RepC.乳酸菌的复制起点;emL.红霉素抗性标记;sppK,sppR.组氨酸蛋白激酶和相应调控元件;HA.流感病毒血凝素表位短肽序列);B.重组乳杆菌LP18:pSIP411-PDCoV S1的PCR鉴定结果(M.DL5000 DNA Marker;1.植物乳杆菌LP18;2~4.电转后的植物乳杆菌LP18的单克隆菌)
2.4 外源基因表达的Western blot 鉴定将构建正确的重组菌培养液中加入诱导肽SppIP(50 μg/L),诱导6 h后收集细菌并提取蛋白,进行Western blot 鉴定,以分别加诱导剂和不加诱导剂且含空白质粒的LP18作为对照。结果如图4所示,加入诱导剂的重组乳杆菌LP18:pSIP411-PDCoV S1中可见70 kDa 大小的特异性条带,与预期相符,而含有空质粒的重组菌,无论诱导与否,都没有条带,表明PDCoV S1基因可以在植物乳杆菌LP18中表达。
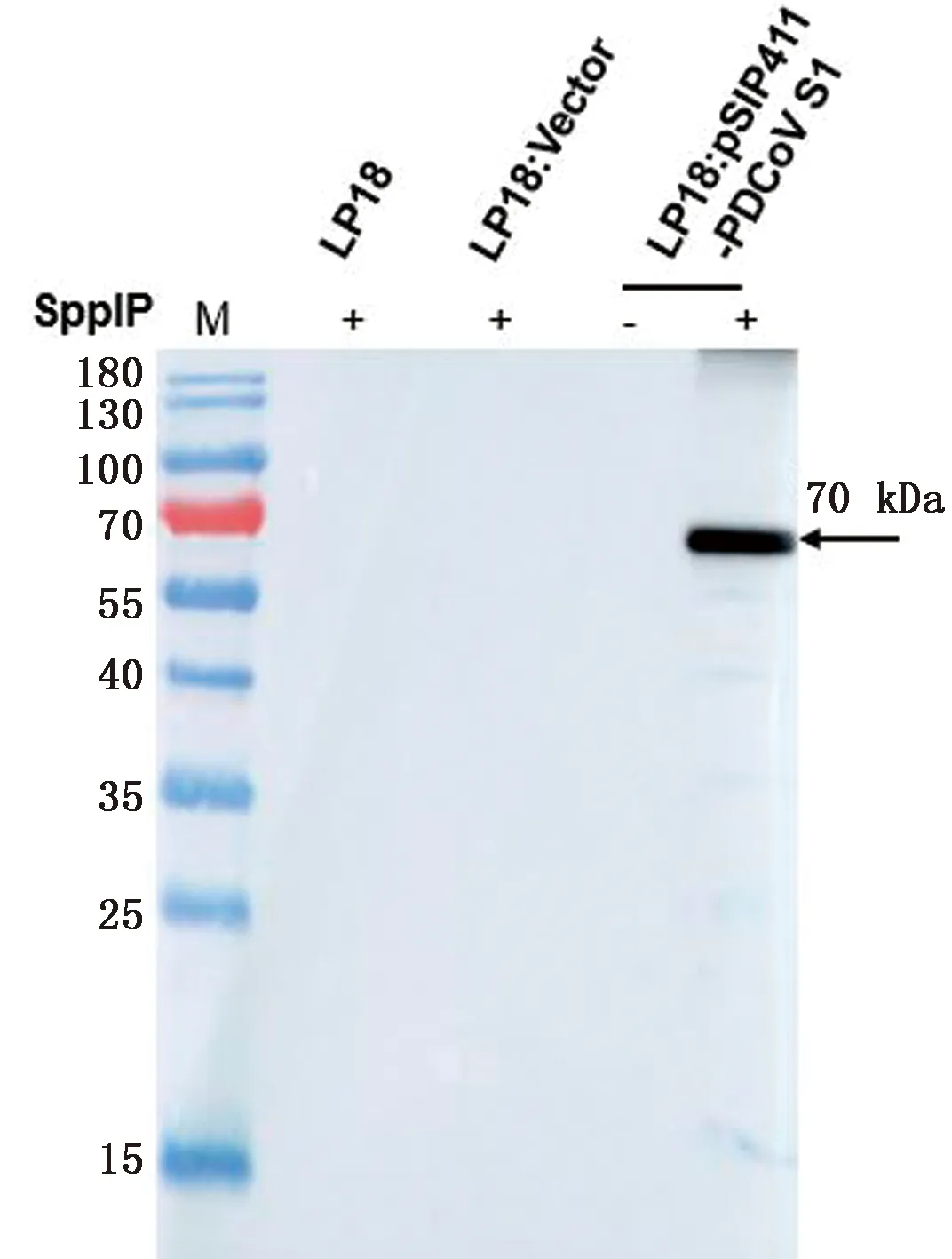
M.蛋白Marker;SppIP+.加诱导剂;SppIP-.不加诱导剂
2.5 外源基因表达的免疫荧光分析通过间接免疫荧光试验对外源基因的进行分析,结果如图5所示,LP18空载体与未加诱导剂的重组菌(LP18:PDCoV S1)未见荧光,而加入诱导剂的重组乳杆菌(LP18:pSIP411- PDCoV S1)的菌体可见荧光,且主要分布于菌体表面。进一步证明PDCoV S1基因可在LP18中表达且表达的目的蛋白锚定在菌体表面,与设计相符。

SppIP+.加诱导剂;SppIP-.不加诱导剂
2.6 外源基因表达的流式细胞分析通过流式细胞术检测LP18:pSIP411-PDCoV S1的阳性率,以含空载体的植物乳杆菌LP18和未加诱导剂的LP18:pSIP411-PDCoV为阴性对照。结果如图6所示,LP18:pSIP411-PDCoV S1的阳性率为28.62%(图6),而另外2种菌未见阳性,表明重组乳杆菌LP18:pSIP411-PDCoV S1具有较高表达效率。
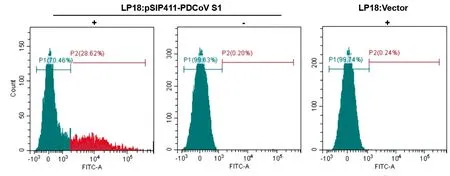
SppIP+.加诱导剂;SppIP-.不加诱导剂
2.7 重组乳杆菌表达条件的优化分别在不同诱导时间、不同诱导剂质量浓度以及不同温度下对重组菌LP18:pSIP411-PDCoV S1进行诱导表达并提取蛋白,以BCA法定量后,进行SDS-PAGE。由图7可以看出,重组菌在诱导6 h表达量最高(7A);在诱导剂质量浓度为150 μg/L时,表达量最高(7B);重组菌在33℃时诱导表达量最高(7C)。因此,重组菌LP18:pSIP411-PDCoV S1的最优表达条件:温度33℃,诱导剂质量浓度150 μg/L,诱导时间6 h。
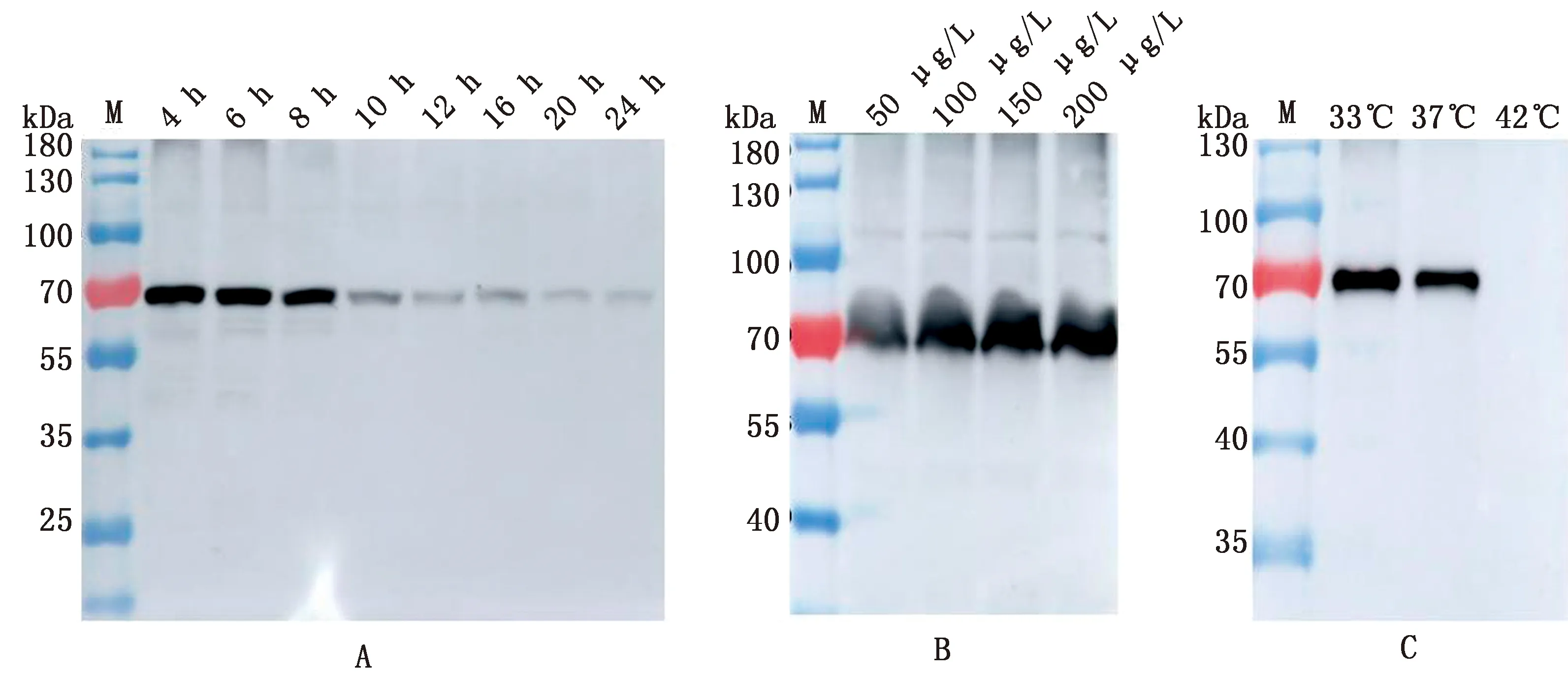
A.不同诱导时间的蛋白表达(M.蛋白Marker;4~24 h为不同诱导时间);B.不同诱导剂质量浓度诱导蛋白表达(M.蛋白Marker;50,100,150,200 μg/L为不同诱导剂质量浓度);C.不同诱导蛋白表达(M.蛋白Marker;33,37,42℃为不同诱导温度)
3 讨论
众所周知,冠状病毒的出现,给人类和其他动物造成了重大威胁,猪肠道冠状病毒更是给全球畜牧业带来了极大损失,因此进行冠状病毒研究与防治工作至关重要[8]。PDCoV是一种新被发现的肠道冠状病毒,不仅可以引起新生仔猪的腹泻、呕吐等症状,更可以感染禽类、犊牛,是一种高风险的新型冠状病毒。但目前对于PDCoV的研究并不多,尚不清楚其传播和致病机制,因此研究一种有效的疫苗尤为关键。PDCoV S蛋白能够辨别靶细胞,从而促进病毒和细胞膜的融合,不但能够诱导机体产生体液免疫,同时还可以刺激机体产生中和抗体[12-13]。PDCoV S蛋白的S1结构域有多个产生中和抗体的重要表位,是受体识别、结合细胞的关键部位[14]。LU等[15]将纯化后的S1蛋白作为包被抗原,检测猪血清和乳汁中PDCoV的IgA抗体,ELISA结果显示,PDCoV-S1-IgA具有较高的特异性和敏感性,为PDCoV的快速检测和疫苗免疫评估提供重要的依据。张爽等[16]利用昆虫细胞-杆状病毒表达系统成功表达了PDCoV-RBD蛋白,通过Western blot、间接免疫荧光方法证明感染rBac-PDR的Sf9细胞能够正确表达PDCoV-RBD蛋白,为后续PDCoV诊断试剂开发及亚单位疫苗研制奠定了基础。
乳酸菌递送载体因其具有独特的特性以及潜在的应用,受到了广泛的关注。乳酸菌作为一种非致病性微生物,具有更高的安全性优势,其细胞壁缺乏脂多糖成分,没有诱导产生内毒素的风险。由于多数乳酸菌具有免疫佐剂的作用,所以异源抗原能够在乳酸菌中大量表达因而可促进免疫反应[17]。研究表明,将乳酸乳球菌表达百日咳杆菌F1S1融合蛋白的黏膜载体疫苗通过口服和滴鼻接种BALB/c小鼠,结果表明在小鼠肺内容物中检测出了较高水平的特异性SIgA,而且可诱导全身黏膜免疫反应[18]。DC广泛分布在胃肠道上皮下,是免疫系统的哨兵[19]。当病原体侵袭时,DC通过捕获外来抗原来激活幼稚T细胞,由Th1免疫应答向Th2免疫应答方向极化。肠道DC亚群可以调节肠道免疫稳态,因此DC细胞是免疫系统的关键调节器[20]。近几年研究表明,当重组乳酸菌所表达的抗原与树突细胞靶肽融合时,可以更好地提高机体免疫力。MANSOUR等[21]将其炭疽杆菌保护抗原(PA)基因与树突细胞靶向肽基因DCpep融合,通过嗜酸乳杆菌表达融合蛋白PA-DCpep,小鼠口服后,产生了大量PA中和抗体,并且刺激T细胞介导的免疫应答,使小鼠对炭疽杆菌产生有效的保护力。MICHON等[22]构建了以DC表面受体DEC-205为靶点的植物乳杆菌菌株,增强了植物乳杆菌与DC细胞的结合能力,从而改善cDNA向免疫细胞的递送能力。本试验选择DCpep作为树突细胞靶向肽,有效地将抗原呈递给免疫细胞,增强黏膜免疫应答,提高免疫原性,更有利于免疫系统发挥作用。pSIP系统已成功应用于植物乳杆菌和清酒乳杆菌中多种蛋白质的细胞内表达、分泌和表面锚定[23-24]。本实验室前期利用pSIP系统建立了植物乳杆菌表达平台,进行了猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome,PRRSV)[25]、新型冠状病毒SARS-CoV2[26]、3型猪圆环病毒(porcine circovirus,PCV)[27]等多种病毒蛋白的表达与免疫研究。本研究中,利用建立的植物乳杆菌表达平台,进行了PDCoV S1的构建与表达,丰富了植物乳杆菌表达异源蛋白的可能性,也可以更好地提高机体免疫力。通过表面锚定的方式,可以增加乳酸菌的表达量,并且能够有效增加抗原的刺激。对乳酸菌载体来说,其表达量较低,所以对于同源信号肽的选择十分重要。1320信号肽为脂质锚定型信号肽,有较强的表面展示性功能,不仅能够展示异源蛋白,还具有促进异源蛋白表达的功效。因此,本试验选用1320信号肽作为异源蛋白的标签确保PDCoV S1蛋白可以在乳酸菌中顺利表达。乳酸菌作为基因工程疫苗具有佐剂的作用,对于植物乳杆菌来说,密码子的偏向性是此菌株的特征之一,本研究对目的基因的密码子进行了优化,并优化了影响乳酸菌载体表达的因素,最终得到了1株表达量较高的重组乳酸菌。
综上所述,本试验成功构建1株能够稳定表达PDCoV S1蛋白的植物乳杆菌,为PDCoV口服疫苗的开发提供了依据。
