CRISPR/Cas9基因编辑技术及其在肉牛基因组编辑中的应用
2022-01-25朱进华翟亚莹朱肖亭李玉龙2张志杰张格阳2张子敬吕世杰施巧婷陈付英徐照学王二耀
朱进华,翟亚莹,朱肖亭,于 翔,李玉龙2,,张志杰,张格阳2,,张子敬,吕世杰,施巧婷,陈付英,徐照学,王二耀*
(1.河南省动物卫生监督所,郑州 450003;2. 河南农业大学动物科技学院, 郑州 450002;3. 河南省农业科学院畜牧兽医研究所, 郑州 450002)
在传统方法(ZFNs技术和TALENs技术)中,外源序列被随机整合到动物基因组中,具有随机性和不确定性,编辑效率低且成本较高。CRISPR/Cas9技术与传统方法截然不同,基因组可以以单核苷酸的精度进行工程改造,使基因更精确地定点编辑[1]。
对于我国的肉牛种业品种改良进展慢、育种成本高,这是限制其良种培育的“卡脖子”问题[2]。CRISPR/Cas9技术的产生与应用在改良肉牛遗传育种上,提供了一种更加高效价廉的方法,对肉牛育种和疾病防控等产生了巨大和深远的影响。本文就CRISPR/Cas9基因编辑技术的发展历程、作用机制、生产应用方面进行综述,重点介绍该系统在肉牛研究中已取得的最新进展,并对其发展做出展望。
1 CRISPR/Cas9的发展历程
早在1987年,Ishino[3]在研究大肠杆菌的IAQ基因时,发现IAQ基因的编码区下游有一段串联间隔的重复序列,被含32个碱基的序列隔开,但此发现在当时并没有引发太大关注。后来科研人员在细菌及古细菌中都检测到了CRISPRS[4],并预测了它们在基因修复或调控中发挥的作用[5-6],Jansen博士领导的实验室发现了4个与CRISPR相关的基因—CAS基因[7],这些基因始终位于CRISPR基因座上。后来人们发现这些短而独特的序列与病毒或质粒的DNA序列相匹配,这暗示着CRISPR-Cas系统的“适应性”,其能提供针对入侵者的特异性防御[8]。随后的生信分析[9]验证了这一点, 而后CRISPR 的作用机制首次在葡萄球菌干扰试验中得到验证[10]。CRISPR-Cas系统分为Ⅰ、Ⅱ、Ⅲ3种类型[11-12],张锋课题组[13]设计了两种不同的Ⅱ型CRISPR / Cas系统,证明了Cas9核酸酶通过介导短RNA(sgRNA)可以定向诱导内源性基因组位点裂解。Cas 9还可以转化为一个缺口酶,促进具有最小诱变活性的同源定向修复。另外,多个sgRNA序列可以共同编码成一个CRISPR阵列,同时编辑基因的多个位点,这表明CRISPR —Cas系统具有易编辑性和广泛适用性。
2 CRISPR/Cas9的作用机制
CRISPR/Cas9的作用机制可以分为以下三个阶段:间隔区的获得、CRISPR的表达、外源DNA的切割。第一步:间隔区的获得,当噬菌体侵入细菌时,CRISPR系统会捕获一段被称为原型间隔序列的外源DNA序列,通过 Cas1、Cas2 和 Csn2 整合到 CRISPR 阵列中,当噬菌体再次入侵时,该“记忆”区间能起到自动识别的作用CRISPR系统将该序列插入到前导序列与间隔重复序列之间[14]。第二步:CRISPR的表达,新形成的间隔区与其他所有间隔区,共同转录成一个包含间隔区和重复序列的CRISPR RNA( pre-crRNA) ,进一步被切割成较小的crRNA,同时合成Cas9蛋白。第三步:crRNA和cas9蛋白在track RNA的指导下形成和蛋白复合物并进行定点切割外来序列,破坏外源DNA[15](如图1)。
CRISPR/Cas9的结构之一—Cas9是一种内切核酸酶,它使用RNA双链体(TracRNA:CrRNA)中的导向序列与DNA靶序列形成碱基对,使Cas9能够在DNA中引入位点特异性双链断裂。在实验室试验中,双重tracrRNA:crRNA被设计成一个单一的导向RNA (sgRNA ),它保留了两个关键特征:在5′的序列通过沃森-克里克碱基配对确定DNA靶位点,在3′的双链RNA结构结合Cas9。sgRNA指导Cas9的导向序列发生变化,以靶向任何感兴趣的DNA序列[16],从而进行定点切割。DNA双链切断后,细胞启动自我修复机制,利用非同源末端连接修复(NHEJ)和同源重组修复(HDR)两种方式对基因进行修复。此环节科研人员可插入外源基因,实现基因的同源重组[17](如图2)。
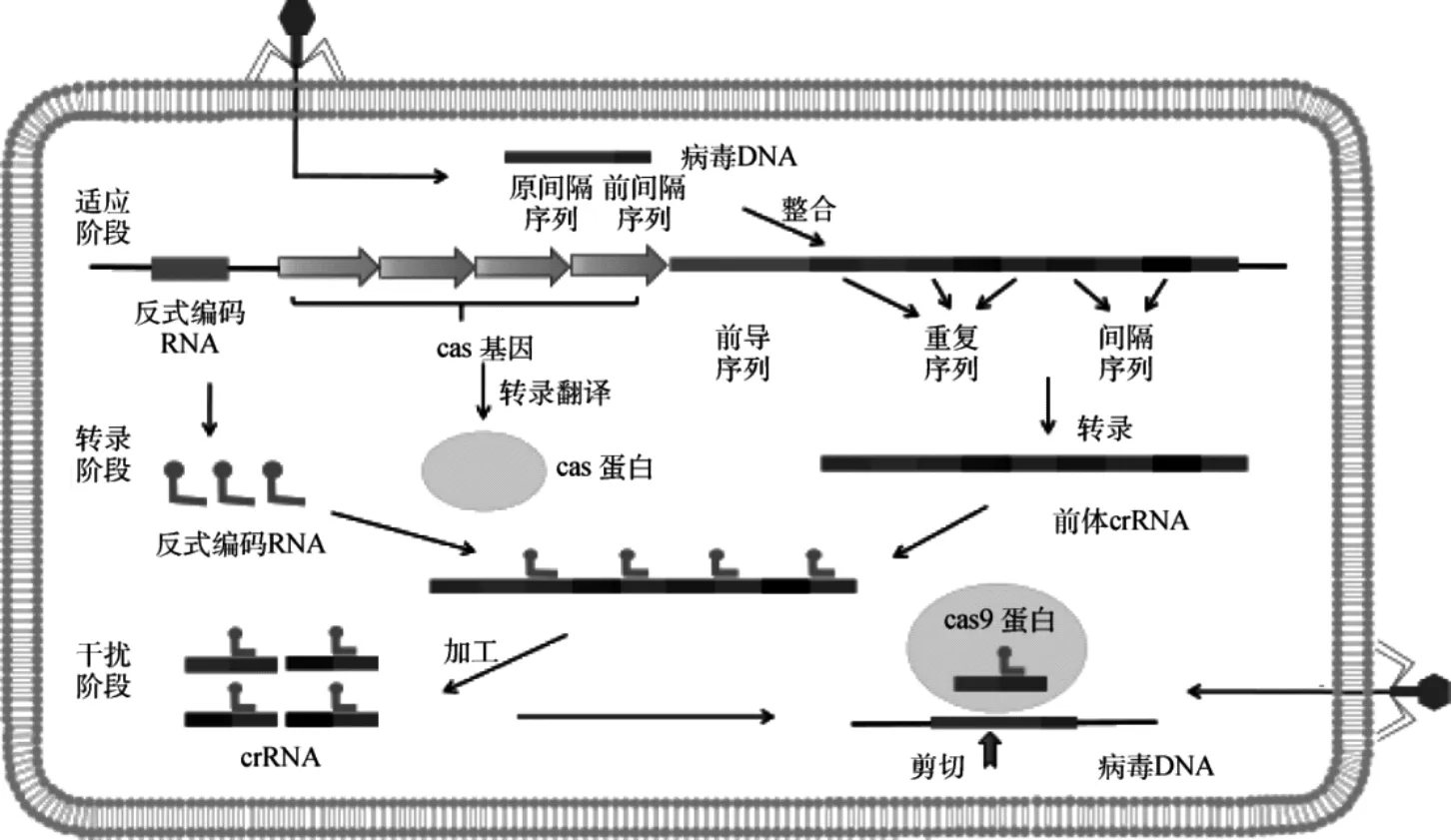
图1 CRISPR/Cas9系统的防御机制[2]
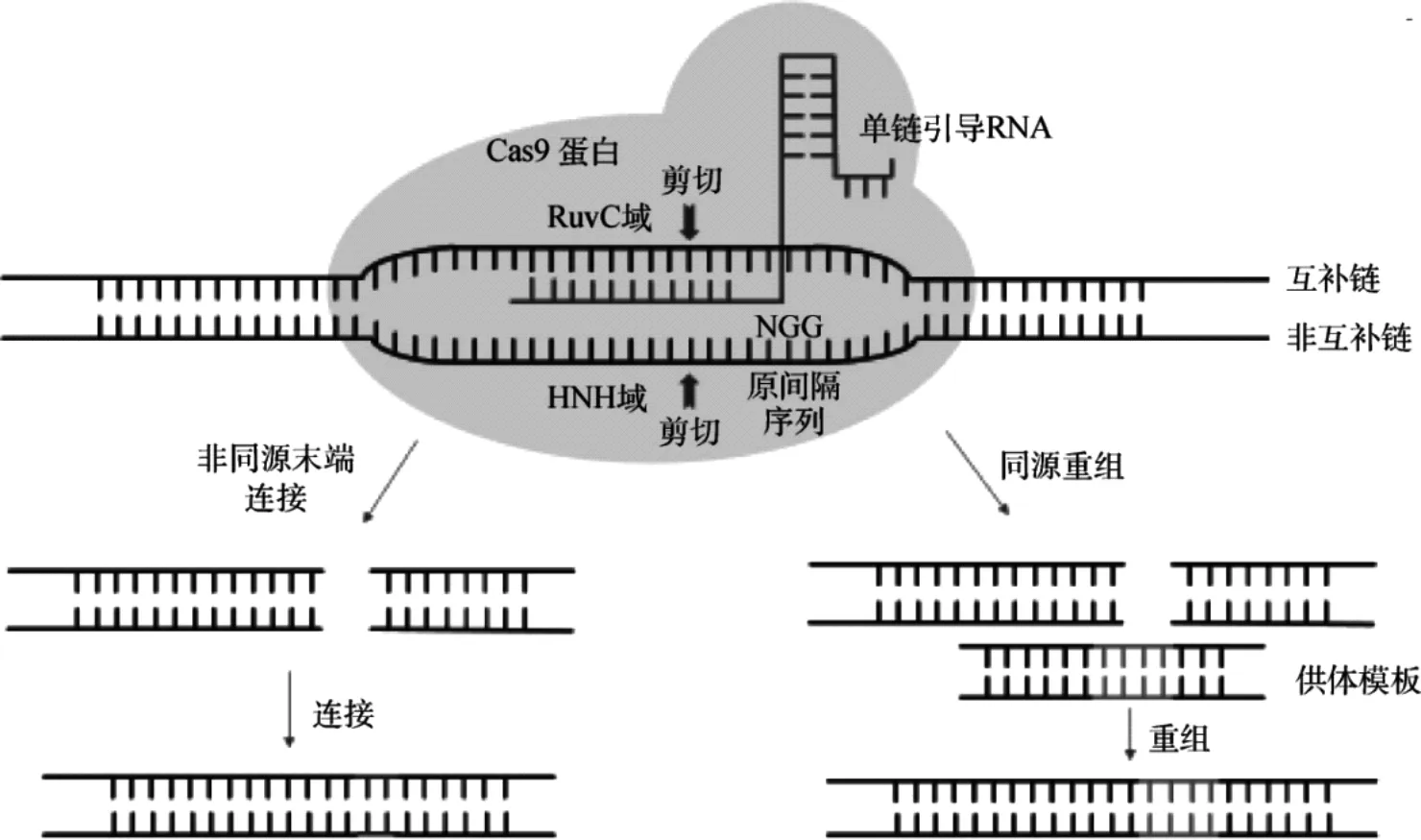
图2 CRISPR/Cas9的作用机理[2]
3 CRISPR/Cas9技术在肉牛上的应用
牛的生产周期长,实验成本高,所以CRISPR/Cas9技术在牛上的应用比较少,较其他动物而言发展较慢,在2014年才出现第一个由CRISPR/Cas9介导、围绕牛开展的基因编辑试验[18],该试验表明CRISPR/Cas9技术可以高效地编辑牛胚胎和诱导多能干细胞。近些年对于肉牛的基因编辑研究有所增加,CRISPR/Cas9技术的发现和应用对于提高肉牛抗病性、改善产肉性能、优化繁殖性状等方面均有显著影响。
3.1 应用于提高牛抗病性
肉牛的健康状况直接影响着肉牛产业的发展,CRISPR/Cas9技术可以通过定点敲入或敲除基因,培育出具有抗病能力的牛。日本黑牛肉质鲜美以大理石花纹闻名,95%的日本黑牛是通过人工授精繁育,所以当优秀的公牛携带的疾病时,可通过人工授精广泛传播。其中IARS综合征是存在于日本黑牛中隐性疾病的一种,其发病原因是IARS基因突变为纯合子,患病纯合突变的犊牛在宫内生长迟缓,体质虚弱,死亡率高甚至宫内死亡。为修正突变的密码子,日本科学家利用CRISPR/Cas9技术,将CRISPR/Cas9和包含正确氨基酸的同义密码子的供体DNA,引入从纯合突变小牛分离的胎牛成纤维细胞(BFF)细胞中,后进行细胞核移植得到了SCNT胚胎,最后成功得到的IARS基因被正确修复的胎牛[19]。
地方上传染病对于当地牛业发展而言是很大的威胁,其中牛白血病病毒(BLV)导致的地方性传染病是一种可以在人和牛间广泛传播的慢性传染病,其防治对于人畜安全生产都很重要。有研究表明,CD209分子可能是BLV的潜在受体,目前已在实验室水平研究出用于敲除CD209基因的CRISPR/Cas9系统,有望通过基因编辑生产出对BLV感染具有抵抗力的牛[20]。
在牛生产上,腹泻一直是严重影响犊牛、成牛健康状况的重要疾病,病原之一的牛病毒性腹泻病毒(BVDV,以下简称BVDV)可导致牛病毒性腹泻病 (BVD),该病在牛之间具有高度接触传染性[21]。牛感染该病毒后轻则出现精神沉郁,腹泻发热,胎牛流产等症状,重则直接死亡;对育肥牛的产肉率,奶牛的奶产量,种用牛的繁殖力有一定影响,并且继发持续感染[22]。为从基因水平上探究防治 BVDV 的方法,有研究利用CRISPR/Cas9系统,分别敲除了牛肾上皮(MDBK,以下简称MDBK) 细胞的低密度脂蛋白受体(LDLR) 基因[23]和MDBK细胞的SERPINF2基因[24],结果发现分别敲除这两个基因均能显著性抑制BVDV复制,这为生产抗腹泻病毒的牛提供了试验依据。
另外,CRISPR/Cas9 系统还可以用于疫苗的研发,CRISPR/Cas9 系统成功敲除了牛疱疹病毒( BHV) 的gE基因,使牛疱疹病毒灭活且重组毒株具有免疫原性,为疫苗生产的新方式提供了试验基础[25]。
3.2 应用于提高产肉性能
MSTN已被证明跟肌肉的发育有关,MSTN的存在会抑制肌肉发育[26-28]。郭梓茹[29]利用CRISPR/Cas9技术构建无标记的MSTN基因敲除的蒙古牛细胞系,得到MSTN基因敲除的细胞株,该细胞株可作为供体细胞,利用体细胞核移植技术生产MSTN基因敲除的蒙古牛。后尉翔栋[30]利用CRISPR/Cas9技术成功制备了敲除MSTN基因的牛胚胎,丰富了双肌肉牛品种培育的遗传素材。目前敲除MSTN基因的转基因牛已被生产出来,李广鹏[31]等利用CRISPR/Cas9基因编辑技术,以影响肌肉发育的MSTN基因为靶标,选择不同位点进行定点敲除,经体细胞克隆技术得到了基因编辑牛,再利用编辑牛精液分别与鲁西牛、蒙古牛和西门塔尔牛配种,生产了221头F1代,对F1代进行生化血液分析和屠宰性状分析,结果显示MSTN基因编辑牛的各项体尺指标普遍优于普通牛,后躯发育极显著提升,产肉率提高且肉质正常。胎儿发育正常,出生体重正常,无明显难产现象[32-33]。
除MSTN可以影响牛的肌肉发育外,肌细胞生成素(MyoG)、生肌因子6(Myf6)在肌纤维数量的固定、肌纤维类型的分化过程中也起到了重要作用[34]。李冬晓[35]以牛骨骼肌卫星细胞为试验材料,利用 CRISPR 干扰( CRISPRi) 技术同时和分别干扰MyoG、Myf6基因的表达,以探究MyoG、Myf6 基因的低表达时对肌肉分化的影响。另外,IGF2基因也已被证实与肌肉发育有关,以浓度控制的方式促进肌纤维的分化[36],浓度高时促进肌肉生长发育,反之抑制[37]。CRISPR/Cas9系统可以有效编辑IGF2基因并提高其表达水平,在得到IGF2基因编辑牛胚胎后,通过胚胎移植技术得到高产肉牛,这会成为分子育种的又一突破[38]。
3.3 应用于提高繁殖率
牛繁殖率低是困扰养牛产业发展的瓶颈问题之一,科研人员利用CRISPR/Cas9技术不断探索,尝试找到提升牛繁殖性能的方法。BMP15和GDF9基因在牛的卵泡发育上起到调控作用[39-41],其突变可以促进卵泡发育并提高排卵率[42]。冯万有[43]使用CRISPR/Cas 9技术突变对水牛胎儿成纤维细胞上的BMP15和GDF9 基因同时进行基因敲除,其中BMP敲除效率为37.5%,GDF 敲除效率为10.0%,此试验为CRISPR/Cas 9双基因同时编辑提供了试验基础,旨在探究提高水牛繁殖能力的分子育种方法。另有研究表明,利用CRISPR/Cas 9系统对牛胚胎的NONAG基因进行定点敲除后,滋养层(TE)的分离和维持没有明显变化,但可以影响多能内细胞团(ICM)结的分化与增殖[44]。利用CRISPR/Cas9技术建立肉牛的繁育体系已经被提上日程,中科院西北高原生物研究所[45]将此技术应用在牦牛品种改良,提供了一套切实可行的牦牛体外胚胎生产和基因编辑技术体系,以促进牦牛的优繁优育和阔群增量。
由于繁殖性状受环境因素、人为因素的影响较大,主效基因复杂,目前利用CRISPR/Cas9对于繁殖性状进行改良的研究比较少,但随着CRISPR/Cas9技术的不断进步和人们对基因的深入探索,相信该技术未来一定可以为肉牛种业的兴旺发达做出贡献。
4 展望
农业现代化,种子是基础。CRISPR/Cas9基因编辑技术的产生对于我国肉牛种业振而言有很大的促进意义,科研工作者们有了更高效精确的工具来编辑基因。然而该技术还存在一些问题,如体系不稳定、脱靶率较高等,需要进一步改善优化。目前CRISPR/Cas9技术在人、小鼠、斑马鱼等方面都有了长足进步,该技术在肉牛上的实验室研究也在如火如荼地进行着,接下来需要理论与实践相结合,把科研成果落实在生产上,相信未来我国的肉牛产业将会拥有更加广阔的发展前景。
