过敏性紫癜患儿血清基质金属蛋白酶-13、白细胞介素-9和肿瘤坏死因子-α表达水平变化及意义
2022-01-25王晓亮赵光宇
王晓亮,赵光宇
(1.榆林市第一医院检验科,陕西 榆林 719000;2.西安市中心医院儿科,陕西 西安 710004)
过敏性紫癜(Henoch-schonlein purpura,HSP)多见于幼儿园幼儿与小学生,可归为血管炎疾病类型,年发病率为万分之一左右,已成为了一种公共卫生问题[1-2]。该病在临床上的主要症状为紫癜,伴有腹痛、肾脏病变、关节痛等,机体可表现为小血管嗜酸粒细胞、周围中性粒细胞侵袭与浸润,存在血液高凝状态,甚至有微血栓形成。HSP常具有自限性,部分患儿不经过治疗就可好转,需要治疗的很多患儿在对症治疗后临床症状可明显好转[3]。但是部分患儿如果不及时进行诊治,可出现颅内出血而危及生命,因此对于HSP治疗的要求也比较高[4]。同时,HSP在发病时无特异性临床症状,容易导致误诊与漏诊情况发生,为此加强早期诊断也具有重要意义。HSP具体发病机制还不明确,病因比较多,涉及多种细胞因子的异常表达[5]。基质金属蛋白酶(Matrix metalloproteinases,MMP)为一组蛋白水解酶,包括数十种蛋白,可降解细胞外基质(Extracellular matrix,ECM)。MMP-13是MMP的主要类型,也是降解Ⅳ型胶原最主要的酶,与川崎病、大动脉炎的发生与发展密切相关[6],但其具体机制尚不清楚。白细胞介素-9(Interleukin,IL-9)为常见促炎因子,不仅可对机体发生炎性反应,也可诱导其他促炎因子的释放,从而使患者病情恶化[7]。肿瘤坏死因子-α(Tumor necrosis factor,TNF-α)也为一种炎症因子,在局部组织炎症的发生中发挥重要作用,可诱导其他炎症因子的释放,增强细胞间黏附分子-1的表达,从而在多种炎性疾病的发生与发展中发挥重要作用[8]。本研究观察HSP患儿血清MMP-13、IL-9和TNF-α表达水平变化,并探讨其临床意义。
1 资料与方法
1.1 一般资料 选择2019年3月至2021年2月在本院接受诊治的HSP患儿96例为HSP组,选择同期在本院进行健康体检的儿童96例为对照组。HSP组中,男性49例,女性47例;平均年龄(7.39±0.58)岁;平均体重(24.02±2.14)kg;平均病程(2.92±0.25)周;平均身高(128.76±10.48)cm;腹型34例,关节型36例,肾型16例,混合型10例;急性期50例,缓解期46例;肾受累56例。对照组中,男性50例,女性46例;平均年龄(7.41±0.41)岁;平均体重(24.42±1.49)kg;平均身高(128.77±9.17)cm。两组儿童性别、年龄、体重、身高比较差异无统计学意义(均P>0.05)。病例纳入标准:HSP组患儿符合HSP诊断标准;所有儿童临床资料完整;检查前1个月未服用抗组胺类药物,检查前3个月未服用长效皮质类固醇激素;HSP组患儿为首次发病;所有儿童凝血功能正常。排除标准:合并肿瘤等免疫异常疾病的患儿;既往有凝血功能异常,导致出、凝血病史的患儿;继发性肾病患儿;患有肿瘤及合并心血管疾病的患儿。所有患儿家属签署知情同意书。本院伦理委员会批准了本研究。
1.2 治疗方法 HSP组所有患儿都给予综合治疗,予以维生素C(国药准字:H20058523)1.0 g/d静脉滴注,孟鲁司特钠颗粒(国药准字:H20203044)4 mg/d口服,西咪替丁氯化钠注射液(国药准字:H20030076)10 mg/kg静脉滴注,10%葡萄糖酸钙(国药准字:H20020311)1 ml/kg静脉滴注,低分子肝素钙(国药准字:H20060190)60~80 μg/kg皮下注射,连续治疗2周。
1.3 疗效判定标准 临床症状有显著缓解,治疗期间无复发,判定为痊愈;临床症状有好转,治疗期间无复发,判定为显效;未达到以上标准甚或恶化,判定为无效。有效包括痊愈和显效。有效率=(痊愈+显效)例数/总例数×100%。
1.4 血清MMP-13、IL-9和TNF-α表达水平检测 采集所有儿童空腹肘静脉血2~3 ml,低温静置30 min后,2000 r/min离心10 min,取上层血清进行低温保温。采用双抗体夹心酶联免疫吸附法检测血清MMP-13、IL-9和TNF-α表达水平(试剂盒批号依次为ab221839、ab242237、ab181421,均购自美国R&D Systems公司),检测过程与检测体系的质量控制都符合要求。
1.5 统计学方法 采用SPSS 23.00统计学软件进行分析。MMP-13表达水平等计量资料以均数±标准差表示,组间比较采用t检验。相关性分析采用Spearsman法。多因素分析采用Logistic回归模型分析。计数资料以率(%)表示,组间比较采用卡方χ2检验; 检验水准α=0.05。
2 结 果
2.1 两组血清MMP-13、IL-9和TNF-α表达水平比较 见表1。HSP组血清MMP-13、IL-9和TNF-α表达水平高于对照组,两组比较差异有统计学意义(均P<0.05)。
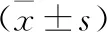
表1 两组血清MMP-13、IL-9和TNF-α表达水平比较
2.2 不同疗效患儿血清MMP-13、IL-9和TNF-α表达水平比较 见表2。在HSP组中,治疗后痊愈54例,显效36例,无效6例,有效率为93.75%。有效患儿血清MMP-13、IL-9和TNF-α表达水平低于无效患儿(均P<0.05)。
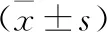
表2 不同疗效患儿血清MMP-13、IL-9和TNF-α表达水平比较
2.3 HSP患儿预后与血清MMP-13、IL-9和TNF-α表达水平相关性分析 Spearsman相关性分析显示,HSP患儿预后与血清MMP-13、IL-9和TNF-α表达水平呈正相关(r=0.722、0.542、0.443,均P<0.05)。
2.4 HSP患儿预后影响因素分析 见表3。Logistic回归分析显示,血清MMP-13、IL-9和TNF-α表达水平均为患儿预后的影响因素(均P<0.05)。

表3 HSP患儿预后影响因素分析
3 讨 论
HSP当前在临床上比较常见,是一种变态反应性疾病,主要表现为全身细小动脉、毛细血管异常[9]。HSP多发生在小儿,在不同性别患儿中的发病率无统计学差异,虽然发病比较急促,但是病程具有自限性,可反复发病,从而影响患儿的身心健康,也影响家庭生活质量。HSP病理改变为血管性炎性反应,涉及大量异常细胞因子的表达,但是具体发病机制还不明确。本研究显示,HSP组血清MMP-13、IL-9和TNF-α表达水平高于对照组,表明HSP患儿多伴有血清MMP-13、IL-9和TNF-α的高表达。从机制上分析,作为一种钙离子、锌离子依赖性蛋白水解酶,MMP-13可参与调节细胞外基质的炎症反应,其高表达可破坏血管内皮屏障,促进大量炎症因子释放和白细胞渗出、迁移,增加内皮细胞通透性,导致患儿出现血管性疾病[10-11]。IL-9具有强大的促炎作用,可直接或者与其他炎症因子协同驱动T细胞应答,诱发炎症活性基因表达,可参与HSP的发生与发展。在机体受到病原体侵袭时,血清中会产生大量TNF-α,后者可促进机体大量分泌趋化因子,还能刺激上皮细胞、成纤维细胞、气道平滑肌细胞分泌大量炎症因子与造血细胞因子,引起骨髓细胞系增生,以增强局部炎症[12-13]。
本研究显示,在HSP组中,治疗后痊愈54例,显效36例,无效6例,有效率为93.75%,有效患儿血清MMP-13、IL-9和TNF-α表达水平低于无效患儿。HSP的治疗药物与方法比较多,包括维生素C、孟鲁司特、西咪替丁、葡萄糖酸钙、低分子肝素钙,在临床上多采用药物联合治疗,可根据患儿病情状况调整用药类型与用药剂量[14-15]。特别是孟鲁司特可降低免疫球蛋白水平、血管内皮生长因子和碱性成纤维细胞生长因子的表达水平,发挥调节免疫及抗血管生成等作用,从而缓解HSP患儿临床症状,改善预后。
当前HSP患儿相对较多,也存在迁延不愈等特点,可严重影响患儿的生活质量[16-17]。本研究中,Spearsman相关性分析显示HSP患儿预后与血清MMP-13、IL-9和TNF-α表达水平呈正相关,Logistic回归分析显示血清MMP-13、IL-9和TNF-α表达水平为影响患儿预后的重要因素。从机制上分析,MMP-13多来源于内皮细胞、成纤维细胞等,正常情况下在机体中很少表达,但在内外在各种因素刺激下,MMP-13的大量释放可造成肾小球基膜的损伤,也可破坏血管基底膜及组织结构,导致机体出现血管性疾病[18]。IL-9也能增加微血管通透性,进而参与血管的病理损伤[19]。TNF-α高表达也能产生多种细胞因子,增加单核细胞及中性粒细胞,从而降解血管基底膜,直接破坏血管内皮屏障,导致患儿预后变差[20-21]。
综上所述,HSP患儿血清MMP-13、IL-9和TNF-α呈现高表达状况,与患儿预后存在相关性,也是影响患儿预后的重要因素。
