铁基材料活化过硫酸盐降解水中抗生素的研究进展
2022-01-25凌良雄周彦波
凌良雄,陆 建,周 易,周彦波
华东理工大学资源与环境工程学院, 上海 200237
抗生素是用于抑制微生物感染性疾病的化合物,广泛应用于医疗保健及畜禽养殖等领域[1]. 据统计,我国地表水和沿海水体中抗生素的检出率分别为98.0%和96.4%[2]. 抗生素在水中长期存在会导致抗性细菌和抗性基因的产生. 抗性基因在环境中的停留时间较抗生素更长,并且会在不同环境介质中传播,往往比抗生素本身对环境的危害更大[3]. 因此,从源头(污水处理厂)削减是对抗生素管控和治理的关键.
目前抗生素废水处理方法主要有吸附法、生物降解法和高级氧化技术(AOPs)等[4]. 吸附法易于操作且成本较低,但只能将抗生素从废水中分离出来,并未降解抗生素. 生物法适用于处理低浓度抗生素废水,但处理时间较长,有产生抗性基因的风险. AOPs可将抗生素快速、无选择性地氧化成小分子化合物,甚至彻底矿化成CO2、H2O和其他矿物盐,降解比较彻底.
根据氧化剂的不同,AOPs可以分为臭氧氧化、芬顿氧化、高锰酸钾氧化和过硫酸盐(PS)氧化等. 其中,基于PS分解生成硫酸根自由基(SO4·-)的高级氧化技术(SR-AOPs)由于操作简单、自由基生成速度快而得到了广泛的研究[5]. PS包括过一硫酸盐(HSO5-,PMS)和过二硫酸盐(S2O82-, PDS),可通过加热、碱、辐射、超声、催化剂活化等方式产生SO4·-. SO4·-较羟基自由基(HO·)具有更高的氧化还原电位及选择性,能够将难降解有机物分解为可生物降解化合物,最终实现较高的矿化率[4]. 因此,SR-AOPs对水中抗生素的降解具有明显的优势.
近年来,多种类型的催化剂,如金属氧化物、碳材料、黏土以及多金属氧酸盐等新型材料已被应用于活化PS降解水中抗生素等污染物[6]. 其中,铁基材料在地壳中含量丰富且对环境表现出友好性,是最受欢迎的PS活化材料之一[7]. 由于均相铁基体系中许多副反应难以控制,铁(氢)氧化物[8-9]、零价铁(ZVI)[10]和铁硫化物[11-12]等非均相铁基材料在活化PS降解抗生素领域引起了广泛关注. 目前,铁基材料活化PS的综述论文主要集中在降解有机污染物方面[13],或是从宏观角度对活化机理进行评述[14],而很少有研究对铁基材料活化PS降解水中抗生素进行总结. 因此,深入理解铁基材料活化PS降解水中抗生素的作用机理,对于更好地满足水质要求并挖掘铁基材料潜能具有重要的理论和现实意义.
基于此,该文在介绍均相铁基反应原理的基础上,重点分析了几种典型非均相铁基材料活化PS降解水中抗生素的研究进展,讨论了影响铁基材料/PS体系反应活性的因素,并对铁基材料活化PS的发展前景进行了展望,以期为抗生素废水处理提供参考.
1 均相铁基体系中的反应
均相铁基体系是利用Fe2+和Fe3+活化PS,具有传质阻力低、反应速率高等优点. Fe2+活化PS的机理如式(1)~(3)[15-16]所示. HO·由SO4·-与H2O、OH-反应生成〔见式(4)(5)〕[17]. Fe2+在活化过程中会不可避免地转化为Fe3+,Fe3+与PMS反应生成活性较低的SO5·-,但Fe3+会转化为Fe2+,进一步与PMS反应生成高活性的SO4·-[18].
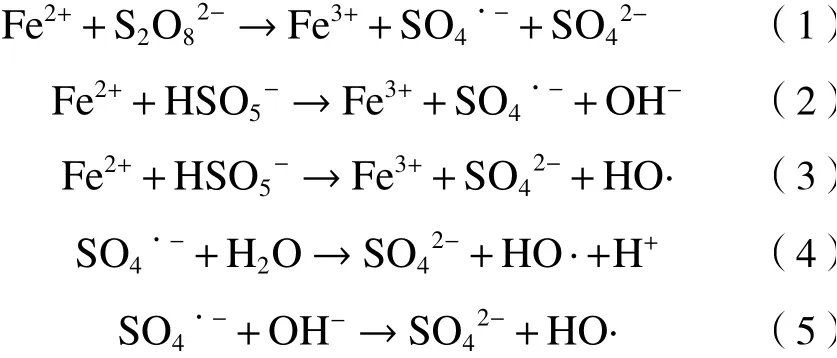
SO4·-和HO·等活性物种对污染物具有不同的反应特性,目前均相铁基体系中各活性物种的贡献机制仍存在争议,Wang等[19]使用甲基苯基亚砜(PMSO)作为化学探针验证了均相Fe2+/PS体系中Fe(Ⅳ)的存在〔见式(6)(7)〕;并且在较宽pH范围内检测到了甲基苯基砜(PMSO2)的存在,认为Fe(Ⅳ)是降解污染物的主要活性物种.
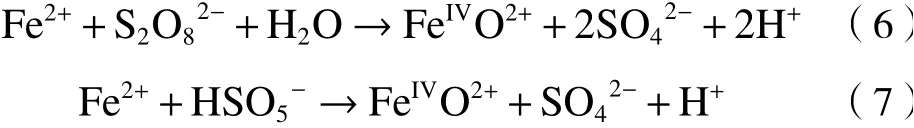
尽管均相铁基体系可快速生成活性物种,但该过程受Fe2+浓度的影响较大. Fe2+浓度不足时,难以连续活化PS,而过量的Fe2+会将PS和SO4·-转化为活性较低的SO42-〔见式(8)(9)〕[20]. 同时,Fe3+在pH>3时会形成Fe(OH)3沉淀,均相铁基体系在实际应用中会受到pH和铁泥产量大的限制.
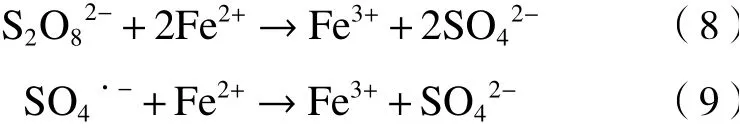
针对均相铁基体系的缺陷,已有研究[21]报道了提高其活化效率的方法,包括螯合改性、外部能量引入以及Fe2+再生等. 这些工作有助于探索非均相铁基材料活化PS的机制,为理性设计高效非均相铁基材料奠定了基础.
2 非均相铁基材料对水中抗生素的去除行为
常见的应用于活化PS的非均相铁基材料包括铁(氢)氧化物、零价铁(ZVI)和铁硫化物. 同时,考虑到这些铁基材料活化PS的实际效果,学者们进行了大量改性工作来提高材料的稳定性和重复使用性,以便更加绿色、经济地实现对水中抗生素的高效降解.
2.1 铁(氢)氧化物
磁铁矿(Fe3O4)、Fe2O3和FeOOH是研究最为广泛的3种铁(氢)氧化物[6]. 各种铁(氢)氧化物活化PS降解水中抗生素的应用情况见表1.

表1 铁(氢)氧化物活化PS降解抗生素性能Table 1 Summary of iron(hydr)oxides activated PS for the degradation of antibiotics
2.1.1 Fe3O4
Fe3O4是一种混合价氧化物,Fe(Ⅱ)、Fe(Ⅲ)所占比例在0.30~0.43之间[26]. 此外,Fe3O4具有磁性,便于在反应结束时回收并在后续运行中重复使用. 因此,Fe3O4被广泛用于活化PS降解抗生素等污染物. 然而,研究发现,Fe3O4在活化PS的过程中溶解释放的Fe2+和Fe3+十分有限. 例如,在Fe3O4/PDS体系中,总溶解铁占总铁的比例仅为0.125%(0.25 mg/L)[27]. 因此,人们普遍认为Fe3O4表面晶格中的Fe(Ⅱ)在活化PS方面起主导作用[14]. 但由于Fe3O4对Fe2+的吸附能力较强,也有研究[28]认为,吸附在Fe3O4表面的Fe2+对PS的活化起重要作用. 溶解释放的铁被迅速吸附到Fe3O4表面,这解释了其他研究中总溶解铁浓度低的问题.
由于Fe3O4纳米颗粒容易团聚导致催化活性降低,Fe3O4复合催化剂成为目前的研究热点[29]. Lu等[8]开发了一种简单绿色高效的类芬顿催化剂Fe3O4@MoS2用于降解水中磺胺(SA),该材料克服了纳米颗粒团聚及Fe(Ⅱ)/Fe(Ⅲ)循环效率低的问题. 相较于传统Fe3O4,Fe3O4@MoS2对SA的降解速率提高了86倍.
2.1.2 Fe2O3
Fe2O3具有α、β、γ和ɛ等不同的晶体结构. 由于β-Fe2O3和ɛ-Fe2O3难以制备成单相材料,赤铁矿(α-Fe2O3)和磁赤铁矿(γ-Fe2O3)是研究最多的[30]. α-Fe2O3氧化还原电位较低,对PMS活化性能较差[31]. Guo等[32]发现,掺杂碱土金属Ca能够增加α-Fe2O3的比表面积和导电性能,促进氧空位的形成,从而显著提高PMS的活化效率. Ca-α-Fe2O3在120 min内对四环素(TC)和环丙沙星(CIP)降解率均大于95%. 除金属掺杂之外,非金属掺杂催化剂制备方法简单,对催化性能也有显著提升. Deng等[33]通过共沉淀、水热和煅烧三步法成功制备出硫掺杂的α-Fe2O3(S-α-Fe2O3),发现S-α-Fe2O3在活化PDS降解卡马西平(CBZ)方面表现出良好的催化活性和稳定性. 硫作为电子俘获中心,显著减小了α-Fe2O3带隙,提高了光生电子与空穴的分离效率.
γ-Fe2O3具有磁性且表面氧物种丰富,有利于催化反应的进行. 但传统的γ-Fe2O3易失活,Niu等[23]采用氧化沉淀法制备出磁性γ-Fe2O3/CeO2催化剂,发现Ce在相应的PDS体系中可以增强催化剂的电子转移,加速Fe(Ⅱ)/Fe(Ⅲ)循环. 其次,Ce可以限制铁溶解来提高催化剂的稳定性和重复使用性. 此外,O2·-和1O2对该体系的催化活性也起到重要作用.
2.1.3 FeOOH
FeOOH是含铁废物的主要成分之一,具有α、β、γ和δ等4种同质异构体. Fan等[9]合成了上述不同结构的FeOOH用于活化PMS,发现FeOOH的催化活性表现为δ-FeOOH>针铁矿(α-FeOOH)>γ-FeOOH>β-FeOOH. He等[34]发现,α-FeOOH表面的铁物种主要是Fe(Ⅲ),α-FeOOH/H2O2/PS体系对氯霉素(CAP)的降解效果较差. 而加入还原剂羟胺(HA)后,Fe(Ⅱ)/Fe(Ⅲ)的循环效率提高,对CAP的降解性能显著提升. 此外,Qi等[35]通过还原煅烧将水处理残留物表面铁物种转化为Fe(Ⅱ)和ZVI,发现改性后的非均相材料在活化PDS降解磺胺甲恶唑(SMX)方面表现出良好的催化活性.
与Fe3O4、γ-Fe2O3相同,也有研究指出FeOOH与其他金属氧化物复合可以提高催化活性. Zhang等[36]发现,Co3O4/δ-FeOOH复合催化剂活化PMS在25 min内能够降解82%的洛美沙星(LOM). 吸附到催化剂表面的PMS被还原性的Fe(Ⅱ)和Co(Ⅱ)活化,通过电子转移生成SO4·-. Fe与Co之间的氧化还原循环以及再生的Fe(Ⅱ)和Co(Ⅱ)会连续活化PMS以生成SO4·-. SO4·-与H2O、OH-反 应 生 成HO·,HO·在LOM降解过程中起主导作用.
2.2 ZVI
ZVI是一种还原性铁基材料. 除表面溶解释放Fe2+外,ZVI可直接作为电子供体活化PS产生SO4·-〔见式(10)(11)〕. 同时,Fe(Ⅲ)与ZVI继续反应实现Fe(Ⅱ)再生〔见式(12)〕[13]. 近年来,许多研究已经证明了ZVI活化PS对抗生素的优异降解性能(见表2).然而,Lin等[37]发现,ZVI表面溶解释放Fe2+的速率会受ZVI粒径大小的影响. 制备的nZVI(平均粒径为46 nm)比表面积大、暴露的活性位点更多,对磺胺二甲嘧啶(SMT)的降解效果明显超过商业nZVI(平均粒径为63 nm).

表2 ZVI活化PS降解抗生素性能Table 2 Summary of ZVI activated PS for the degradation of antibiotics

为了防止ZVI团聚和氧化,负载型ZVI得到了广泛的研究[13]. Wu等[43]制备的nZVI负载有机蒙脱土复合材料(nZVI/OMt)对活化PDS降解水中磺胺嘧啶(SDZ)表现出优异的催化活性. nZVI/OMt/PDS体系的反应速率是nZVI/PDS体系的1.5倍. 此外,Ma等[10]发现,载体与nZVI之间存在协同作用. ZVI/BC复合材料表面铁含量的增加有助于增强表面的化学吸附作用. 同时,吸附的SDZ集中在催化剂表面,提高了SDZ利用率并加速其降解.
2.3 铁硫化物
自20世纪90年代马基诺矿(FeS)被应用于环境修复以来,铁硫化物在催化反应中逐渐受到重视,其中FeS和黄铁矿(FeS2)是最常用的PS活化材料[44](见图1).
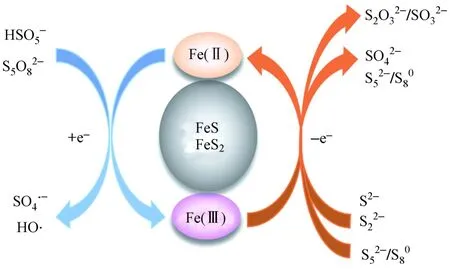
图1 铁硫化物/PS体系可能的催化机制Fig.1 Possible catalytic mechanism of iron sulfides/PS system
2.3.1 FeS
FeS是通过硫酸盐生物还原形成的亚稳态矿物.FeS因具有较强的还原能力,故对PS等多种物质表现出较高的反应活性[45]. 均相活化机制认为,FeS可溶解释放Fe2+活化PS,生成的Fe3+被FeS或S2-还原为Fe2+以持续活化PS降解抗生素等污染物〔见式(13)~(16)〕[46]. 非均相活化机制则认为,FeS表面晶格中的Fe(Ⅱ)直接活化PS,S(Ⅱ)作为电子供体实现Fe(Ⅱ)再生〔见式(17)〕[45]. 尽管有研究证明了FeS/PS体系中存在均相和非均相反应,但是很少有研究关注它们之间的关系. Fan等[11]发现,FeS/PDS体系对TC的降解首先发生在FeS表面,当体系中溶解铁浓度高于1.35 mg/L时,均相反应逐渐成为主导反应. 然而,目前对于这两种机制的研究尚不清楚,在今后的研究中仍需进一步明确.
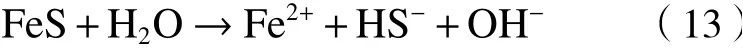
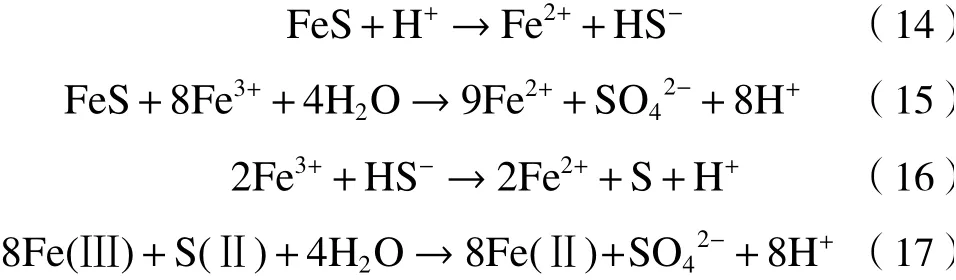
2.3.2 FeS2
FeS2表面富含Fe(Ⅱ)和低价硫物种,可作为非均相催化剂活化PS以降解抗生素[47]. 大部分研究认为FeS2表面晶格中的Fe(Ⅱ)是影响PS活化和自由基形成的主要因素,而没有充分探索FeS2/PS体系中硫物种的作用. Zhou等[48]提出,硫物种是PMS活化的主要电子供体,S22-是影响Fe(Ⅱ)再生和PMS活化的关键因素. 同时,S52-、S80和S2O32-等硫物种也可以加速Fe(Ⅱ)/Fe(Ⅲ)循环以提高PMS的活化效率.
此外,Ma等[12]通过PMSO探针证明了FeS2/PDS体系中Fe(Ⅳ)的存在. 他们认为,FeS2/PS体系中同时发生两个过程来生成Fe(Ⅳ). FeS2表面释放的Fe2+与PS反应生成Fe(Ⅳ),另外,吸附在FeS2表面的S2O82-可以与其表面晶格中的Fe(Ⅱ)反应生成Fe(Ⅳ). Fe(Ⅳ)通过一系列副反应转化为Fe(Ⅱ)以活化PS产生SO4·-和HO·,对CBZ的降解起重要作用.
2.4 单原子铁
2011年,Qiao等[49]将孤立的单个Pt原子锚固到FeOx纳米微晶的表面,发现这种催化剂表现出优异的催化性能和稳定性,首次提出了单原子催化剂(SACs)的概念. SACs不仅具有非均相催化剂易于回收利用的特点,而且具有均相催化体系原子利用率高的优势,是连接均相和非均相催化剂之间的桥梁[50].
Peng等[51]采用铁咪唑配合物(Fe ICC)作为前驱体制备了单原子铁催化剂(SA Fe-g-C3N4)以活化PMS降解TC,发现锚定在g-C3N4上的单原子铁可以直接活化PMS产生高价铁. 此外,1O2也对TC的降解起到重要作用. SACs中没有传统的金属-金属键,可以最大限度地暴露催化活性位点,从而实现原子利用率的最大化[50]. 但是由于PMS的强酸性会导致SACs金属浸出进而造成环境污染,同时对抗生素等污染物的催化性能逐渐下降. 因此,SACs需要加强金属与载体之间的配合来解决金属离子的浸出问题.
3 铁基材料活化PS降解水中抗生素的影响因素
铁基材料活化PS降解水中抗生素受自身理化性质和外部条件等因素影响,包括初始pH、PS和催化剂浓度、水中阴离子和天然有机物、催化剂稳定性与重复使用性及经济可行性等[52](见图2).

图2 铁基材料/PS体系的影响因素Fig.2 The influence of various factors on the ironbased material/PS system
3.1 初始pH
pH是铁基材料活化PS过程中的关键影响因素,它不仅决定铁的存在形式,还影响催化剂表面性质[53]. Fe2+在pH为2~9范围内可以保持稳定,而Fe3+在pH>3时会形成Fe(OH)3沉淀[54]. Lu等[8]研究了Fe3O4@MoS2/PMS体系中初始pH对SA降解速率的影响,发现初始pH为3时,其降解速率最快. pH接近中性时,降解速率仍然很高. 当pH升至9时,降解速率明显减缓. 他们认为,Fe3O4表面晶格中的Fe(Ⅱ)在碱性环境中被部分钝化,从而降低了反应速率.
目前报道的大部分类芬顿技术只适用于酸性(pH为3~4)反应条件,仍然没有真正克服pH的限制. 同时,由于PMS的强酸性,体系中加入PMS时pH往往会降低. 传统理论认为,类芬顿反应主要受到宏观环境pH的影响,而忽略了催化剂表面等微环境pH对芬顿活性的作用机制[55]. 因此,开发可真正克服宏观环境pH限制的类芬顿技术在环境污染控制领域具有重要的科学意义.
3.2 PS和催化剂浓度
研究[56-57]发现,适当的PS浓度可以提高抗生素的降解效率,但过量的PS会将HO·和SO4·-转化为反应活性较低的SO5·-和HSO4-〔见式(18)(19)〕. Lu等[8]研究了PMS剂量对SA降解的影响,发现当PMS投加量在0.5~1.0 mmol/L之间时,SA的降解率随着PMS用量的增加而升高. 而当PMS的投加量增至1.5 mmol/L时,SA在前5 min的降解速率比1.0 mmol/L时慢得多. 因此,确定PS的最佳浓度对于实际应用至关重要.
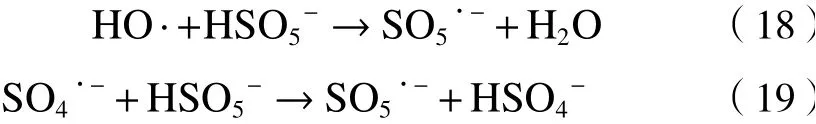
催化剂浓度也是影响PS活化的重要因素. Pan等[58]发现,当ZVI浓度为0.05~0.40 mmol/L时,SMT的降解速率逐渐增加;但当ZVI浓度达到0.8 mmol/L时,其降解速率反而减慢. Xi等[59]在Fe@N/BC/PDS体系研究中也得出了类似结论. 原因在于,过量催化剂会产生过量的自由基和Fe2+,并导致它们相互作用〔见式(8)(9)(20)(21)(22)〕[20,60].
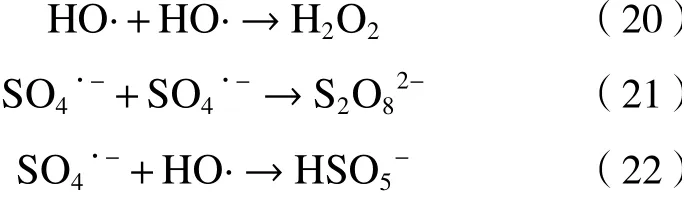
3.3 水体中阴离子及天然有机物
实际水体中普遍存在各种阴离子(Cl-、HCO3-、NO3-、SO42-)与活性物种反应从而影响催化性能[61].Lu等[27]认为,Cl-、HCO3-可以与HO·、SO4·-反应形成活性较低的Cl·、Cl2·-、HOCl·-和CO3·-〔见式(23)(24)〕,从而抑制了抗生素的降解. 而Duan等[62]则认为,HCO3-可以将体系pH调节到8.5的碱性条件,有利于HSO5-向SO52-转化〔见式(25)〕,为1O2的产生提供机会.

天然有机物(NOMs)对铁基材料/PS体系降解水中抗生素等污染物具有双重影响. Lu等[63]认为NOMs作为一种潜在污染物,会与抗生素竞争活性位点,导致降解效率降低. Duan等[64]则认为,NOMs可以在水中形成半醌自由基以活化PMS产生SO4·-. 相较于NOMs与HO·之间的反应,NOMs与SO4·-的反应速率更慢,因此对PS体系降解抗生素等污染物的影响不大. 同时,当抗生素降解涉及非自由基路径时,NOMs的影响也会减小[65].
3.4 稳定性与重复使用性
除催化活性之外,铁基材料在连续运行中的稳定性和重复使用性是一个值得关注的问题. 目前,催化剂失活的主要原因[66]如下:①材料表面污染物及中间产物的积累抑制了活性位点与PS接触;②Fe2+流失导致催化剂活性位点数量减少,催化剂表面上沉积的铁氧化物阻碍了Fe2+的释放.
鉴于上述情况,一些研究者采用热处理和超声处理等方法来恢复催化剂的反应活性,并取得了较好的效果. Pu等[67]发现,Fe@C-800催化剂循环4次之后,SMX的降解率从98.4%降至28.7%. 他们在800 ℃下对其进行热再生,发现催化剂反应活性几乎完全恢复. Lai等[66]发现,磁分离后超声清洗可以有效去除钛磁铁矿表面的吸附质以恢复催化活性.
稳定性和重复使用性对评估催化剂在实际应用中的可行性至关重要. 然而,在多次循环后保持高催化性能仍然是一个巨大的挑战. 因此,对于催化剂失活原因及再生方法的研究仍需进一步加深.
3.5 经济性可行性等指标
作为H2O2的替代氧化剂,PS处理水中污染物的研究持续了近20年,但关于实际工程应用的报道很少[68]. 尽管在实验室中已采用SR-AOPs处理了一些抗生素废水,但主要聚焦于工艺的降解性能,而很少关注成本. 因此,为了推动SR-AOPs从实验室研究发展到实际应用,经济可行性是必须考虑的因素.
与其他过渡金属相比,铁的价格较低,且铁基材料合成方法较为简单[6]. 据报道,PDS(0.74 $/kg,以K2S2O8计)的价格远低于H2O2(1.5 $/kg)和PMS(2.2$/kg,以KHSO5计)[69]. 当然,这些评估仅是在实验室运行成本基础上进行的,其实际应用成本评估需要诸如运输成本、施工成本等更多实际数据来支撑. 此外,对SR-AOPs的经济可行性评估应该综合考虑工艺的适应条件和降解性能,仅比较SR-AOPs的成本是比较困难且没有价值的.
4 结论与展望
a) 铁基材料活化PS降解水中抗生素表现出良好效果. 掺杂、负载等改性方式可以显著提高铁基材料的催化活性. 抗生素降解过程中,主要有自由基(如HO·、SO4·-和O2·-)和非自由基(如1O2和高价铁)两种氧化降解途径.
b) 水体中存在多种阴离子(Cl-、HCO3-、HPO42-、H2PO4-等)和NOMs等易与抗生素竞争消耗活性物种的物质,不仅导致PS利用率降低,还可能产生有毒副产物. 因此,开发具有抗干扰、选择性降解能力的铁基材料/PS技术具有重要的环境意义,但目前这方面研究尚处于起步阶段,仍存在很大挑战.
c) 目前铁基材料/PS体系降解抗生素大多数是以模拟废水在间歇式反应器中进行的. 但模拟废水与实际废水的组成存在较大差异,间歇式反应器也不能满足真实的废水处理需求,非常有必要将研究向实际水环境拓展.
d) 单原子铁催化剂活化PMS对四环素类抗生素具有良好的降解性能,但单原子铁和载体结构特性与单原子铁催化剂催化降解抗生素性能之间的构效关系尚不清楚,催化机制也有待进一步明确.
参考文献(References):
[1]TAN Q W,LI W Y,ZHANG J P,et al.Presence, dissemination and removal of antibiotic resistant bacteria and antibiotic resistance genes in urban drinking water system:a review[J].Frontiers of Environmental Science & Engineering,2019,13(3):1-15.
[2]LYU J, YANG L S, ZHANG L, et al. Antibiotics in soil and water in China:a systematic review and source analysis[J].Environmental Pollution, 2020, 266: 115147.
[3]WANG J L, ZHUAN R.Degradation of antibiotics by advanced oxidation processes:an overview[J].Science of the Total Environment,2020,701:135023.
[4]CHEN G Y,YU Y,LIANG L,et al. Remediation of antibiotic wastewater by coupled photocatalytic and persulfate oxidation system: a critical review[J]. Journal of Hazardous Materials,2021,408:124461.
[5] 郭彦秀,李旭光,侯太磊,等. 生物炭基材料活化过一硫酸盐降解有机污染物的研究进展[J]. 环境科学研究,2021,34(4):936-944.
GUO Y X,LI X G,HOU T L,et al. Review of biochar-based materials for catalyzing peroxymonosulfate degradation of organic pollutants[J]. Research of Environmental Sciences,2021,34(4):936-944.
[6]WANG J L,TANG J T.Fe-based Fenton-like catalysts for water treatment: preparation,characterization and modification[J].Chemosphere,2021,276:130177.
[7] 衣晓虹, 王崇臣.铁基金属-有机骨架及其复合物高级氧化降解水中新兴有机污染物[J].化学进展,2021,33(3):471-489.
YI X H, WANG C C.Elimination of emerging organic contaminants in wastewater by advanced oxidation process over iron-based MOFs and their composites[J].Progress in Chemistry,2021,33(3):471-489.
[8]LU J, ZHOU Y, ZHOU Y B.Efficiently activate peroxymonosulfate by Fe3O4@MoS2for rapid degradation of sulfonamides[J].Chemical Engineering Journal,2021,422:130126.
[9]FAN J Y,ZHAO Z W,DING Z X,et al. Synthesis of different crystallographic FeOOH catalysts for peroxymonosulfate activation towards organic matter degradation[J]. RSC Advances,2018,8(13):7269-7279.
[10]MA D M,YANG Y,LIU B F,et al.Zero-valent iron and biochar composite with high specific surface area via K2FeO4fabrication enhances sulfadiazine removal by persulfate activation[J].Chemical Engineering Journal,2021,408:127992.
[11]FAN J H, CAI Y, SHEN S H, et al.New insights into FeS/persulfate system for tetracycline elimination: Iron valence,homogeneous-heterogeneous reactions and degradation pathways[J].Journal of Environmental Sciences,2022,112:48-58.
[12]MA X Y, YE C, DENG J, et al.Elucidating the role of Fe(Ⅳ) and radical species for CBZ degradation in FeS2/PS system[J].Separation and Purification Technology,2021,274:118982.
[13]LI J, YANG L X, LAI B, et al.Recent progress on heterogeneous Fe-based materials induced persulfate activation for organics removal[J].Chemical Engineering Journal,2021,414:128674.
[14]HOU K J, PI Z J, YAO F B, et al.A critical review on the mechanisms of persulfate activation by iron-based materials:clarifying some ambiguity and controversies[J].Chemical Engineering Journal,2021,407:127078.
[15]ZHU C Y, FANG G D, DIONYSIOU D D, et al.Efficient transformation of DDTs with persulfate activation by zero-valent iron nanoparticles: a mechanistic study[J].Journal of Hazardous Materials,2016,316:232-241.
[16]RASTOGI A, AL-ABED S R, DIONYSIOU D D.Effect of inorganic, synthetic and naturally occurring chelating agents on Fe(Ⅱ) mediated advanced oxidation of chlorophenols[J].Water Research,2009,43(3):684-694.
[17]WANG Z, JIANG J, PANG S Y, et al.Is sulfate radical really generated from peroxydisulfate activated by iron(Ⅱ) for environmental decontamination?[J].Environmental Science &Technology,2018,52(19):11276-11284.
[18]RASTOGI A, AL-ABED S R, DIONYSIOU D D.Sulfate radicalbased ferrous-peroxymonosulfate oxidative system for PCBs degradation in aqueous and sediment systems[J].Applied Catalysis B:Environmental,2009,85(3/4):171-179.
[19]WANG Z, QIU W, PANG S Y, et al.Relative contribution of ferryl ion species (Fe(Ⅳ)) and sulfate radical formed in nanoscale zero valent iron activated peroxydisulfate and peroxymonosulfate processes[J].Water Research,2020,172:115504.
[20]ZHANG Y Q,XIE X F,HUANG W L,et al. Degradation of aniline by Fe2+-activated persulfate oxidation at ambient temperature[J]. Journal of Central South University,2013,20(4):1010-1014.
[21]KARIM A V, JIAO Y L, ZHOU M H, et al.Iron-based persulfate activation process for environmental decontamination in water and soil[J].Chemosphere,2021,265:129057.
[22]YIN F,WANG C,LIN K Y A,et al. Persulfate activation for efficient degradation of norfloxacin by a rGO-Fe3O4composite[J].Journal of the Taiwan Institute of Chemical Engineers,2019,102:163-169.
[23]NIU L J,ZHANG G M,XIAN G,et al. Tetracycline degradation by persulfate activated with magnetic γ-Fe2O3/CeO2catalyst:performance, activation mechanism and degradation pathway[J].Separation and Purification Technology,2021,259:118156.
[24]ZHAO J H, WANG Y Z, LI N, et al. Efficient degradation of ciprofloxacin by magnetic γ-Fe2O3-MnO2with oxygen vacancy in visible-light/peroxymonosulfate system[J]. Chemosphere, 2021,276: 130257.
[25]XU X,LIN R D,DENG X Y,et al.In situsynthesis of FeOOHcoated trimanganese tetroxide composites catalyst for enhanced degradation of sulfamethoxazole by peroxymonosulfate activation[J]. Separation and Purification Technology,2021,275:119184.
[26] 安继斌,夏春秋,陈红宇,等. UVA/Fe3O4活化过硫酸盐降解阿特拉津[J]. 环境科学研究,2018,31(1):130-135.
AN J B,XIA C Q,CHEN H Y,et al. Activation of persulfate by irradiated magnetite: implications for abatement of atrazine in aqueous solution[J]. Research of Environmental Sciences, 2018,31(1):130-135.
[27]LU J, ZHOU Y, LEI J Y, et al.Fe3O4/graphene aerogels: a stable and efficient persulfate activator for the rapid degradation of malachite green[J].Chemosphere,2020,251:126402.
[28]RUAN X X,GU X G,LU S G,et al.Trichloroethylene degradation by persulphate with magnetite as a heterogeneous activator in aqueous solution[J].Environmental Technology,2015,36(11):1389-1397.
[29]ZHANG Y, ZHANG B T, TENG Y G, et al.Activation of persulfate by core-shell structured Fe3O4@C/CDs-Ag nanocomposite for the efficient degradation of penicillin[J].Separation and Purification Technology,2021,254:117617.
[30]TUČEK J, ZBOŘIL R, NAMAI A, et al.ε-Fe2O3:an advanced nanomaterial exhibiting giant coercive field, millimeter-wave ferromagnetic resonance, and magnetoelectric coupling[J].Chemistry of Materials,2010,22(24):6483-6505.
[31]FENG Y,LIAO C Z,KONG L J,et al.Facile synthesis of highly reactive and stable Fe-doped g-C3N4composites for peroxymonosulfate activation:a novel nonradical oxidation process[J].Journal of Hazardous Materials,2018,354:63-71.
[32]GUO S,WANG H J,YANG W,et al.Scalable synthesis of Cadoped α-Fe2O3with abundant oxygen vacancies for enhanced degradation of organic pollutants through peroxymonosulfate activation[J].Applied Catalysis B: Environmental,2020,262:118250.
[33]DENG J, YE C, CAI A H, et al.S-doping α-Fe2O3induced efficient electron-hole separation for enhanced persulfate activation toward carbamazepine oxidation: Experimental and DFT study[J].Chemical Engineering Journal,2021,420:129863.
[34]HE F, MA W C, ZHONG D, et al.Degradation of chloramphenicol by α-FeOOH-activated two different double-oxidant systems with hydroxylamine assistance[J].Chemosphere,2020,250:126150.
[35]QI C D, YU G, HUANG J, et al.Activation of persulfate by modified drinking water treatment residuals for sulfamethoxazole degradation[J].Chemical Engineering Journal,2018,353:490-498.
[36]ZHANG H X,WANG J N,ZHANG X Y,et al. Enhanced removal of lomefloxacin based on peroxymonosulfate activation by Co3O4/δ-FeOOH composite[J]. Chemical Engineering Journal,2019,369:834-844.
[37]LIN C C, CHEN Y H.Feasibility of using nanoscale zero-valent iron and persulfate to degrade sulfamethazine in aqueous solutions[J].Separation and Purification Technology,2018,194:388-395.
[38]TAN C Q, DONG Y J, FU D F, et al.Chloramphenicol removal by zero valent iron activated peroxymonosulfate system: kinetics and mechanism of radical generation[J].Chemical Engineering Journal,2018,334:1006-1015.
[39]GHAUCH A,AYOUB G,NAIM S.Degradation of sulfamethoxazole by persulfate assisted micrometric Fe0in aqueous solution[J].Chemical Engineering Journal,2013,228:1168-1181.
[40]CUI H, TIAN Y, ZHANG J, et al.Enhanced oxidation of sulfadiazine by two-stage ultrasound assisted zero-valent iron catalyzed persulfate process:factors and pathways[J].Chemical Engineering Journal,2021,417:128152.
[41]HOA N T, NGUYEN H, NGUYEN L, et al.Efficient removal of ciprofloxacin in aqueous solutions by zero-valent metal-activated persulfate oxidation:a comparative study[J].Journal of Water Process Engineering,2020,35:101199.
[42]PULICHARLA R, DROUINAUD R, BRAR S K, et al.Activation of persulfate by homogeneous and heterogeneous iron catalyst to degrade chlortetracycline in aqueous solution[J].Chemosphere,2018,207:543-551.
[43]WU J X, WANG B, BLANEY L, et al.Degradation of sulfamethazine by persulfate activated with organomontmorillonite supported nano-zero valent iron[J].Chemical Engineering Journal,2019,361:99-108.
[44]CHEN H, ZHANG Z L, FENG M B, et al.Degradation of 2, 4-dichlorophenoxyacetic acid in water by persulfate activated with FeS (mackinawite)[J].Chemical Engineering Journal,2017,313:498-507.
[45]FAN J H, GU L, WU D L, et al.Mackinawite (FeS) activation of persulfate for the degradation of p-chloroaniline:surface reaction mechanism and sulfur-mediated cycling of iron species[J].Chemical Engineering Journal,2018,333:657-664.
[46]CHENG D, YUAN S H, LIAO P, et al.Oxidizing impact induced by mackinawite (FeS) nanoparticles at oxic conditions due to production of hydroxyl radicals[J].Environmental Science &Technology,2016,50(21):11646-11653.
[47]SHAIDA M A, SEN A K, DUTTA R K.Alternate use of sulphur rich coals as solar photo-Fenton agent for degradation of toxic azo dyes[J].Journal of Cleaner Production,2018,195:1003-1014.
[48]ZHOU Y, WANG X L, ZHU C Y, et al.New insight into the mechanism of peroxymonosulfate activation by sulfur-containing minerals:role of sulfur conversion in sulfate radical generation[J].Water Research,2018,142:208-216.
[49]QIAO B T,WANG A Q,YANG X F,et al. Single-atom catalysis of CO oxidation using Pt1/FeOx[J]. Nature Chemistry,2011,3(8):634-641.
[50]HUANG B K,WU Z L,ZHOU H Y,et al. Recent advances in single-atom catalysts for advanced oxidation processes in water purification[J]. Journal of Hazardous Materials,2021,412:125253.
[51]PENG X M, WU J Q, ZHAO Z L, et al.Activation of peroxymonosulfate by single-atom Fe-g-C3N4catalysts for high efficiency degradation of tetracycline via nonradical pathways:role of high-valent iron-oxo species and Fe-Nx sites[J].Chemical Engineering Journal,2022,427:130803.
[52]XIAO S, CHENG M, ZHONG H, et al.Iron-mediated activation of persulfate and peroxymonosulfate in both homogeneous and heterogeneous ways: a review[J].Chemical Engineering Journal,2020,384:123265.
[53]WANG J L, WANG S Z.Reactive species in advanced oxidation processes:formation, identification and reaction mechanism[J].Chemical Engineering Journal,2020,401:126158.
[54]ZHANG T Y,XU S C,WU P,et al. Mitoquinone attenuates bloodbrain barrier disruption through Nrf2/PHB2/OPA1 pathway after subarachnoid hemorrhage in rats[J]. Experimental Neurology,2019,317:1-9.
[55]YAN Q Y, LIAN C, HUANG K, et al.Constructing an acidic microenvironment by MoS2in heterogeneous Fenton reaction for pollutant control[J].Angewandte Chemie,2021,60(31):17155-17163.
[56] 葛勇建, 蔡显威, 林翰, 等.碱活化过一硫酸盐降解水中环丙沙星[J].环境科学,2017,38(12):5116-5123.
GE Y J, CAI X W, LIN H, et al.Base activation of peroxymonosulfate for the degradation of ciprofloxacin in water[J].Environmental Science,2017,38(12):5116-5123.
[57]ZHAO C H, SHAO B B, YAN M, et al.Activation of peroxymonosulfate by biochar-based catalysts and applications in the degradation of organic contaminants:a review[J].Chemical Engineering Journal,2021,416:128829.
[58]PAN Y W, ZHANG Y, ZHOU M H, et al.Synergistic degradation of antibiotic sulfamethazine by novel pre-magnetized Fe0/PS process enhanced by ultrasound[J].Chemical Engineering Journal,2018,354:777-789.
[59]XI M F, CUI K P, CUI M S, et al.Enhanced norfloxacin degradation by iron and nitrogen co-doped biochar:revealing the radical and nonradical co-dominant mechanism of persulfate activation[J].Chemical Engineering Journal,2021,420:129902.
[60]FAN Y N, MA W J, HE J L, et al. CoMoO4as a novel heterogeneous catalyst of peroxymonosulfate activation for the degradation of organic dyes[J]. RSC Advances, 2017, 7(57):36193-36200.
[61] 尹汉雄, 唐玉朝, 黄显怀, 等.紫外光强化Fe(Ⅱ)-EDTA活化过硫酸盐降解直接耐酸大红4BS[J].环境科学研究,2017,30(7):1105-1111.
YIN H X, TANG Y C, HUANG X H, et al.Decolorization effect of direct fast scarlet 4BS by Fe(Ⅱ)-EDTA activated peroxodisulfate under ultraviolet light[J].Research of Environmental Sciences,2017,30(7):1105-1111.
[62]DUAN X G, AO Z M, ZHOU L, et al.Occurrence of radical and nonradical pathways from carbocatalysts for aqueous and nonaqueous catalytic oxidation[J].Applied Catalysis B:Environmental,2016,188:98-105.
[63]LU J, WANG T H, ZHOU Y, et al.Dramatic enhancement effects of l-cysteine on the degradation of sulfadiazine in Fe3+/CaO2system[J].Journal of Hazardous Materials,2020,383:121133.
[64]DUAN P J, QI Y F, FENG S S, et al.Enhanced degradation of clothianidin in peroxymonosulfate/catalyst system via core-shell FeMn @ N-C and phosphate surrounding[J].Applied Catalysis B:Environmental,2020,267:118717.
[65]LEE J, VON-GUNTEN U, KIM J H.Persulfate-based advanced oxidation: critical assessment of opportunities and roadblocks[J].Environmental Science & Technology,2020,54(6):3064-3081.
[66]LAI L D, ZHOU H Y, ZHANG H, et al.Activation of peroxydisulfate by natural titanomagnetite for atrazine removal via free radicals and high-valent iron-oxo species[J].Chemical Engineering Journal,2020,387:124165.
[67]PU M J, WAN J Q, ZHANG F Z, et al.Insight into degradation mechanism of sulfamethoxazole by metal-organic framework derived novel magnetic Fe@C composite activated persulfate[J].Journal of Hazardous Materials,2021,414:125598.
[68]GAO Y J,LUO J C,SONG T H,et al. Research progress on nano-Fe0/PS system for degradation of refractory organics in aqueous solution[J]. Journal of Environmental Chemical Engineering,2021,9(4):105345.
[69]CHEN X, OH W D, LIM T T. Graphene- and CNTs-based carbocatalysts in persulfates activation: material design and catalytic mechanisms[J]. Chemical Engineering Journal, 2018,354:941-976.
