正常肝细胞和肝癌细胞对镉暴露毒性响应差异分析
2022-01-25马娇阳保欣晨张振宁王成尘崔道雷
马娇阳,保欣晨,张振宁,王成尘,崔道雷,向 萍
西南林业大学生态与环境学院/环境修复与健康研究院, 云南 昆明 650224
镉(Cadmium,Cd)是一种普遍存在于环境中的污染物,且具有较强的生物毒性[1]. 随着工业的生产与发展,土壤和水体中的Cd污染日益严重[2-3],水稻、蔬菜等植物源性食物可以通过根系富集土壤中的Cd,水体中的Cd也可通过食物链逐渐富集到鱼虾贝类等海产品中造成食品污染[4-6]. 因此,长期摄入被Cd污染的食品可导致其在体内蓄积,从而对人体产生危害. 肝脏作为机体的主要代谢场所,且是人体急性或慢性Cd中毒的主要靶器官,对金属的毒性敏感性较强,这可能是由于肝脏中可合成金属硫蛋白,从而减弱Cd对人机体的危害[7-9]. 然而,当肝细胞持续坏死或凋亡时,将会影响Cd金属硫蛋白复合物的表达[10].研究表明,低浓度Cd (0.25 μmol/L)可能会促进细胞的增殖[11],而高浓度Cd (>5 μmol/L)会诱导许多器官和组织的凋亡[12].
重金属对肝脏具有明显的毒性效应,在细胞水平上重金属可影响细胞的活性、分化和凋亡等[13]. 目前,人正常肝细胞系(HL-7702)和肝癌细胞系(HepG2)均被用于重金属毒性研究[10,14-17],且人正常肝细胞系和肝癌细胞系对重金属的响应不同. 目前,研究者多采用肝癌细胞系(HepG2)来探究Cd对人体肝细胞的毒性效应及其机制[18-19],但人正常细胞系和癌细胞系中的基因转录表达水平具有明显差异,因此两种不同类型的细胞可能对重金属毒性的耐受性有所差异[20].Xiang等[21]研究表明,采用人正常肝细胞可准确评估外部污染物对肝脏的毒性效应,与肝癌细胞相比,正常肝细胞与人体内组织的生理生化条件更加吻合.
目前,Cd对人正常肝细胞和肝癌细胞的毒性效应及其分子机制的研究较为鲜见. 因此,该研究对正常肝细胞系(HL-7702)和肝癌细胞系(HepG2)经Cd暴露后在细胞活力、形态、凋亡及凋亡相关基因表达等方面的响应差异进行了深入研究,比较了Cd对两种细胞的毒性效应,以期为准确评价Cd对肝细胞的毒性效应提供科学的试验依据.
1 材料与方法
1.1 设备及试剂
该研究使用的设备有以下几种:CO2细胞培养箱(371型,赛默飞,美国);酶标仪(SpectraMax®Plus 384型,Molecular Devices LLC公司,美国);倒置显微镜(TS-10型,尼康,日本);流式细胞仪(CyFlow®Cube6型,Sysmex Partec GmbH,德国);高速冷冻离心机(ST16R型,Thermo,美国);超微量分光光度计(Nanophotometer N60型,IMPLEN,德国);梯度PCR仪(Mastercycler Nexus Gradient型,Eppendorf,德国);聚合酶链式反应仪(荧光定量)( LightCycler®480 Ⅱ型,瑞士罗氏).
该研究使用的试剂有以下几种:DMEM高糖基础培养基、MEM基础培养基、胎牛血清(fetal bovine serum,FBS)、青霉素链霉素溶液-双抗(penicillin streptomycin,PS)和0.25%胰蛋白酶溶液,均购自武汉普诺赛生命科技有限公司;CCK-8法细胞增殖检测试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒、总RNA快速提取试剂、cDNA第一链快速合成试剂盒(去基因组)、SYBR green qPCR master mix,均购自南京翼飞雪生物科技有限公司;分析纯氯化镉(CdCl2),购自上海金山亭新化工试剂厂.
1.2 细胞培养与暴露
人正常肝细胞系(HL-7702)来自中国科学院细胞库(上海),人肝癌细胞系(HepG2)来自美国模式培养物寄存库(American type culture collection,ATCC).HL-7702细胞和HepG2细胞分别生长于含有10%胎牛血清、1%PS的DMEM高糖基础培养基和MEM基础培养基中,并在37 ℃、5% CO2的培养箱中培养.
用纯水溶解CdCl2以配置细胞暴露母液,并用0.22 μm滤膜(Milipore-GP,美国)除菌以备用. 在进行细胞暴露前,利用细胞相应的基础培养基将CdCl2溶液稀释至目标浓度.
1.3 细胞形态及活力
为探究重金属Cd对正常肝细胞和肝癌细胞活力的变化,将HL-7702细胞和HepG2细胞以1×104cells/(100 μL·孔)的密度接种于96孔板中,并于CO2细胞培养箱中孵育过夜待细胞贴壁. 根据Aziz等[10]所设定的Cd浓度对细胞进行暴露,将完全培养基更换为含有不同Cd浓度(0~4 mg/L)的基础培养基,并继续培养24 h. Cd暴露后,利用倒置显微镜观察细胞的形态并拍照,随后根据CCK-8试剂盒说明书进行吸光度测定.
1.4 细胞凋亡
为测定细胞凋亡,将HL-7702和HepG2细胞以1×106cells/(2 mL·孔)的密度接种于6孔板中,培养24 h后,将完全培养基吸出并弃掉,以基础培养基培养的细胞作为对照组,以含0.25和1 mg/L Cd的基础培养基作为试验暴露组. 随后,将细胞放置CO2培养箱培养24 h后,收集细胞并用预冷的PBS溶液洗涤2次,用1×Binding Buffer悬浮细胞,在细胞悬液中依次加入膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙啶(PI)孵育细胞. 最后,用流式细胞仪检测凋亡情况并用FlowJo v10软件进行数据分析.
1.5 RNA提取、转录和实时定量PCR
为了探究重金属Cd对肝细胞凋亡的相关分子机制,进一步测定其相关基因的表达. 在HL-7702细胞和HepG2细胞暴露于0.25和1 mg/L Cd溶液24 h后,进行总RNA快速提取,并将其逆转录为cDNA. 之后,利用SYBR green qPCR master mix进行实时定量PCR (qRT-PCR),反应循环条件:首先为95 ℃ 10 min;然后在95℃ 15 s和60℃ 1 min的条件下循环40次.以β-Actin作为内参基因来计算相关基因的表达,细胞凋亡相关的引物序列如表1所示.
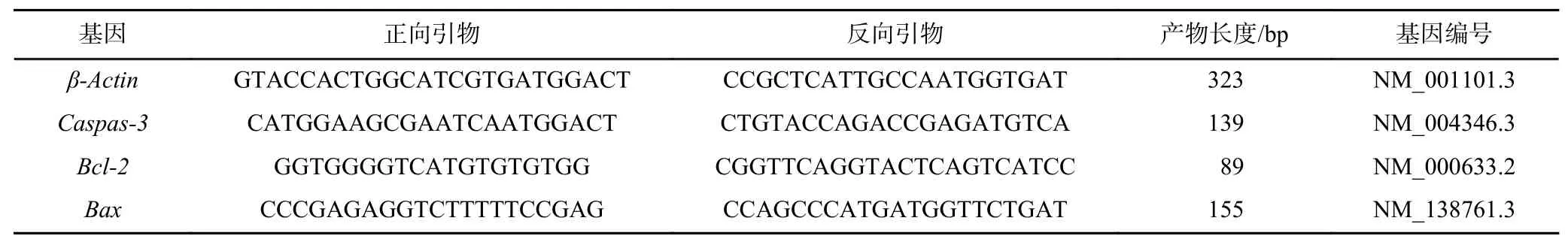
表1 细胞凋亡相关引物信息Table 1 The information of apoptosis related primers
1.6 数据分析
研究数据以平均值±标准差的形式呈现,利用Microsoft Office Excel 2019软件计算数据,GraphPad Prism 8和FlowJo v10软件作图,认为当P<0.05时,差异有统计学意义.
2 结果与讨论
2.1 重金属镉对肝细胞活力及形态影响
细胞活力是反映污染物对细胞毒性效应的重要指标之一. 为探究Cd对正常肝细胞和肝癌细胞活力的差异,该研究将HL-7702细胞和HepG2细胞暴露于不同浓度的Cd中以测定细胞活力的变化,结果表明,正常肝细胞和肝癌细胞的细胞活力变化趋势有所差异. 由图1(a)(c)可见:当Cd浓度为0.25和0.5 mg/L时,正常肝细胞和肝癌细胞活力下降均小于5%,且与对照组无显著差异;当Cd浓度为1 mg/L时,HL-7702细胞活力降至65% (P<0.000 1),而HepG2细胞活力与对照组无显著差异;当Cd浓度大于1 mg/L时,两种细胞活力均明显下降. 结果说明,Cd所诱导的肝细胞毒性是具有浓度依赖性的,与Aziz等[10]研究结果较为一致. 基于拟合曲线,两种细胞对Cd的半致死浓度(LC50)如图1(b)(d)所示,HL-7702细胞对Cd的半数致死浓度(LC50)(1.9 mg/L)低于HepG2细胞(2.4 mg/L),说明两种细胞对Cd暴露的耐受性不同,正常肝细胞对Cd更为敏感,与Xiang等[21]研究结果相似,其发现细胞暴露于外部污染物后肝癌细胞比正常肝细胞更具有耐受性. 此外,正常肺细胞(MRC-9)和癌变肺细胞(A549)对Cd暴露的敏感性也有所不同[22]. 因此,正常肝细胞和肝癌细胞对Cd暴露的毒性响应具有差异.
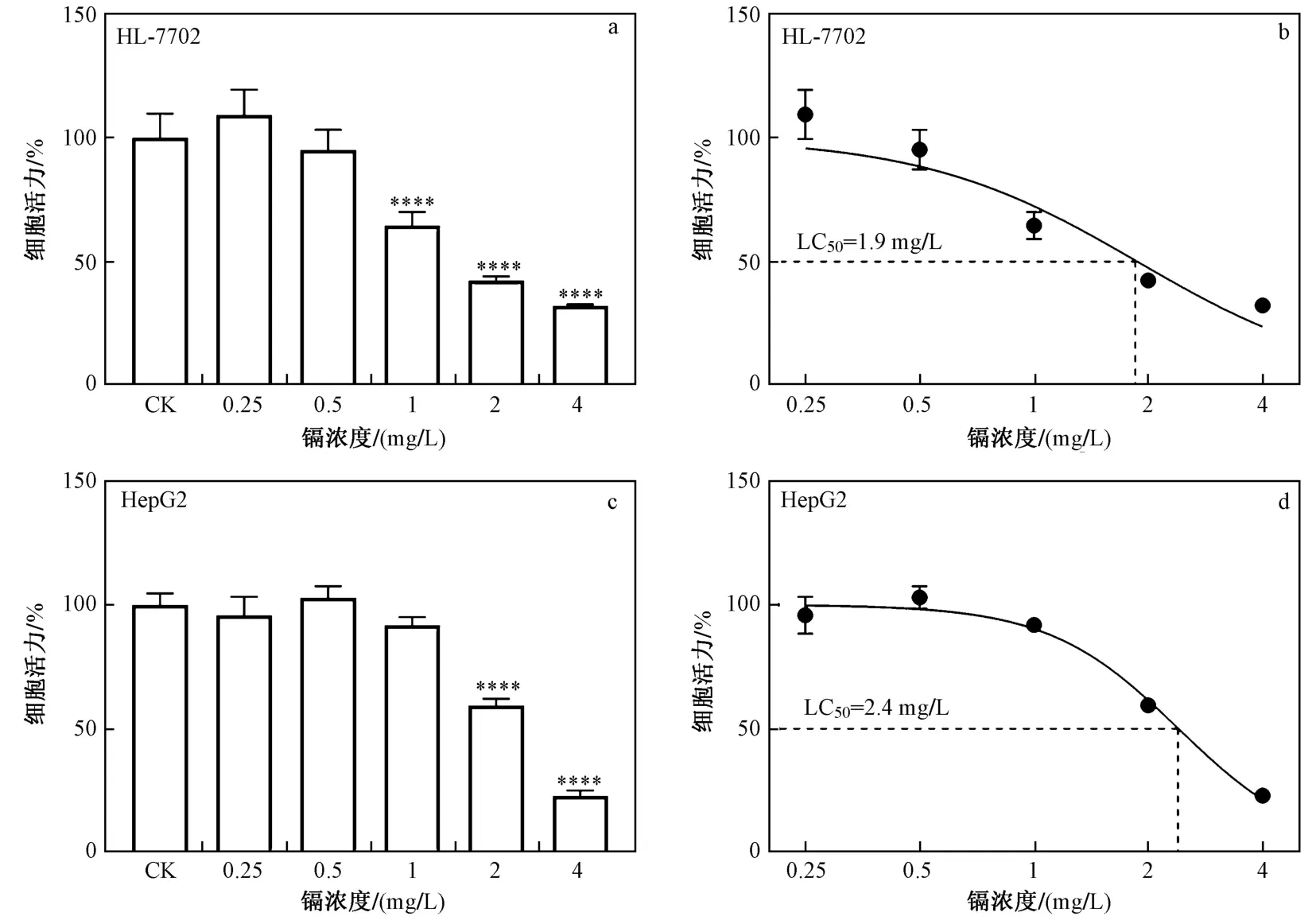
图1 不同浓度Cd对正常肝细胞(HL-7702)和肝癌细胞(HepG2)活力及半数致死浓度(LC50)的影响Fig.1 Effects of cadmium exposure on cell viability and the lethal concentration (LC50) of normal (HL-7702) and cancerous (HepG2) hepatic cells
利用倒置显微镜观察不同Cd浓度暴露组下HL-7702细胞和HepG2细胞的形态差异. 由图2可见:对照组中,HL-7702细胞形态呈多边形状;当暴露于0.25 mg/L的Cd后细胞形态与对照组差异不明显;而当HL-7702细胞暴露于1 mg/L的Cd后,有部分细胞萎缩成圆形并具有明显的细胞碎片堆积,且该浓度Cd暴露下,细胞活力也显著下降〔见图1(a)〕,说明Cd使正常肝细胞产生明显损伤[23]. 对照组中,HepG2细胞呈堆积生长,单个细胞形态不明显;当暴露于0.25和1 mg/L的Cd后,均与对照组细胞形态无明显差异,同样HepG2细胞活力也无显著下降趋势〔见图1(c)〕.
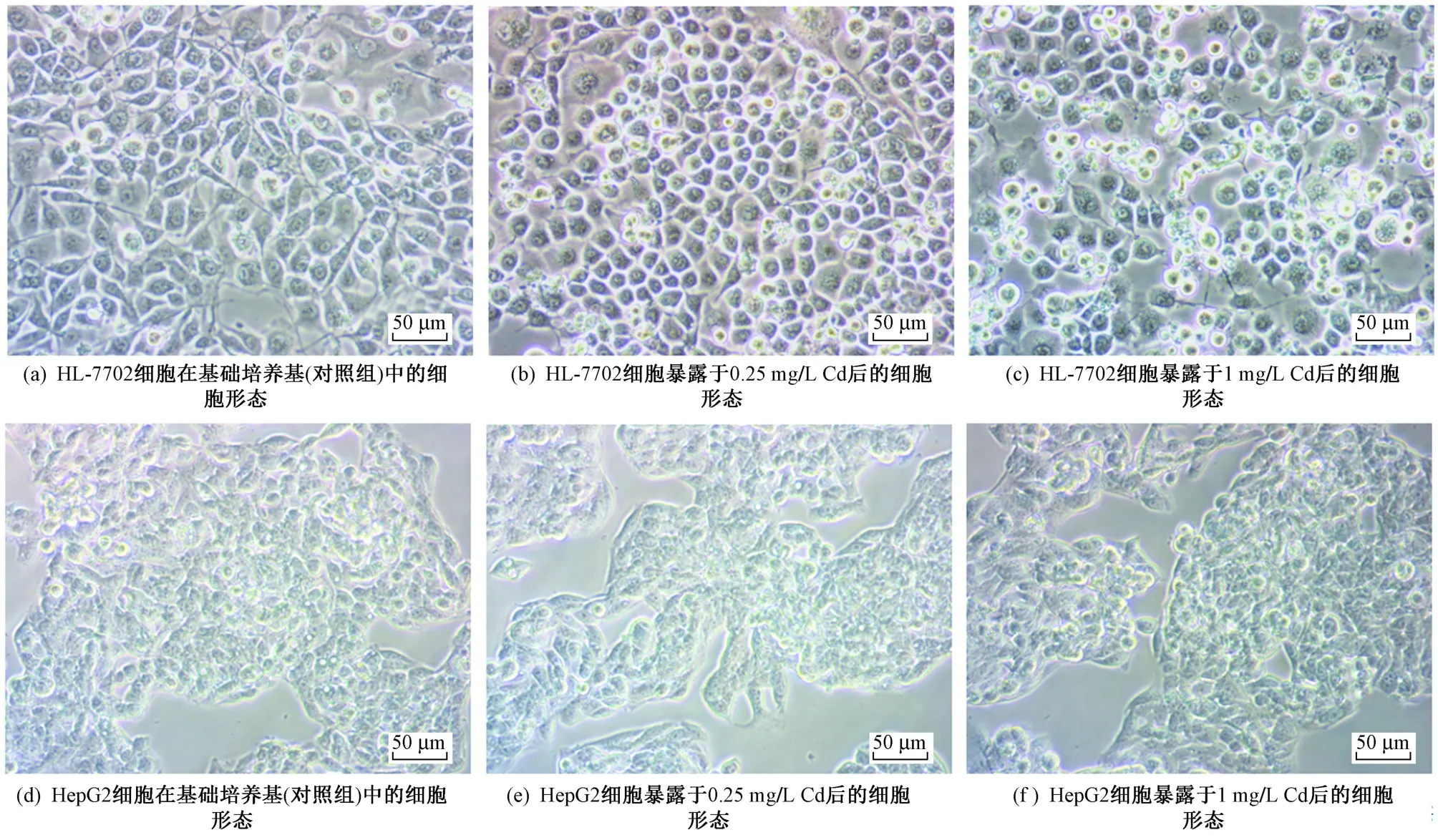
图2 不同浓度Cd暴露后正常肝细胞(HL-7702)和肝癌细胞(HepG2)的形态变化Fig.2 Morphology changes of normal (HL-7702) and cancerous (HepG2) hepatic cells after exposure to cadmium
2.2 重金属Cd诱导的肝细胞凋亡
细胞凋亡是一种严格控制的程序性细胞死亡过程,其对生物体维持内环境稳态及系统的生长发育有重要作用,但异常凋亡是一种病理过程[24-26]. 根据细胞活力及形态的结果,将HL-7702细胞和HepG2细胞暴露于浓度为0.25和1 mg/L的Cd中,研究Cd诱导两种肝细胞凋亡情况的差异. Annexin V-FITC和PI双染法常被应用于区分细胞早期凋亡与晚期凋亡[27],因此对细胞进行双染后,利用流式细胞仪测定细胞的分布(见图3),其中象限Q1~Q4分别代表坏死、晚期凋亡、早期凋亡、活细胞的数量. 由图3可见:暴露在浓度为0.25 mg/L的Cd下,HL-7702细胞凋亡率与对照组无显著差异;而Cd浓度升至1 mg/L时,正常肝细胞凋亡率显著升高,较对照组凋亡率增加了4倍. 因此,暴露于不同浓度的Cd后人正常肝细胞凋亡率变化规律与其对应的细胞活力一致,而Cd对HepG2细胞凋亡的影响与HL-7702细胞不同,暴露于0.25和1 mg/L的Cd后,HepG2细胞的凋亡率均增至对照组的2倍〔见图3(e)~(h)〕. 因此,在该研究检测浓度(0.25~1 mg/L)下,正常肝细胞的抗凋亡能力显著高于肝癌细胞,可能与正常细胞相比,癌细胞中有超过500个表达异常的基因,细胞表面死亡受体差异较大,多个辅助细胞抵抗外界刺激的酶活性均显著降低[20,28-29]. 因此,采用HepG2细胞探究Cd对人体肝脏细胞凋亡的影响将会高估其健康风险. 此外,细胞死亡可通过坏死或凋亡发生[16]. 该研究中暴露于Cd后,与对照组相比,正常肝细胞活细胞率从97.3%降至85.3%,降幅为12%〔见图3(a)~(c)〕,而肝癌细胞的降幅为5.3%〔见图3(e)~(g)〕. 因此,暴露于0.25~1 mg/L Cd中HL-7702细胞的活细胞率降幅明显高于HepG2细胞,与细胞活力检测呈现的趋势较为一致.综上,不同浓度Cd均能促进两种细胞的凋亡率或坏死率,从而降低活细胞的比率.
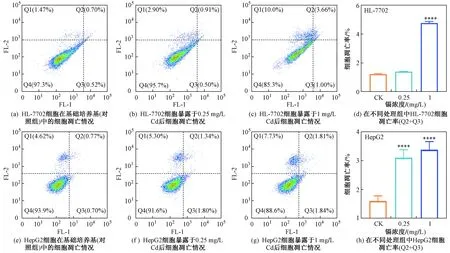
图3 Cd诱导正常肝细胞(HL-7702)和肝癌细胞(HepG2)凋亡情况Fig.3 Cadmium triggered human normal (HL-7702) and cancerous (HepG2) hepatic cell apoptosis
细胞凋亡在Cd所诱导的肝毒性中是一个极其重要的过程[30],而目前研究Cd对肝细胞的损伤多采用肝癌细胞(HepG2). 然而,正常肝细胞和肝癌细胞的代谢具有差异,因此可能会影响其对外部胁迫的响应. Wang等[31]研究表明,相同浓度药物作用下HepG2细胞的凋亡率明显增加,而HL-7702细胞并无显著变化. 此外,在正常肝细胞和肝癌细胞暴露于高剂量金属有机骨架化合物后,HL-7702细胞凋亡率较HepG2细胞更明显[32]. 因此,在外部胁迫下正常肝细胞和肝癌细胞毒性响应存在差异. 在其他生物体内,重金属Cd也可引起肝脏凋亡的现象. Habeebu等[30]研究表明,Cd暴露组的小鼠肝脏凋亡指数增至对照组的30倍. 此外,Cd也可诱导斑马鱼ZFL肝脏细胞出现凋亡的现象[33]. 因此,当生物体内摄入Cd后会在肝脏积累,从而可能对组织器官产生毒性效应.
2.3 重金属镉改变肝细胞凋亡相关基因
为了进一步阐述Cd诱导不同肝细胞凋亡的分子机制的差异,利用qRT-PCR技术测定与细胞凋亡相关基因的表达水平.Bcl-2和Bax属于Bcl-2基因家族,其中,Bcl-2是一种原癌基因,可抑制细胞的凋亡,其可调节多种细胞的增殖和凋亡相关基因的表达;而Bax是促凋亡基因,其表达过高将会加速细胞死亡[34-36]. 两种细胞在暴露于不同浓度的Cd后,有关凋亡基因的mRNA表达水平如图4所示. 由图4可见:暴露于1 mg/L的Cd可明显下调HL-7702细胞中Bcl-2的表达水平,但可上调HepG2细胞中Bcl-2的表达水平;而两种细胞在暴露于0.25和1 mg/L的Cd后,Bax的表达均无显著性变化. 此外,细胞凋亡现象的发生也可通过Bcl-2/Bax(表达水平的比值)的降低进行表征[37],暴露于1 mg/L的Cd可显著降低HL-7702细胞中Bcl-2/Bax值(降至0.54±0.14),而Cd对HepG2细胞中Bcl-2/Bax值无显著影响. 因此,Cd暴露仅诱导人正常肝细胞中Bcl-2家族相关基因的表达,而对肝癌细胞无显著影响.Caspase-3作为效应凋亡蛋白酶,在线粒体凋亡途径中起至关重要的作用,其过量表达将会介导细胞凋亡[38-39]. HL-7702细胞暴露于1 mg/L的Cd后,Caspase-3的表达上调至对照组的2倍〔见图4(a)〕,然而在HepG2细胞中两种不同浓度的Cd均明显诱导Caspase-3表达上调〔见图4(b)〕,该结果与流式细胞仪所测细胞凋亡率的结果较为一致. 综上,Cd可激活细胞凋亡相关信号通路,进而使正常肝细胞和肝癌细胞发生凋亡.
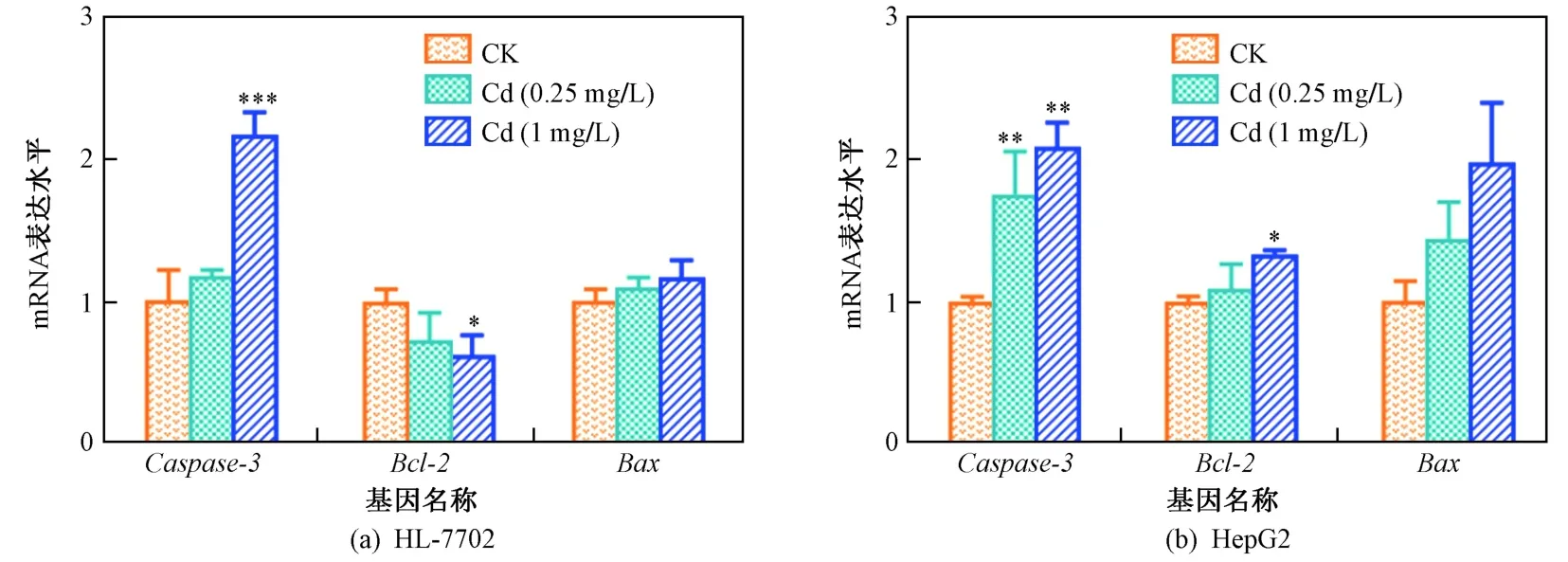
图4 暴露于不同浓度Cd后正常肝细胞(HL-7702)和肝癌细胞(HepG2)凋亡相关基因的mRNA表达水平Fig.4 Cell apoptosis related genes expression in both normal (HL-7702) and cancerous (HepG2)hepatic cells after exposure to cadmium
研究[40]表明,重金属Cd会引起生物体组织/器官凋亡相关基因表达的改变,其中在U-87 MG人星形胶质细胞中,当Cd浓度大于2.2 mg/L时,会诱导下调Bcl-2的表达,上调Bax的表达. 同样,Cd也可降低人支气管细胞16-HBE中Bcl-2的表达[41]. 对于人或水生生物肝细胞,Cd可通过激活Caspase-3等相关信号通路诱导细胞凋亡[42-43]. 笔者研究中正常肝细胞暴露于Cd后,不仅激活了Caspase-3的表达,而且降低了Bcl-2表达;但在肝癌细胞,Cd仅诱导上调Caspase-3的表达. 结果表明,Cd可通过激活正常肝细胞和肝癌细胞中凋亡相关基因的表达,从而导致凋亡. 因此,正常肝细胞和肝癌细胞将通过不同的分子机制来响应Cd暴露对细胞产生的毒性效应.
3 结论
a) 不同浓度的Cd对正常肝细胞(HL-7702)和肝癌细胞(HepG2)活力的影响存在差异,HL-7702细胞对Cd的半数致死浓度(LC50)为1.9 mg/L,HepG2细胞为2.4 mg/L,正常肝细胞对Cd毒性更为敏感.
b) 当Cd浓度为0.25 mg/L时,仅诱导HepG2细胞发生凋亡;而Cd达1 mg/L时,HL-7702和HepG2细胞的凋亡率均明显升高. 因此,在Cd暴露后,正常肝细胞抗凋亡能力要显著高于肝癌细胞,而利用肝癌细胞将会高估Cd对人体肝脏的健康风险.
c) 在HL-7702细胞中,Cd通过激活Caspase-3和降低Bcl-2的表达使细胞产生凋亡;在HepG2细胞中,Cd仅激活Caspase-3的表达. 综上,Cd可通过改变不同凋亡基因的表达促使正常肝细胞和肝癌细胞凋亡.
