漓江流域桂林市区段有机磷农药和磺胺类抗生素的复合污染及其生态风险
2022-01-25刘洁雪覃礼堂莫凌云梁延鹏曾鸿鹄袁星义
刘洁雪,梁 萧,覃礼堂,2*,莫凌云,3,,梁延鹏,3,曾鸿鹄,2,袁星义
1. 桂林理工大学环境科学与工程学院, 广西环境污染控制理论与技术重点实验室, 广西 桂林 541004
2. 桂林理工大学, 广西环境污染控制理论与技术重点实验室科教结合科技创新基地, 广西 桂林 541004
3. 桂林理工大学, 岩溶地区水污染控制与用水安全保障协同创新中心, 广西 桂林 541004
4. 自然资源部南方石山地区矿山地质环境修复工程技术创新中心, 广西 南宁 530022
有机磷农药(organophosphorus pesticides,OPs)是一种含磷元素的有机化合物农药,是我国目前生产和使用量最大的一类农药[1]. 在其生产和使用过程中,残留的农药会随着雨水、地表径流渗入地下水体,对环境水体造成污染,危害人类健康[2]. 磺胺类药物(sulfonamide antibiotics,SAs)是以对氨基苯磺酰胺为基本化学结构的一类合成抗菌药物,其种类繁多,用于预防和治疗细菌感染性疾病,是重要的人兽共用药物[3-4]. 大多磺胺类药物以原药或代谢产物(氧化产物、共轭态、水解产物等)形式随粪便和尿液等排泄物排入水体等环境中. 由于其持续性进入水体,已对水环境造成污染[5-6].
漓江流域属于典型喀斯特地区,近年来随着城市化进程、农业现代化和旅游业的快速发展,漓江流域生态环境压力倍增,维持区域较低的生态风险水平对流域可持续发展至关重要[7-8]. 自21世纪以来,漓江水质变差、枯水期变长且水面萎缩,两岸自然景观退化. 高振刚等[9]在桂林市漓江流域的会仙岩溶湿地水体中共检出14种OPs,总浓度范围在nd(未检出)~182.590 ng/L之间,平均值为7.932 ng/L. Qin等[10]在会仙岩溶湿地水体中共检出10种SAs,检出目标物质的平均浓度总和在时间上呈现出枯水期>平水期>丰水期,各物质平均浓度之和分别在14.13~62.57、4.49~123.43、8.03~61.50 ng/L. 在我国多个流域检出磺胺嘧啶和磺胺甲恶唑[11-14],珠江流域检出浓度分别为nd~20.30和9.40~845.0 ng/L,海河流域检出浓度分别为4.90~53.60 和2.18~259.60 ng/L[15]. 在珠江和海河流域也检出敌敌畏、内吸磷、乐果、甲基对硫磷和马拉硫磷[16],在珠江的检出浓度分别为nd~24.0、nd~124.0、nd~28.8、nd~3.1和nd~216.0 ng/L,在海河的检出浓度分别是10~50、nd~50、nd~220、nd~160、10~130 ng/L[17]. OPs和SAs在我国各流域中被广泛报道,但在漓江这些污染物的污染特征和生物效应缺乏报道,且环境浓度下OPs和SAs多以混合污染物存在[18],联合效应是否发生协同或拮抗作用仍不清晰.
在生态风险评估中,需要分析测量确定目标污染物的检测环境浓度(MEC),或通过计算获得预测环境浓度(PEC). MEC或PEC是生态风险评估的必要数据,其数值影响评价结果. 此外,污染物的生态毒理学数据对评估结果产生重要影响,其数据的准确性和可靠性在生态风险评估中起着关键作用. 在许多生态风险评估研究中,通常从文献或数据库中收集原始生态毒理学数据,如半数效应浓度(EC50)、半数致死浓度(LC50)、无观测效应浓度(NOEC)、5%有害浓度(HC5),以确定特定污染物的预测无效应浓度(PNEC). 已有研究[19]发现,每个污染物的生态毒性数据不同,部分原因是其使用了各种不同的端点、测试时间和物种.即使相同的物种和相同的测试终点,推导的PNEC数值也存在较大差异. 这些问题意味着,如果数据不恰当(如使用了错误的端点或试验动物、试验技术不够严格),或使用不同来源的原始生态毒性数据会导致不同的PNEC值,即使用相同的MEC或PEC计算,最终也会得出不同的风险水平. 此外,由于特定混合物的毒性试验数据缺乏,现有混合物生态风险评估大多采用单一物质的风险进行相加,这有可能低估或高估实际混合物的风险. 因此,需要开展OPs和SAs混合物的毒性测试及其生态风险评估.
该研究评估环境浓度下OPs和SAs混合物对初级生产者蛋白核小球藻的联合毒性,并比较基于单一污染物风险熵与基于混合物风险熵对生态风险评估的影响. 以漓江流域桂林市区段中多种OPs和SAs为例,计算OPs和SAs不同来源的PNEC数值,利用风险熵值(RQ)[20]进行生态风险评估,研究不同PNEC值下对应的生态风险评估结果.
1 材料与方法
1.1 标准品与试剂
16种OPs (甲胺磷、乙酰甲胺磷、氧乐果、敌敌畏、久效磷、乐果、灭线磷、敌百虫、对硫磷、辛硫磷、水胺硫磷、三唑磷、氯唑磷、杀扑磷、马拉硫磷和毒死蜱)和9种SAs (磺胺嘧啶、磺胺吡啶、磺胺甲基嘧啶、磺胺二甲嘧啶、磺胺甲氧哒嗪、磺胺甲恶唑、磺胺氯哒嗪、甲氧苄啶、磺胺喹啉)均购于德国Dr. Ehrenstorfer GmbH公司,纯度均大于95%;甲醇、乙酸、乙腈均购于德国Merck公司;丙酮、乙酸乙酯、二氯甲烷均购于美国FISHER公司;乙酸铵购于阿拉丁;蛋白核小球藻购自中国武汉水生生物研究所淡水藻种库(FACHB),编号FACHB-5.
1.2 研究区域和采样
以漓江流域桂林市区段的OPs和SAs为研究对象,分别于2019年10月(平水期)、2020年3月(枯水期)、2020年7月(丰水期)进行水样采集,采样点分布见图1,共10个采样点(S1~S10). 采样区域从北面的南洲大桥至南面的相思江流域,途径东镇、解放桥、漓江桥、净瓶山大桥和上窑,干流水从东镇分支流至小东江,最后于净瓶山大桥处与干流水汇合,桃花江支流从漓江桥处注入主干流,另一条经奇峰河与主干流汇合. 采样过程严格遵循HJ 495-2009《水质采样方案设计技术规定》. 每个采样点采集3个平行水样,每个水样采集2 L置于棕色玻璃瓶中,现场加入10 mL甲醇助溶,用稀盐酸调节pH在3~5之间,于4 ℃冰箱中避光保存,采样结束后立即运回实验室,48 h内完成前处理.
1.3 样品前处理
1.3.1 有机磷农药前处理
取500 mL经0.45 μm滤膜过滤后水样,调节pH至3~5. 固相萃取采用活性炭柱-高效液相色谱柱串联,上样前依次用10 mL丙酮-二氯甲烷(体积比为8∶2)、10 mL甲醇和10 mL超纯水活化萃取小柱,水样再以3 mL/min流速过柱,上样结束后用10 mL超纯水淋洗萃取柱,在氮气下干燥40 min,然后将两柱分开,用12 mL丙酮-二氯甲烷(体积比为8∶2)洗脱HLB柱,12 mL甲醇(含5 mmol/L乙酸铵)洗脱活性炭柱,最后将两种洗脱液混合,在氮气下吹至近干,最后用甲醇与0.1%甲酸水(体积比为75∶25)定容至1 mL,过0.22 μm滤膜后,置于棕色进样瓶中,待上机测定.
1.3.2 磺胺类抗生素前处理
取500 mL经0.45 μm滤膜过滤后水样,调节pH至6. 固相萃取采用HLB柱,上样前依次用5 mL乙酸乙酯-甲醇(体积比为1∶1)、5 mL氨水-甲醇(体积比为3∶100)溶液,5 mL超纯水活化萃取柱,水样再以3 mL/min流速过柱,上样结束后以6 mL的超纯水淋洗萃取柱,在氮气下干燥20 min,再依次用5.5 mL乙酸乙酯-甲醇(体积比为1∶1)、5 mL氨水-甲醇(体积比为3∶100)溶液进行洗脱,在氮气下吹至近干,最后用30%甲醇溶液定容至1 mL,过0. 22 μm滤膜后,置于棕色进样瓶中,待上机测定.
1.4 污染物测定方法
OPs和SAs抗生素均采用超高效液相色谱三重四级杆质谱联用仪(UPLC-MS/MS)测定[21]. 色谱条件: 色谱柱采用ACQUIT BEH C18柱(2.1 mm×100 mm,1.7 μm);进样量2 μL,流速0.3 mL/min,柱温40 ℃. 流动相A为0.1%甲酸水溶液,流动相B为甲醇,其中OPs洗脱梯度程序如下:0~2 min,20%流动相B;2~4.5 min,20%~86%流动相B;4.5~8 min,86%~90%流动相B;8~9 min,90%~20%流动相B;9~11 min,20%流动相B. SAs洗脱程序如下:0~1 min,10%~12%流动相B;1~7 min,12%~50%流动相B;7~10 min,50%~70%流动相B;10~10.1 min,70%~10%流动相B,10.1~12 min,10%流动相B. 质谱条件:采用正离子扫描(ESI+),多反应监测模式(MRM);离子源温度150 ℃;脱溶剂温度600 ℃;脱溶剂流速1 000 L/h,其中OPs毛细管电压为0.5 kV,SAs毛细管电压为2.94 kV.
1.5 毒性测定及数据拟合
蛋白核小球藻购自中国武汉水生生物研究所淡水藻种库(FACHB),编号为FACHB-5. 该藻采用BG11培养基[22]放入恒温光照培养箱中,于22 ℃、照度3 000 lx和光暗比12 h∶12 h条件下培养[23]. 先取5 mL藻种液于250 mL锥形瓶中于弱光下培养2~3 d,再传代培养20~30 d后,可用于毒性试验. 采用藻类微板毒性分析法进行污染物毒性测试[24],具体步骤如图2所示. 以透明96孔微孔板作为载体,在微孔板四周一共36个孔中加入300 μL超纯水,以防止产生边缘效应;剩下60个孔的第2、6、7和11列一共24个孔中分别是空白对照组,空白对照组加入与试验组相同含量的助溶剂(DMSO)(难溶解的化合物,用对蛋白核小球藻毒性小的体积浓度不超过5‰的DMSO溶解);第3列以及第8列的6个孔分别加入按确定好的稀释因子设计的12个不同浓度的目标污染物100 μL;第4和5列为第3列的平行试验,第9和10列为第8列的平行试验,然后在除四周外的60个孔中均加入100 μL已稀释好的藻液,使各孔的试液总体积为200 μL;每个浓度至少重复3块板,盖上透明盖板密封,静置15 min,将板置于多功能酶标仪中测定光密度值(OD),暴露时间为0 h;然后将测定后的板置于光照培养箱中培养,培养温度为22 ℃,光照度2 000~3 000 lx,光暗周期12 h∶12 h;每天定时将微板交叉调换位置2~4次,使之光照均匀,待达96 h时再次测定其OD值,并由此计算对应时间点的目标化合物对蛋白核小球藻的生长抑制率(I),计算公式:
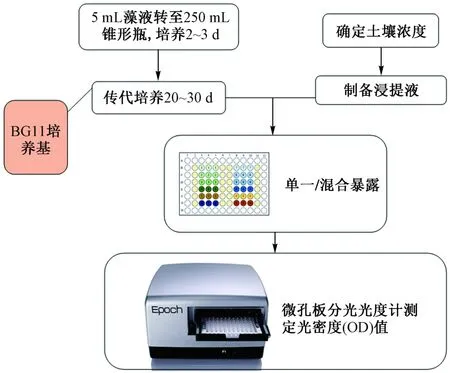
图2 毒性试验主要步骤Fig.2 The main steps of toxicity experiment
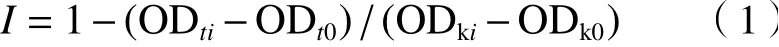
式中,I为污染物对蛋白核小球藻的生长抑制率,%;ODti为i时刻污染物试验组t的藻液OD值,ODki为i时刻空白对照组k的藻液OD值(i=0,1,2,···,96).采用的两参数非线性函数Weibull〔见式(2)〕和Logit〔见式(3)〕对浓度-抑制率数据进行非线性最小二乘拟合,选择确定系数(R2)最大或均方根误差(RMSE)最小者为最优拟合函数[25].
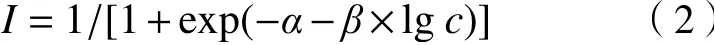
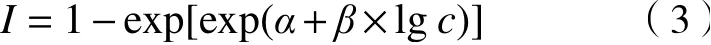
式中:α、β分别为Weibull和Logit的位置与斜率;c为单个污染物或混合物的浓度,mol/L.
1.6 混合物毒性评估
为了更加客观准确地分析混合物毒性相互作用,同时采用了参考模型:浓度加和(CA)〔见式(4)〕和独立作用(IA)〔见式(5)〕评估混合毒性[26]. 如果混合物毒性偏离了参考模型CA或IA的预测结果,则认为混合物发生了毒性相互作用(协同或拮抗作用)[27].
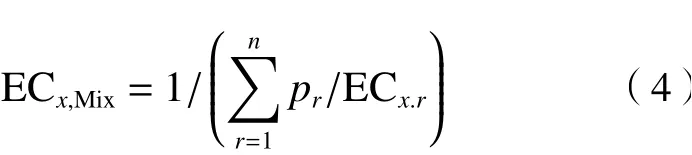
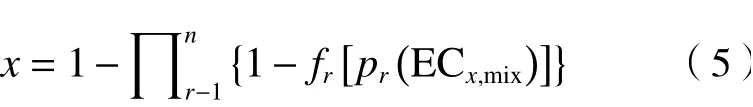
式中:ECx,Mix为混合物产生x%效应时对应的效应浓度,mol/L;ECx,r为第r组分单独存在时产生x%效应时对应的效应浓度,mol/L;pr为第r个组分的摩尔浓度比;x为混合物效应,%;fr为第r个组分的浓度-效应曲线(CRC)最佳拟合函数.
为了定量评估混合物的毒性相互作用,利用模型偏移率(MDR)〔见式(6)〕进行定量评估,MDR置信区间上限(MDRUpper)和下限(MDRLower)的计算见式(7)(8).
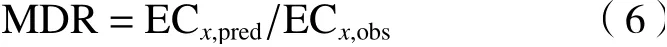
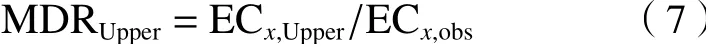
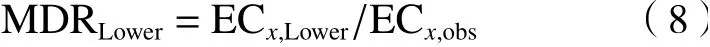
式中:ECx,pred为某指定效应下参考模型CA或IA预测的效应浓度,mol/L;ECx,obs为指定效应下开展的试验浓度,mol/L;ECx,Upper与ECx,Lower分别为试验浓度的上限和下限,mol/L. 在混合物指定效应下,MDRLower<MDR< MDRUpper为加和作用;MDR< MDRLower为拮抗作用;MDR> MDRUpper为协同作用.
1.7 生态风险评估
利用混合物风险商对研究区域内的混合污染物进行生态风险评估,计算公式[28]如下:
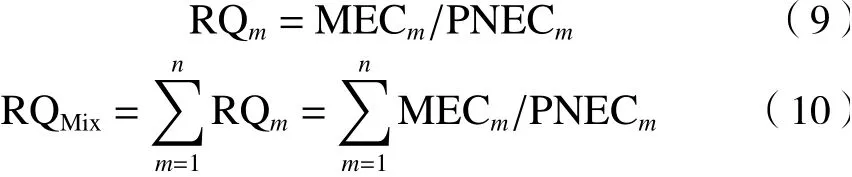
式中:PNECm为预测无效应浓度,ng/L;MECm为环境检测浓度,ng/L;RQm为单一物质风险熵值;RQMix为混合物风险熵值,即单一污染物风险熵之和. 当RQMix> 1时,污染物可能造成高风险,当0.1 <RQMix< 1时,判断为污染物可能造成中风险;当0.01 <RQMix< 0.1时,污染物可能造成低风险;当RQMix< 0.01时,污染物无风险[29].
为比较不同PNEC对风险评估结果的影响,PNEC通过如下方式计算得出:①利用文献中收集的单一物质EC50值除以风险因子经验值(AF,该研究取1 000[20]);②通过蛋白核小球藻测试单一物质及其混合物的毒性,获取EC50值后除以AF;③通过蛋白核小球藻单一污染物物质及其混合物的毒性,计算无观测效应浓度NOEC,以该数值作为PNEC. 通过不同的PNEC数值得出不同的RQ值,比较不同方法下目标污染物的生态风险.
2 结果与讨论
2.1 OPs和SAs在漓江流域桂林市区段随时间的分布规律
以16种OPs和9种SAs为目标污染物,在漓江流域桂林市区段共检出2种OPs〔敌百虫(TRC)、毒死蜱(CHP)〕和3种SAs〔磺胺甲基嘧啶(SMR)、磺胺二甲嘧啶(SM2)、磺胺甲恶唑(SMZ)〕. 研究区内不同时期SAs和OPs残留浓度如图3所示. 不同时期下SAs和OPs残留浓度具有明显差异,SAs浓度呈丰水期>平水期>枯水期的特征,这与孙凯[30]对洪泽湖的研究相似. 而OPs则与总体表现相反,枯水期>平水期>丰水期. SAs的丰水期浓度较高可能是由于夏季处于鱼苗和牲畜快速生长期,SAs使用量较大,夏季强降雨将漓江周边SAs随地表径流及各支流汇集到漓江干流中,同时原来吸附于沉积物中的SAs,也由于急流的扰动被重新释放到上层水中[31]. 在枯水期和平水期降雨稀少,地表难以形成有效径流,漓江各支流水量锐减甚至部分支流断流,使得SAs来源途径减少,使得平水期和枯水期残留浓度低于丰水期. 对于OPs,枯水期多为病虫害多发季节,而漓江沿岸农业活动使得OPs在该季节使用量增加,最终导致OPs在枯水期的残留浓度高于丰水期和平水期.
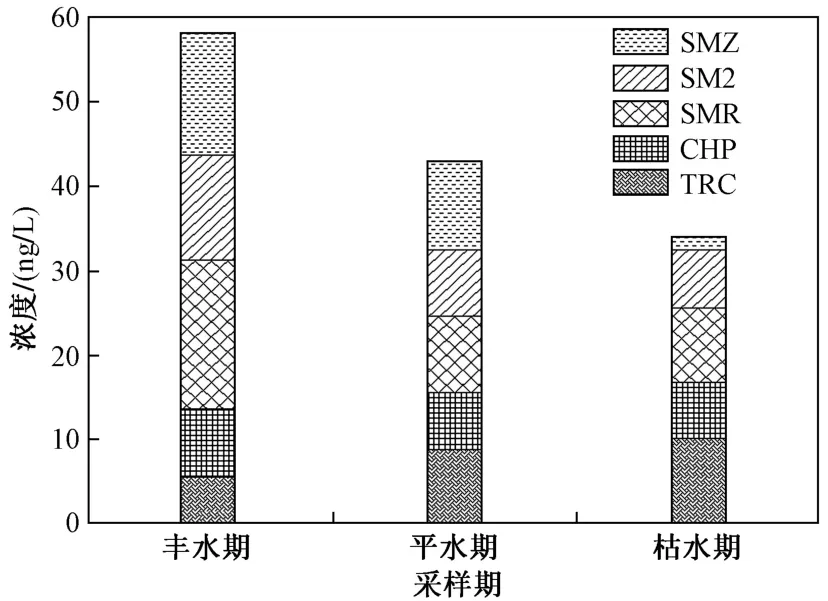
图3 研究区河流中各组分OPs和SAs在不同时期的检出浓度Fig.3 The detected concentrations of each OPs and SAs in the rivers of the study area at different periods
2.2 OPs和SAs在漓江流域桂林市区段的空间分布规律
OPs和SAs在不同采样点的浓度水平见图4. 由图4可知,SMR在S1采样点(南洲大桥)和TRC在S2采样点(东镇)的浓度显著高于其他地方,其主要原因可能是该采样点分布的农业活动,SMR和TRC使用量较大,最终随地表径流汇入漓江流域;在S10采样点(相思江)中,SAs和OPs浓度总体较高,由于该采样点的河流与会仙湿地水体相连接,而会仙湿地水体中检测出高浓度的SAs和OPs[9-10],从而导致该采样点的SAs和OPs浓度水平较高.
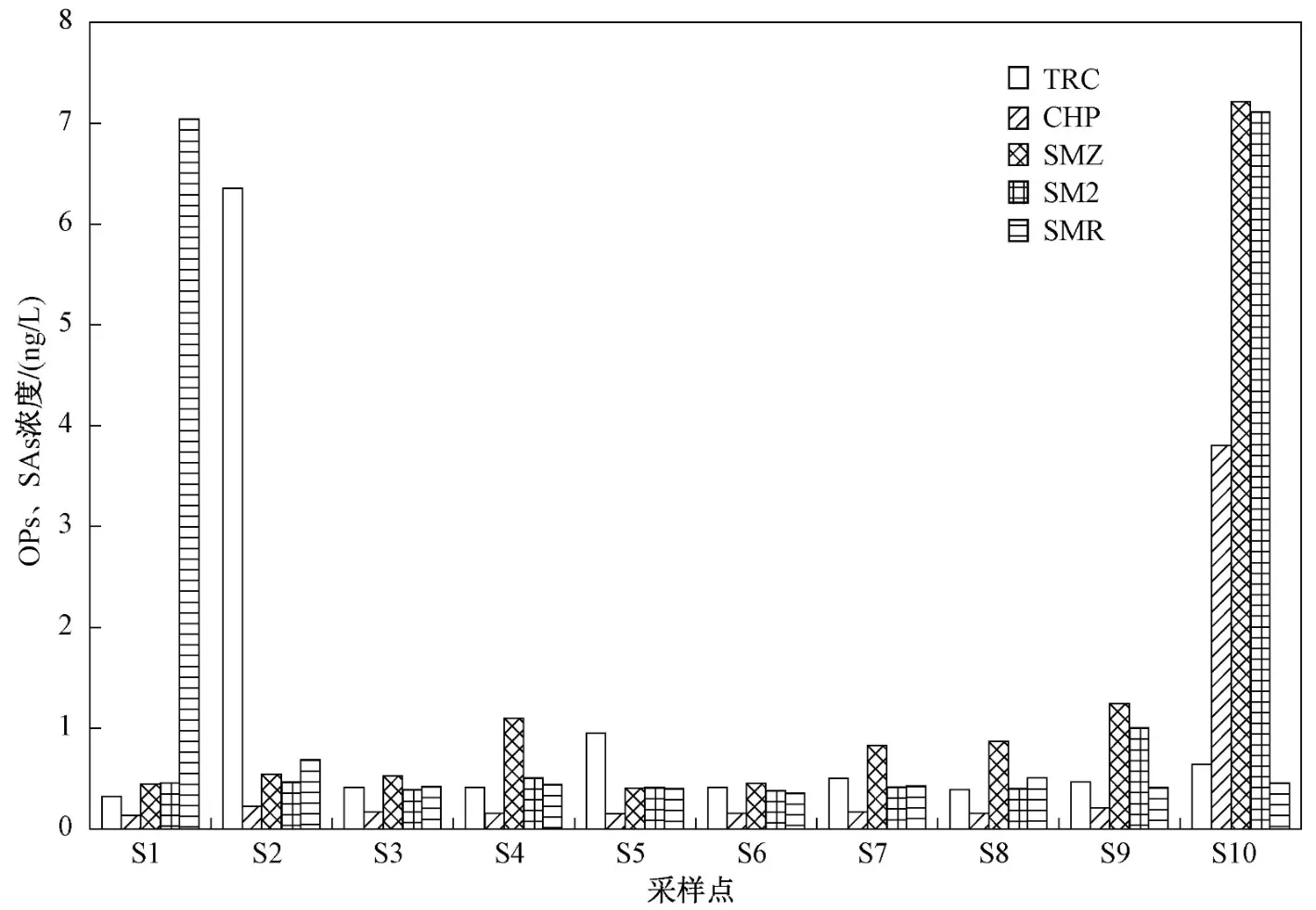
图4 漓江流域桂林市区段5种污染物残留浓度Fig.4 Residual concentrations of 5 pollutants in Guilin section of Lijiang River Basin
2.3 OPs和SAs在漓江流域桂林市区段的残留特征
漓江流域桂林市区段中OPs和SAs的浓度水平见表1. OPs浓度检出范围为nd~27.34 ng/L,平均值为7.78 ng/L. SAs浓度检出范围为0.99~53.45 ng/L,平均值为18.24 ng/L. 3种SAs检出率均为100 %,最大检出浓度为20.6 ng/L (SMR),2种OPs检出率分别为55.70 %和47.56 %,最大检出浓度为17.20 ng/L (TRC).SAs和OPs被检出可能由于漓江干流周围遍布大量居民区、农业种植区以及养殖业等,使得SAs随生活污水、养殖废水和农田径流等多种形式进入漓江.
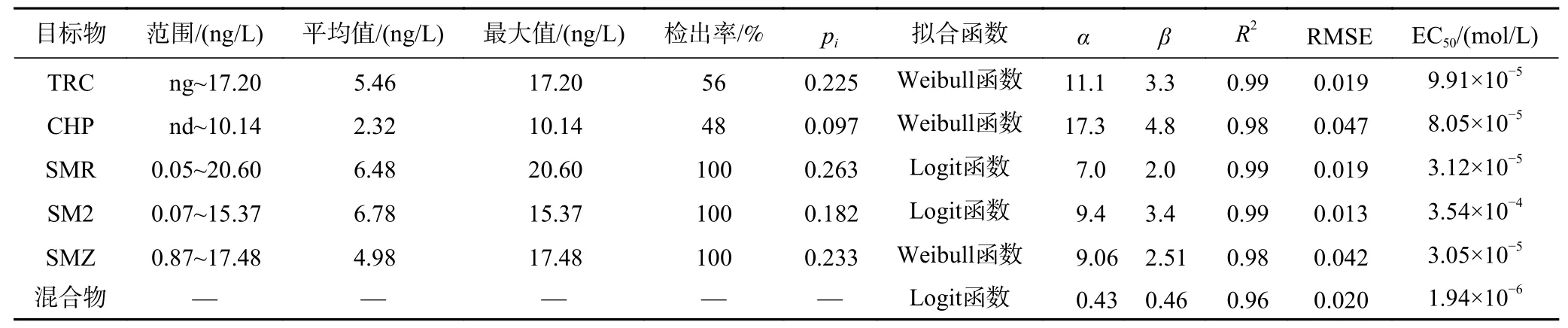
表1 漓江流域桂林市区段中OPs和SAs的浓度水平及检出率和浓度-效应曲线的拟合参数Table 1 The concentration levels, detection rates and fitting parameters of OPs and SAs in Guilin section of Lijiang River Basin
2.4 单一污染物及其混合物对蛋白核小球藻的毒性效应
使用Weibull、Logit函数拟合5种OPs和SAs对蛋白核小球藻96 h的浓度-效应数据,参数(回归参数α和β值,统计参数R2和RMSE)见表1,所有R2值均大于0.95、RMSE值均小于0.07,表明拟合质量的可靠性较高. 5种污染物的浓度-效应拟合曲线(CRC)如 图5所示. 以EC50作为毒性指标,EC50的数值越大,毒性越大[32],则5种有机磷农药和磺胺类抗生素对蛋白核小球藻的毒性表现为SM2>TRC>SMR>SMZ>CHP.
在生态风险评估中,为了估计最坏的情况,常以污染物的最大检测浓度计算. 为此,该研究将漓江流域桂林市区段的5种污染物最大浓度作为混合物固定浓度配比,依照此浓度比例配制混合物母液,设计从低浓度至高浓度共12个浓度点(12个浓度点的混合物组分比例不变),以藻类微板毒性分析法测试该混合物对蛋白核小球藻的96 h毒性. 混合物对蛋白核小球藻的CRC及其CA、IA预测关系见图5,因CA与IA模型的预测曲线接近,利用IA模型计算的混合物在1%~26%效应(试验测得最大抑制效应为26 %)范围的MDR数值,定量评估混合物的毒性相互作用大小,结果如图6所示.
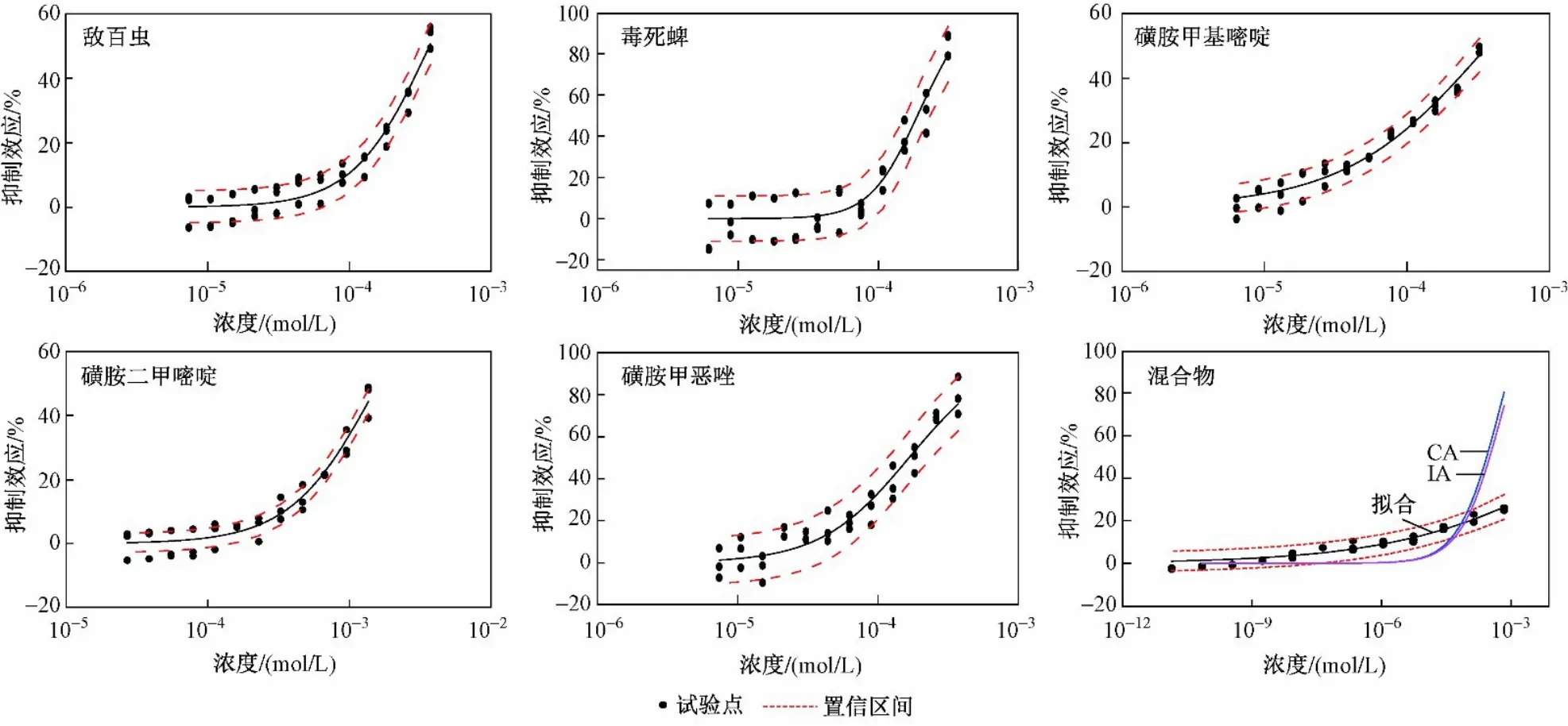
图5 5种污染物及污染物CRC曲线Fig.5 CRC curves of 5 pollutants andmixture
由图6可知,低于5 %效应(4.62×10-8mol/L)下,MDR值处于置信区间内,即呈现出加和作用. OPs和SAs在环境最高混合浓度下(2.97×10-10mol/L),对蛋白核小球藻产生的效应为1.88 %,在该环境浓度下混合物的联合作用表现为加和作用. 协同作用发生在5%~19% (8.19×10-5mol/L)之间,随着混合浓度和效应值增加,协同作用增大,协同作用最大发生在18%效应(5.87×10-5mol/L)下,MDR值为0.57(MDRUpper=1.21,MDRLower=0.68);在19%~21%(1.53×10-4mol/L)效应范围混合物呈现加和效应. 当效应值为21%~26%(6.19×10-4mol/L)时,MDR值处于置信区间上方,即呈现拮抗作用,且随着混合浓度和效应值增加,拮抗作用逐渐增大. 因此,OPs和SAs五元混合物的联合毒性在1%~26%效应范围(浓度范围为1.19×10-11~6.19×10-4mol/L)内呈现加和效应、协同作用和拮抗作用,且在效应范围内呈现低效应加和、高效应拮抗作用,在混合物的环境浓度下对蛋白核小球藻产生加和效应. 曾莎莎等[33]研究表明OPs混合污染物对蛋白核小球藻呈现加和作用的原因是混合物毒性并没有明显的组分浓度比依赖性. 王滔等[34]在研究三嗪类农药复合污染物对蛋白核小球藻的联合毒性时,混合物的毒性相互作用整体上呈从加和作用向协同作用转变,与该研究结果大致相同.
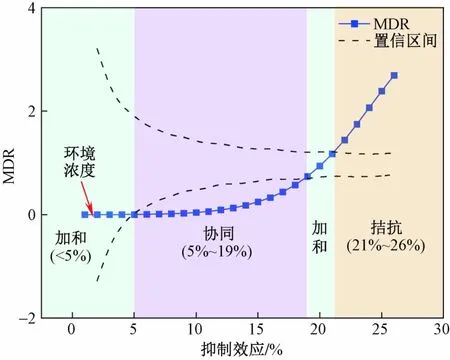
图6 基于IA模型的混合物MDR值Fig.6 Mixture MDR values based on IA model
2.5 生态风险评估
该研究从相关文献[10,35]中获得单一物质对藻类的96 h毒性数据,通过试验得到5种污染物对蛋白核小球藻的毒性数据. 评估单一污染物时,通过文献EC50、该试验EC50和该试验NOEC共3种方法确定污染物PNEC,进而计算单一污染物风险熵值,以目标污染物检出浓度平均值和最高值作为MEC进行评估,结果如图7所示. 利用试验单一污染物NOEC值代替PNEC值确定的RQ值过小,图7显示了前2种方法得出的RQ值. 在平均检出浓度和最高检出浓度下,单一目标污染物通过3种方式计算得到的结果RQ值具有明显差别,但对蛋白核小球藻均表现为无风险. 在最高浓度下评估混合物风险,通过文献EC50、该试验EC50和该试验NOEC三种方式计算得到的混合风险熵值分别为0.006 3、0.006 0和0.000 02,即从单一物质的PNEC计算混合物风险值均小于0.01,对蛋白核小球藻无生态风险. 利用混合物毒性试验的EC50和NOEC进行评估时,混合风险熵值分别为0.153和0.845,均处于中风险. 因此,利用单一污染物对混合污染物进行评估,低估了混合污染物实际风险,通过混合物毒性试验可以更加准确地确定混合物污染风险.

图7 不同方式计算的RQ值Fig.7 The RQ values with different methods
不同采样点在丰水期、平水期和枯水期分别使用不同PNEC计算混合风险熵值,风险熵值计算方法依次是:获得文献中EC50计算、试验单一目标物EC50计算、试验单一目标物NOEC代替、试验目标混合物EC50计算、试验目标混合物NOEC计算. 使用前3种计算方法时,所有采样点在3个水期均呈现无风险;使用文献中EC50和试验单一目标物计算的PNEC得出的RQ值相差不超过10倍;通过试验中单一NOEC代替PNEC计算得出的RQ值远小于前两种方法计算得出的RQ值,其中在S1采样点(南洲大桥)试验中单一目标物NOEC计算RQ值与文献中EC50计算PNEC得到的RQ值相差197倍,其余全部相差200倍以上;利用试验中混合物EC50计算风险熵值时,S10采样点在3个水期出现低风险状态,其余均为无风险〔见图8(a)〕;利用试验中混合物NOEC计算风险熵值时,S10采样点在所有水期呈现中风险,在丰水期、平水期、枯水期的风险熵值分别为0.182、0.228和0.183,S2采样点在丰水期和枯水期分别呈现中风险和无风险,其余均处于低风险〔见图8(b)〕. 在所有风险熵值计算法中,S10采样点风险熵值皆相对其他地点较大,原因是S10采样点与会仙湿地相连接,而Qin等[10,35]已在会仙湿地中检出高浓度OPs和SAs. 因此,不同PNEC计算方式导致的生态风险评估存在模型差异. 通过试验获得混合物NOEC值,该数值为混合物真实的PNEC,基于整体混合物NOEC计算混合风险熵值为最准确的评估方法.
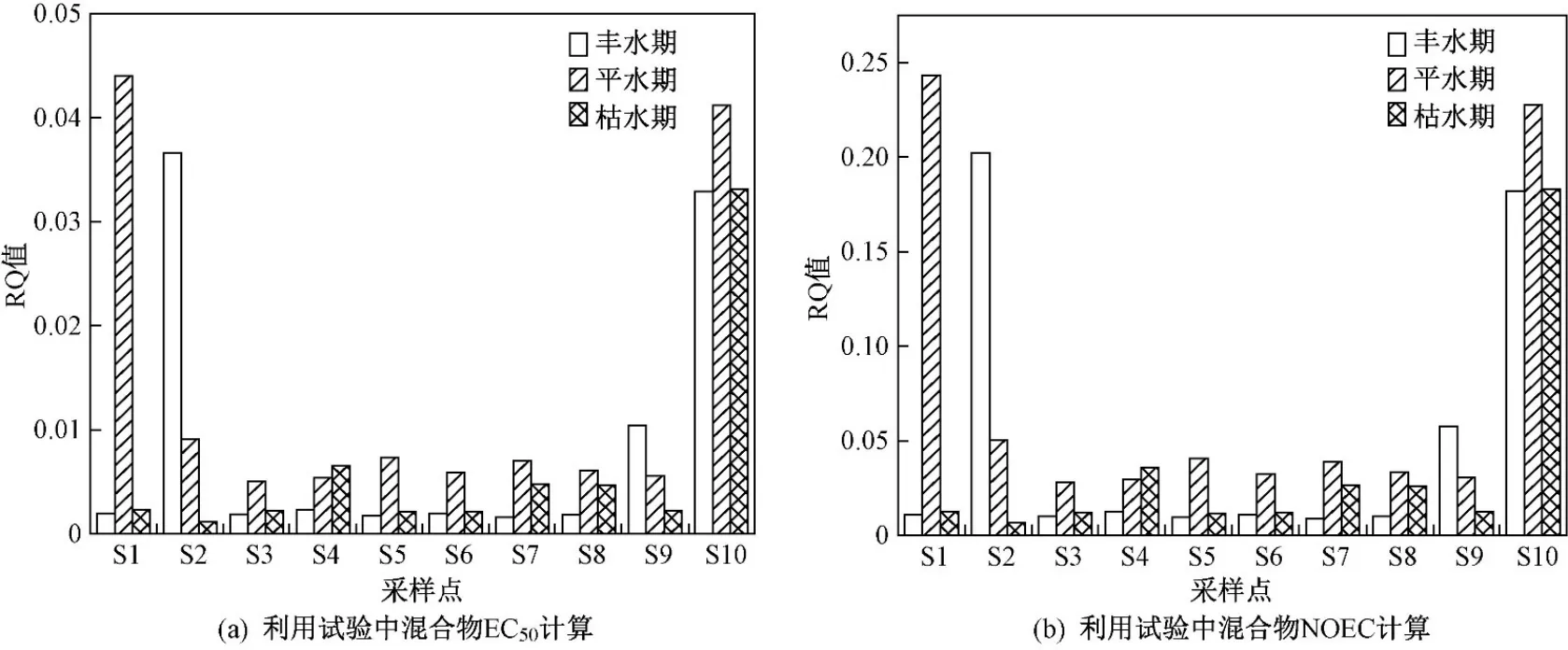
图8 不同时期通过不同方法计算各采样点RQ值Fig.8 RQ values of each sampling site calculated by different methods in different periods
3 结论
a)在漓江流域桂林市区段共检测出2种OPs〔敌百虫(TRC)、毒死蜱(CHP)〕和3种SAs〔磺胺甲基嘧啶(SMR)、磺胺二甲嘧啶(SM2)、磺胺甲恶唑(SMZ)〕,其中,OPs检出浓度为nd~27.34 ng/L,平均值为7.78 ng/L,TRC和CHP检出率分别为55.70%、47.56%;SAs检出浓度为0.99~53.45 ng/L,平均值为18.24 ng/L,且检出率均高达100%.
b)SAs和OPs残留量随时间呈规律性变化. SAs表现为丰水期>平水期>枯水期,OPs表现为枯水期>平水期>丰水期;两类污染物在空间分布上无明显规律,在S10采样点(相思江)中,SAs和OPs含量总体较高.
c)OPs和SAs五元混合物的联合毒性对蛋白核小球藻在1%~26 %效应范围(浓度范围为1.19×10-11~6.19×10-4mol/L)内呈现加和效应、协同作用和拮抗作用,在该效应范围内呈现低效应加和、高效应拮抗作用,且混合物在环境最高浓度下对蛋白核小球藻产生加和效应.
d)利用单一污染物对混合污染物进行评估,低估了混合污染物实际风险. 利用试验混合物NOEC计算混合风险熵值,评估结果更准确且最保守. 在漓江流域桂林市区段中,通过试验混合物NOEC计算混合风险熵值,对各污染物最高浓度进行评估时,最大风险熵值为0.845,呈现中风险.
参考文献(References):
[1] 熊大伟, 吴恩凯, 李桂晓.液液萃取-气相色谱质谱法测定环境水体中有机磷农药[J].环境与发展,2020,32(5):113,115.
XIONG D W, WU E K, LI G X.Determination of organophosphorus pesticides in environmental water by liquidliquid extraction-gas chromatography-mass spectrometry[J].Environment and Development,2020,32(5):113,115.
[2] 陈建义, 谢林伸, 朱婷婷, 等.三类水体中7种有机磷农药国标测试方法的整合优化[J].环境卫生学杂志,2020,10(6):597-601.
CHEN J Y, XIE L S, ZHU T T, et al.Consolidation of the national standard examination methods for determination of 7 organophosphorus pesticides in three kinds of water samples[J].Journal of Environmental Hygiene,2020,10(6):597-601.
[3] 张琳, 胡潇涵. 环境水体中磺胺类抗生素分析方法的建立与应用[J]. 新疆环境保护, 2019, 41(2): 11-16.
ZHANG L,HU X H. Establishment and application of analysis method for sulfonamide antibiotics in environmental waters[J].Environmental Protection of Xinjiang,2019,41(2):11-16.
[4] 胡双庆,张玉,沈根祥.抗生素磺胺嘧啶和磺胺甲恶唑在土壤中的淋溶行为研究[J].环境科学研究,2021.doi: 10.13198/j.issn.1001-6929.2021.08.18.
HU S Q,ZHANG Y,SHEN G X.Leaching behavior of antibiotics sulfadiazine and sulfamethoxazole in soil[J].Research of Environmental Sciences, 2021.doi:10.13198/j.issn.1001-6929.2021.08.18.
[5]XU L Y,ZHANG H,XIONG P,et al.Occurrence,fate,and risk assessment of typical tetracycline antibiotics in the aquatic environment: a review[J].The Science of the Total Environment,2021,753:141975.
[6]BIAŁK-BIELIŃSKA A,STOLTE S,ARNING J,et al.Ecotoxicity evaluation of selected sulfonamides[J].Chemosphere, 2011,85(6):928-933.
[7] 符志友,张衍燊,冯承莲,等.我国水环境风险管理进展、挑战与战略对策研究[J].环境科学研究,2021,34(7):1532-1541.
FU Z Y,ZHANG Y S,FENG C L,et al.Research on the problems and strategic countermeasures to promote Chinese pollution risk management of water environment[J].Research of Environmental Sciences,2021,34(7):1532-1541.
[8] 黄宏伟, 肖河, 王敦球, 等.漓江流域水体中重金属污染特征及健康风险评价[J].环境科学,2021,42(4):1714-1723.
HUANG H W, XIAO H, WANG D Q, et al.Pollution characteristics and health risk assessment of heavy metals in the water of Lijiang River Basin[J].Environmental Science,2021,42(4):1714-1723.
[9] 高振刚, 曾莎莎, 曾鸿鹄, 等.固相萃取-超高效液相色谱-串联质谱法测定水中16种有机磷农药残留[J].分析科学学报,2021,37(1):22-28.
GAO Z G, ZENG S S, ZENG H H, et al.Detection of 16 organophosphorus pesticides in water by solid phase extractionultra-high performance liquid chromatography-tandem mass spectrometry[J].Journal of Analytical Science,2021,37(1):22-28.
[10]QIN L T, PANG X R, ZENG H H, et al.Ecological and human health risk of sulfonamides in surface water and groundwater of Huixian Karst Wetland in Guilin, China[J].Science of the Total Environment,2020,708:134552.
[11]ZHOU L J, YING G G, ZHAO J L, et al.Trends in the occurrence of human and veterinary antibiotics in the sediments of the Yellow River, Hai River and Liao River in northern China[J].Environmental Pollution,2011,159(7):1877-1885.
[12]SHI H, YANG Y, LIU M, et al.Occurrence and distribution of antibiotics in the surface sediments of the Yangtze Estuary and nearby coastal areas[J].Marine Pollution Bulletin,2014,83(1):317-323.
[13]YAN C X, YANG Y, ZHOU J L, et al.Antibiotics in the surface water of the Yangtze Estuary: occurrence, distribution and risk assessment[J].Environmental Pollution,2013,175:22-29.
[14]LIANG X M, CHEN B W, NIE X P, et al.The distribution and partitioning of common antibiotics in water and sediment of the Pearl River Estuary, South China[J].Chemosphere,2013,92(11):1410-1416.
[15]GAO J J, LIU L H, LIU X R, et al.The occurrence and spatial distribution of organophosphorous pesticides in Chinese surface water[J].Bulletin of Environmental Contamination and Toxicology,2009,82(2):223-229.
[16] 杨璇. 珠江河口水体常见有机磷农药污染现状及风险评价[D].广州: 暨南大学, 2011.
[17] 杨尚乐, 王旭明, 王伟华, 等.松花江哈尔滨段及阿什河抗生素的分布规律与生态风险评估[J].环境科学,2021,42(1):136-146.
YANG S L, WANG X M, WANG W H, et al.Distribution and ecological risk assessment of antibiotics in the Songhua River Basin of the Harbin section and Ashe River[J].Environmental Science,2021,42(1):136-146.
[18]GUSTAVSSON M, KREUGER J, BUNDSCHUH M, et al.Pesticide mixtures in the Swedish streams: environmental risks,contributions of individual compounds and consequences of singlesubstance oriented risk mitigation[J].Science of the Total Environment,2017,598:973-983.
[19]KIM Y, CHOI K, JUNG J, et al.Aquatic toxicity of acetaminophen, carbamazepine, cimetidine, diltiazem and six major sulfonamides, and their potential ecological risks in Korea[J].Environment International,2007,33(3):370-375.
[20]HERNANDO M D, MEZCUA M, FERNÁNDEZ-ALBA A R, et al.Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments[J].Talanta,2006,69(2):334-342.
[21] 高振刚, 梁延鹏, 曾鸿鹄, 等.固相萃取-超高效液相色谱-三重四极杆质谱法测定水中15种抗生素残留[J].分析试验室,2021,40(8):875-880.
GAO Z G, LIANG Y P, ZENG H H, et al.Detection of 15 antibiotics in water by solid phase extraction-ultra-high performance liquid chromatography-triple quadrupole tandem mass spectrometry[J].Chinese Journal of Analysis Laboratory,2021,40(8):875-880.
[22]BHARTE S, DESAI K.The enhanced lipid productivity of Chlorella minutissima and Chlorella pyrenoidosa by carbon coupling nitrogen manipulation for biodiesel production[J].Environmental Science and Pollution Research,2019,26(4):3492-3500.
[23]WANG L J, LIU S S, YUAN J, et al.Remarkable hormesis induced by 1-ethyl-3-methyl imidazolium tetrafluoroborate onVibrio qinghaiensissp. Q67[J].Chemosphere,2011,84(10):1440-1445.
[24] 袁静, 刘树深, 王丽娟, 等.蛋白核小球藻(Chlorella pyrenoidosa)微板毒性分析方法优化[J].环境科学研究,2011,24(5):553-558.
YUAN J, LIU S S, WANG L J, et al.Optimization of microplate toxicity analysis method based onChlorella pyrenoidose[J].Research of Environmental Sciences,2011,24(5):553-558.
[25]ZHANG J, LIU S S, DOU R N, et al.Evaluation on the toxicity of ionic liquid mixture with antagonism and synergism toVibrio qinghaiensissp. Q67[J].Chemosphere,2011,82(7):1024-1029.
[26] 徐小庆, 郭璞, 王晓静, 等.浓度加和模型与独立作用模型在化学混合物联合毒性预测方面的研究进展[J].动物医学进展,2020,41(4):91-94.
XU X Q, GUO P, WANG X J, et al.Progress on CA and IA models in combined toxicity prediction of chemical mixtures[J].Progress in Veterinary Medicine,2020,41(4):91-94.
[27]LIU L, LIU S S, YU M, et al.Application of the combination index integrated with confidence intervals to study the toxicological interactions of antibiotics and pesticides inVibrio qinghaiensissp. Q67[J].Environmental Toxicology and Pharmacology,2015,39(1):447-456.
[28]BACKHAUS T, FAUST M.Predictive environmental risk assessment of chemical mixtures: a conceptual framework[J].Environmental Science & Technology,2012,46(5):2564-2573.
[29]SÁNCHEZ-BAYO F, BASKARAN S, KENNEDY I R.Ecological relative risk (EcoRR): another approach for risk assessment of pesticides in agriculture[J].Agriculture, Ecosystems &Environment,2002,91(1/2/3):37-57.
[30] 孙凯. 洪泽湖湿地典型抗生素污染特征与生态风险[D]. 南京:南京林业大学, 2015.
[31] 刘晓晖. 洞庭湖流域水环境中典型抗生素污染特征、来源及风险评估[D]. 济南: 山东师范大学, 2017.
[32]LIU S S, SONG X Q, LIU H L, et al.CombinedPhotobacteriumtoxicity of herbicide mixtures containing one insecticide[J].Chemosphere,2009,75(3):381-388.
[33] 曾莎莎, 梁延鹏, 覃礼堂, 等.有机磷农药对蛋白核小球藻的毒性相互作用研究[J].生态毒理学报,2019,14(4):121-129.
ZENG S S, LIANG Y P, QIN L T, et al.Toxicological interactions of organophosphorus pesticides mixtures toChlorella pyrenoidosa[J].Asian Journal of Ecotoxicology,2019,14(4):121-129.
[34] 王滔, 班龙科, 张瑾, 等.三嗪类农药复合污染物对蛋白核小球藻的联合毒性作用评估[J].农业环境科学学报,2020,39(3):482-495.
WANG T, BAN L K, ZHANG J, et al.Evaluation of combined toxicity of triazine pesticide contaminants againstChlorella pyrenoidosa[J].Journal of Agro-Environment Science,2020,39(3):482-495.
[35] 张健威, 曾莎莎, 梁延鹏, 等.会仙湿地水体有机磷农药污染特征及生态风险[J].农业环境科学学报,2021,40(9):1990-1997.
ZHANG J W, ZENG S S, LIANG Y P, et al.Pollution characteristics and ecological risk assessment of organophosphorus pesticides in Huixian wetland water[J].Journal of Agro-Environment Science,2021,40(9):1990-1997.
