克林霉素耐药型金黄色葡萄球菌耐药基因与生物膜形成能力分析*
2022-01-25裴光德冉华丽肖文科汤荣睿
陈 瑶,裴光德,李 娟,王 芳,冉华丽,李 蓉,肖文科,汤荣睿
(重庆市沙坪坝区人民医院医学检验科,重庆 400030)
金黄色葡萄球菌是一种革兰阳性球菌,分布广泛、致病性强、耐药率高,可导致院内感染流行,是医院内感染常见的病原体之一,也是引起人类化脓性感染的常见病原菌[1]。近年来,金黄色葡萄球菌暴发流行,当患者机体免疫功能低下或皮肤黏膜出现破损时,可突破皮肤及黏膜屏障,导致皮肤、肺等部位出现感染,从而引起败血症、脓毒症等,造成极其严重的临床后果[2]。细菌生物膜可将细菌包裹其中保护细菌不受抗菌药物的作用,并能降低机体免疫功能和细胞的吞噬作用,是发生持续性感染及感染难以治愈的主要原因[3]。研究表明,生物膜能阻碍抗生素的释放并参与抗生素耐药[1]。金黄色葡萄球菌极易形成生物膜以逃避机体的免疫系统和抗菌药物的杀灭作用,导致金黄色葡萄球菌致病性和耐药性明显增强。
金黄色葡萄球菌的传统治疗方法仍以抗生素为主,临床上常使用大环内酯类(MLSB类)即(如红霉素)、林可酰胺类(如克林霉素)、B类链阳霉素类抗菌药物治疗金黄色葡萄球菌引起的感染。克林霉素因其半衰期长、不良反应少被广泛使用。然而,随着广谱抗生素的大量使用,多重耐药菌的发生呈上升趋势[4-5]。金黄色葡萄球菌对克林霉素的耐药率逐年上升,仅次于青霉素和红霉素。然而,我国住院患者分离的金黄色葡萄球菌体外生物膜形成能力及其与耐药性的关系研究甚少。本研究拟通过对本院2019年9月至2020年9月分离的克林霉素耐药型金黄色葡萄球菌耐药基因及生物膜形成能力的研究,以期更深入地了解克林霉素耐药型金黄色葡萄球菌发生的分子机制,为临床上控制耐药菌的产生提供可靠的理论基础。
1 材料与方法
1.1材料
1.1.1菌株来源 收集沙坪坝区人民医院在2019年9月至2020年9月临床分离的金黄色葡萄球菌,根据药敏试验结果和D试验,选取结构型和诱导型克林霉素耐药金黄色葡萄球菌作为研究菌株。同一患者、同一时期相同部位分离的菌株只取1次作为研究。菌株均来自本院住院和门诊患者送检的样本,包括痰液、尿液、脓液、分泌物等。
1.1.2仪器与试剂 全自动细菌鉴定及药敏试验分析仪(湖南天地人生物科技有限公司);二氧化碳恒温培养箱(上海三腾仪器有限公司);基因扩增仪(珠海黑马医学仪器有限公司);凝胶电泳成像仪(美国BIO RAD公司);酶标仪(上海科华实验系统有限公司);DNA抽提试剂盒及PCR试剂盒(上海生工生物工程股份有限公司);erm耐药基因引物(上海生工生物工程股份有限公司);Star Marker D2000 Plus(广州市康润生物科技有限公司);1%结晶紫染色液(上海心语生物科技有限公司)。
1.2方法
1.2.1细菌鉴定及药敏试验 常规培养分离细菌,操作按《全国临床检验操作规程》第4版进行[6],利用全自动细菌分析仪鉴定菌种。药敏试验采用全自动细菌分析仪测试最低抑菌浓度(MIC),结果判读参考美国临床和实验室标准化协会(CLSI)M100标准。
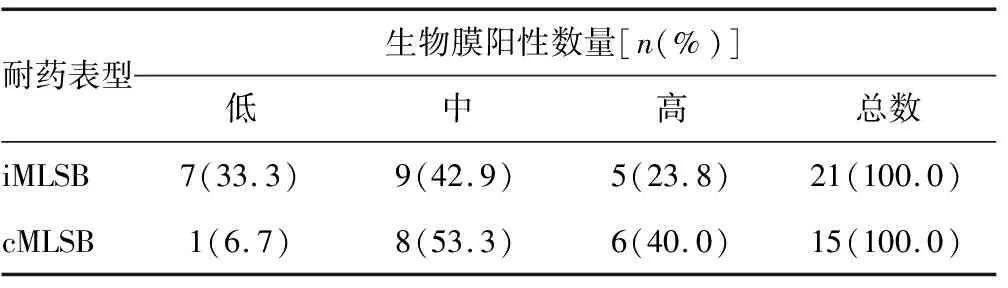
1.2.2生物膜形成试验 采用96孔板结晶紫染色法,挑取单个菌落接种于含1%葡萄糖的TSB溶液中,置于37 ℃、60 r/min的恒温空气摇床中培养[7],24 h后用比浊仪将菌液调至1.0麦氏浊度。在无菌96孔板中加入100 μL调制好的菌液,置于37 ℃、60 r/min的恒温空气摇床中培养72 h,PBS缓冲液缓慢冲洗3遍,加入100 μL甲醇固定15 min,加入100 μL 1%结晶紫溶液,37 ℃染色15 min,PBS缓冲液洗涤3次,干燥,最后加入95%乙醇溶解结晶紫染料,于波长570 nm处测定A值,以A(570)值代表各组金黄色葡萄球菌生物膜形成量。每种菌株重复3次实验,每次实验重复3个孔,每种菌株OD值取3次实验平均值(OD值),空白组只加入含1%葡萄糖TSB溶液,空白组OD值的2倍作为界限值(ODc),根据每组细菌OD值与ODc值大小的关系,细菌被分为以下4类[8]:(1)强生物被膜形成株(OD>4*ODc);(2)中等强度生物被膜形成株(2*ODc 1.2.3耐药基因的检测 1.2.3.1金黄色葡萄球菌DNA的提取 将收集的待测菌株接种于哥伦比亚血琼脂平板上,置于37 ℃二氧化碳培养箱中培养18~24 h。用取菌环挑取数个单菌落接种于1 mL双蒸水制成混悬菌液,之后方法严格按照细菌DNA提取试剂盒说明书进行操作。 1.2.3.2耐药基因检测 根据GenBanK中己发布的金黄色葡萄球菌erm耐药基因序列,参考文献[8]设计各型别引物(委托上海生工生物工程股份有限公司合成),扩增条件见表1。取5 μL PCR产物在1%琼脂糖凝胶进行电泳30 min,后将凝胶置于紫外凝胶成像仪下拍照并记录保存结果。 表1 erm基因各分型PCR扩增引物序列及其产物长度 1.3统计学处理 所有数据采用SPSS26.0统计学软件进行分析。不同表型克林霉素耐药型金黄色葡萄球菌、erm耐药基因与生物膜形成能力的比较采用卡方检验。P<0.05为差异有统计学意义。 2.1标本来源情况 本院2019年9月至2020年9月共分离得到金黄色葡萄球菌114株,根据药敏试验结果和D试验,将克林霉素耐药型金黄色葡萄球菌分为结构型耐药(cMLSB)和诱导型耐药(iMLSB),共分离得到36株,其中cMLSB型15株,占41.7%;iMLSB 21株,占58.3%。绝大多数标本来自于痰液,占55.6%(20/36),其余来源于分泌物33.2%(12/36)、导管2.8%(1/36)、穿刺液2.8%(1/36)、血液2.8%(1/36)、组织2.8%(1/36)。检出率位于前3位的科室分别是儿科41.6%(15/36)、呼吸科27.8%(10/36)、外科19.4%(7/36)。见表2。 表2 36株克林霉素耐药型金黄色葡萄球菌标本来源及分布特点 2.2生物膜形成能力的判断 依据生物膜形成能力判断标准,36株克林霉素耐药型金黄色葡萄球菌均有生物膜的形成能力,其中有8株生物膜形成能力较弱,占22.2%;有17株形成生物膜的能力较中等,占47.2%;有11株具有较强的生物膜形成能力,占30.6%。经统计分析,cMLSB型和iMLSB型在生物膜形成能力方面差异无统计学意义(P>0.05)。见表3。 表3 不同MLSB表型与生物膜形成能力检出情况 2.3耐药基因型检测结果 2.3.1erm基因在不同类型菌株中的分布 目前,在金黄色葡萄球菌中发现了3种erm基因,即ermA、ermB和ermC,ermA和ermC比较常见。检测发现,在36株克林霉素耐药型金黄色葡萄球菌中,检出ermA基因12株,占33.3%;ermB基因2株,占5.6%;ermC基因18株,占50.0%;同时表达ermA+ermC基因4株,占11.1%。其中,iMLSB型主要表达ermC(P=0.012),cMLSB型主要表达ermA(P=0.004),差异有统计学意义(P<0.05)。见表4。PCR反应产物在琼脂糖凝胶中电泳见图1。 表4 erm耐药基因在不同MLSB表型中检出情况 M表示Marker(2 000 plus);1.阴性对照;2.ermA基因;3.ermB基因;4.ermC基因。 2.3.2erm耐药基因在不同生物膜形成重的分布 对耐药基因ermA、ermB、ermC进行PCR检测,ermA阳性菌株有50.0%具有强生物膜形成能力,43.7%具有中等生物膜形成能力;ermA阴性菌株仅有15.0%具有强生物膜形成能力,85.0%的菌株只有中等和低等生物膜形成能力,存在ermA耐药基因的菌株中生物膜阳性数量显著高于无ermA耐药基因携带组,差异有统计学意义(P=0.024)。而ermB、ermC在生物膜形成能力上差异无统计学意义(P>0.05)。见表5。 表5 erm耐药基因在不同生物膜形成能力中检出情况[n(%)] 金黄色葡萄球菌能产生多种毒力因子,如α毒素、肠毒素、杀白细胞素、表皮剥脱毒素、休克综合征毒素、酚溶解蛋白、血浆凝固酶等,并能降低宿主免疫反应和细胞吞噬作用[2]。金黄色葡萄球菌生物膜对抗生素具有高度耐药性,并能抵抗宿主防御机制的攻击,使抗感染治疗日益困难。近年来,越来越多的研究者为了降低抗生素的使用频率,减少多重耐药菌的产生,试图通过寻找生物膜抑制剂来控制感染的发生,这将是后抗生素时代控制细菌感染最有前途的治疗手段。由此可见,临床医生迫切需要充分认识金黄色葡萄球菌的耐药机制,结合其生物膜特性,发现其相关性,以求探索治疗金黄色葡萄球菌感染新方法的思路,建立金黄色葡萄球菌的感染管理新策略。 金黄色葡萄球菌对克林霉素的耐药机制主要有2种:一种是特异性耐药,由erm基因编码,主要包括ermA、ermB和ermC。erm基因编码产生的甲基转移酶导致23S rRNA的甲基化作用,降低了MLSB类抗生素对rRNA靶位的结合,使药物失效,引起大环内酯类、林可霉素类和B型链阳霉素耐药(即MLSB耐药)。MLSB耐药又分为cMLSB和iMLSB[10]:cMLSB是由于erm基因上游启动子发生突变而使其erm基因持续表达产生耐药,其表型为红霉素和克林霉素同时耐药。iMLSB是指红霉素作为诱导剂通过衰减机制诱导erm基因表达而产生耐药,其表型为对红霉素耐药对克林霉素敏感。另一种耐药为非特异性耐药,金黄色葡萄球菌作为医院内感染的重要病原菌,也是容易形成细菌生物膜的常见细菌之一[10]。各种证据表明,金黄色葡萄球菌感染过程中生物膜的形成除了导致住院时间延长外,还与许多重要的疾病密切相关,如肺炎、坏死性筋膜炎、多发性关节炎、败血症和心内膜炎。生物膜的概念最先由微生物学家COSTERTON在1987年提出,其是细菌黏附于固体或机体腔道表面形成的微菌落与分泌的细胞外多糖蛋白复合物形成的膜状物[11]。生物膜可将细菌包裹在其里面,保护细菌不受抗菌药物的作用,并能降低机体免疫功能和细胞的吞噬作用,加之细菌的大量繁殖和毒性因子的分泌使感染长期停留在炎症阶段,难以治愈[12]。对于生物膜感染的伤口,最常用的方式为外科清创法,然而由于清创面积及深度有限,生物膜容易残留,进而形成新的生物膜。随着生物膜研究的进展,负压创面疗法、干扰细胞群体感应系统、胞外多聚糖降解酶、DNA酶、抗菌肽的运用已投入到生物膜的治疗中来[13-14]。 耐药菌的克隆传播造成大面积患者感染更使治疗情况日益严峻,为临床感染的控制带来了极大的挑战。然而,多重耐药细菌的监测与预防仍然面临诸多问题,如耐药菌监测技术落后、耐药性监测手段匮乏、预防技术停滞不前等。目前,尚无一种可靠的多重耐药菌感染预防方法。 本研究显示,本院2019年9月至2020年9月共分离得到金黄色葡萄球菌114株,根据根据药敏试验结果和D试验,共收集到克林霉素耐药型金黄色葡萄球菌36株,其中cMLSB型15株,占41.7%;iMLSB 21株,占58.3%,这表明本院诱导型克林霉素耐药金黄色葡萄球菌发生率已很高,临床应引起高度重视,谨慎使用克林霉素。从标本来源看,克林霉素耐药型金黄色葡萄球菌绝大多数标本来自于痰液(55.6%)和分泌物(33.2%),送检科室主要是儿科(41.6%)、呼吸科(27.8%)和外科(19.4%),说明克林霉素耐药型金黄色葡萄球菌是呼吸道和外伤等感染性疾病的主要致病菌,而儿童由于免疫系统尚未成熟对病原体抵抗能力不足,因此检出率也较高。从耐药表型来分析,克林霉素耐药型金黄色葡萄球菌耐药基因以ermA和ermC为主,分别占33.3%和50.0%,ermB基因较少见。其中,iMLSB型主要表达ermC,cMLSB型主要表达ermA,与相关文献报道一致[15]。从耐药基因分析,生物膜在ermA基因阳性菌株中形成能力较强,ermA阳性菌株有50.0%具有强生物膜形成能力,ermA阴性菌株仅有15.0%具有强生物膜形成能力,ermA耐药基因与生物膜表达显著相关,与研究结果一致[14]。这表明cMLSB型金黄色葡萄球菌具有较强的生物膜形成能力,且耐药机制与ermA高度相关,在临床检验工作中应重点关注此类菌株对疾病感染的影响。因此,后续研究将加大样本量进一步研究其相关性,并开展生物膜抑制剂对ermA耐药型菌株的干预性研究,比较使用抑制剂前后菌株药物敏感性的差异,以降低抗生素的使用频率,从而减少耐药菌的产生。在此基础上进一步研究抗生素耐药性与生物膜形成之间的关系可能有助于制定金黄色葡萄球菌治疗新思路,延缓耐药菌的发展。
2 结 果




3 讨 论
