活血通络药物对膝骨关节炎小鼠凋亡软骨细胞体外干预的影响
2022-01-24韦佳佳廖建青张英杰
韦佳佳,廖建青,张英杰,王 琦*
(1.云南中医药大学第一附属医院,昆明 650021;2.云南中医药大学,昆明 650500)
骨关节炎(OA)是全世界范围内常见的慢性、进行性的骨关节疾病[1-3]。生理状态下,膝关节软骨细胞增殖和凋亡处于动态平衡,以维持细胞数量及功能的稳定。然而,一旦软骨细胞发生过度凋亡就会打破这一动态平衡,软骨细胞出现凋亡是导致膝骨性关节炎软骨退行性病变的关键性因素[4-6]。而近年来中药治疗膝骨关节炎(KOA)、抑制软骨细胞凋亡的作用机制已成为研究热点,中医药能抑制KOA 炎症保护关节软骨、缓解关节疼痛已经得到证实,中医药不仅具有整体治疗、辨证论治个性化等独特优势,还可明显改善患者的生活质量[7-9]。中医学认为,瘀血贯穿于整个KOA 病程的始终,故运用活血化瘀通络治疗KOA 也贯穿于整个疾病的治疗过程[10]。有研究表明,运用活血通络中药治疗早期KOA时在总有效率、不良反应率、KSS评分等方面均优于NSAIDs[11]。为了深入研究验证,本次实验拟选用正常小鼠软骨细胞和KOA 小鼠凋亡软骨细胞进行体外培养、细胞传代,在培养传代成功的基础上,绘制细胞生长曲线,分别以具有活血通络作用的不同血清浓度骨痹合剂、氨糖美辛、生理盐水干预后,观察活血通络药物对软骨细胞凋亡的影响。以此对活血通络药物的机制进行初步的验证,并为下一步实验提供前期基础。
1 实验材料
1.1 实验动物 取SPF 级正常小鼠、KOA 造模小鼠各80 只。体质量(19.6±0.6)g。动物接收、灭菌后将小鼠置于IVC 动物房中,将小鼠随机放入小鼠笼中,每笼5 只,共16 笼。正常饲养,室温20~24 ℃,相对湿度42%~53%,常规饮食,日照时间为每天10~12 h,空气流通。C57小鼠(南京市江宁区青龙山动物繁殖场,许可证号:SCXK(苏)2017-0001),IVC 动物饲养系统(苏州苏杭科技)。
1.2 实验试剂及设备 II 型胶原酶(ThermoFisher,17101015),PBS(南京生兴,SN331),胰酶(Hyclone,SH30042.01),DMEM/F12(Hyclone,SH30023),细胞培养箱(Thermo Fisher,3131),甲苯胺蓝染色 液(Leagene,DB0057),多聚甲醛(aladdin,C104188),II 型胶原酶(ThermoFisher,17101015),DMSO(sigma,C6295-50 mL),FBS(Hyclone,SH30070.03),显微镜(Nikon,Ts2R),RPMI-1640 培养基(Hyclone,SH30809),FBS(Hyclone,SH30070),PI-AnnexinV-FITC 细胞凋亡检测试剂盒(eBioscience,BMS500FI),冷冻离心机(Eppendorf,5430),流式细胞仪(BD,FACScalibur),DMEM/F12(Hyclone,SH30023.01B),胎牛血清(Hyclone,SH30070.03),青霉素/ 链霉素(Hyclone,SV30010),血球计数板(上海求精生化),MTT(beyotime,C0009),CO2培养箱(Thermo fisher,3131),酶标仪(Thermo fisher,Multiskan 51119000)。
1.3 实验药物 骨痹合剂(滇药制字(Z)04A01888)由云南中医药大学第一附属医院制剂中心提供,氨糖美辛肠溶片(国药准字H20023171)由上海华中药业有限公司提供。
2 实验方法
2.1 动物分组 实验动物SPF 级小鼠80 只,质量20~25 g,20 只用于软骨细胞取材,其中10 只用于正常软骨细胞取材,10只用于建立KOA软骨细胞取材,60 只用于含药血清制备。
2.2 KOA 小鼠模型的建立 取10 周龄SPF 级C57 雄性小鼠10 只,4%的戊巴比妥钠腹腔麻醉,小鼠腿部膝关节处剃毛,膝关节部位备皮消毒,取髌旁内侧切口显露膝关节,显露髌骨向外侧脱位,尽量屈曲膝关节显露前交叉韧带后切断,止血后将髌骨复位,关节腔逐层闭合。术后3 d 每天每只肌肉注射青霉素预防感染。剩余10 只为正常组软骨细胞取材。
2.3 含药血清的制备方法 骨痹合剂组小鼠以骨痹合剂灌胃,氨糖美辛组小鼠以氨糖美辛肠溶片溶于同体积蒸馏水灌胃,生理盐水组小鼠以同体积生理盐水灌胃,每组20 只,药物剂量和浓度按人与小鼠正常药量比进行换算(Meeh Rubner 公式)的3 倍,每日上午、和下午各1 次,连续3 d,末次灌胃2 h 后麻醉状态下腹主动脉采血,4 ℃静置过夜后离心,取血清56 ℃灭活30 min,过滤除菌,分装,-20 ℃冰箱保存备用。
2.4 小鼠关节软骨细胞分离及培养 用手术刀切出胫骨和股骨端部软骨,放入PBS 中,收集完所有软骨组织后,切碎,转移到15 mL 离心管中,1 000 r/min 离心5 min。弃去上清PBS,加入足量II 型胶原酶和胰酶消化3~6 h,收集细胞悬液,转移到培养瓶中,补足DMEM/F 12 培养基,37 ℃培养,48 h 后换液,观察细胞状态。每2 d 更换新的完全培养基,当细胞长至80%~90%时,去除培养基,加入PBS 洗1~2 次,去除PBS 后,加入1 mL 胰酶消化2 min 后,加入3 mL完全培养基中和胰酶终止消化,消化的细胞离心,倒掉上清,加入3 mL 培养基重悬细胞,1:3 传代至培养皿中,轻轻摇晃均匀后放入培养箱中培养。5 d 后将细胞从培养箱中取出,置于超净台中,轻轻去除培养基,加入PBS 洗1 次,去除PBS 后,加入1 mL 胰酶,摇晃均匀后放入培养箱中消化2 min,细胞消化结束后,加入3 mL 完全培养基中和胰酶终止消化,将消化的细胞离心。离心结束后倒掉上清,传代的细胞加入培养基将细胞重悬后将细胞接种至培养皿中,放入培养箱中培养。当细胞状态正常,细胞融合度在90%,2 d 后再次将细胞从培养箱中取出,置于超净台中,轻轻去除培养基,加入PBS 洗1 次,去除PBS 后,加入1 mL 胰酶,摇晃均匀后放入培养箱中消化2 min,细胞消化结束后,加入3 mL 完全培养基中和胰酶终止消化,将消化的细胞转移至15 mL 离心管中,1 000 r/min离心5 min。离心结束后倒掉上清,传代的细胞加入培养基将细胞重悬后将细胞接种至培养皿中,放入培养箱中培养。接种部分细胞至24 孔板中,做甲苯胺蓝染色鉴定。需要冻存的细胞,加入细胞冻存液重悬细胞,转移至细胞冻存管中,标记后放入细胞冻存盒中置于-80 ℃冰箱中冻存。冻存液:FBS 和DMSO 9:1。
2.5 甲苯胺蓝染色 将细胞从培养箱中取出,将细胞置于显微镜下观察细胞贴壁情况以及细胞状态。将24孔板中培养基去除培,用PBS 清洗1 次,加入1 mL多聚甲醛常温固定细胞10 min,去除多聚甲醛,用PBS 清洗2 次。每孔加入甲苯胺蓝工作液500 μL,室温染色30 min。弃去染色液,用自来水清洗数次显色。显微镜下观察染色效果,拍照。
2.6 MTT 检测 将长到培养皿80%~90%的正常软骨细胞和KOA 软骨细胞用胰酶消化下来,1 000 r/min离心,去除上清,加入完全培养基重悬细胞,将细胞分别种在96 孔板中,每孔种3 000 个细胞。待细胞贴壁后,加入含药血清5%、10%、20% 3 个浓度的骨痹合剂、氨糖美辛和生理盐水的培养基。分别培养2、4、6、8 d 后,加入10 μL MTT(5 mg/mL),在细胞培养箱中继续培养约3 h。去除培养基,每孔加入150 μL DMSO,摇晃均匀,在570 nm 波长测定吸光度。
2.7 细胞凋亡检测 正常小鼠和KOA 小鼠软骨细胞加入骨痹合剂、氨糖美辛以及生理盐水培养到指定时间点。收集培养上清,用胰酶消化贴壁的细胞,1 000 r/min 离心5 min,弃上清。(将细胞培养上清中的细胞和贴壁细胞全部收集到离心管中)。用预冷的PBS 洗3 次细胞,4 ℃,1 000 r/min 离心5 min,弃上清。加入1 mL binding buffer 洗细胞,4 ℃,1 000 r/min离心5 min,弃上清。加入100 μL binding buffer 重悬细胞,加入5 μL PI 和5 μL FITC-Annexin V,混合均匀,常温避光孵育15 min,加入400 μL binding buffer 混匀,立刻用流式细胞仪检测。收集和分析数据,输出报告。
2.8 统计学分析 采用 SPSS 22.0 软件进行统计学分析。计量资料以均数±标准差()表示,组间比较采用t检验。
3 结果
3.1 小鼠关节软骨原代细胞形态及鉴定 小鼠关节软骨细胞成功提取,显微镜下观察可见软骨细胞呈多角形、梭形单层覆盖于培养皿底部。培养后见细胞状态正常,将原代细胞以1:3 传代至培养皿。正常小鼠软骨细胞增殖能力较强,KOA 模型的软骨细胞增殖能力较弱。见图1。

图1 为关节软骨细胞白光图
将传代细胞进行甲苯胺蓝染色,显微镜下软骨细胞多呈多角形,胞质呈均质状,较疏松,大部分可见到核仁,少数也可见分裂相,细胞浆和胞膜呈蓝色,所有的细胞都被甲苯胺蓝着色,表明都是软骨细胞。见图2。

图2 为分离提取的关节软骨细胞甲苯胺蓝染色结果
3.2 MTT 检测结果 见图3。
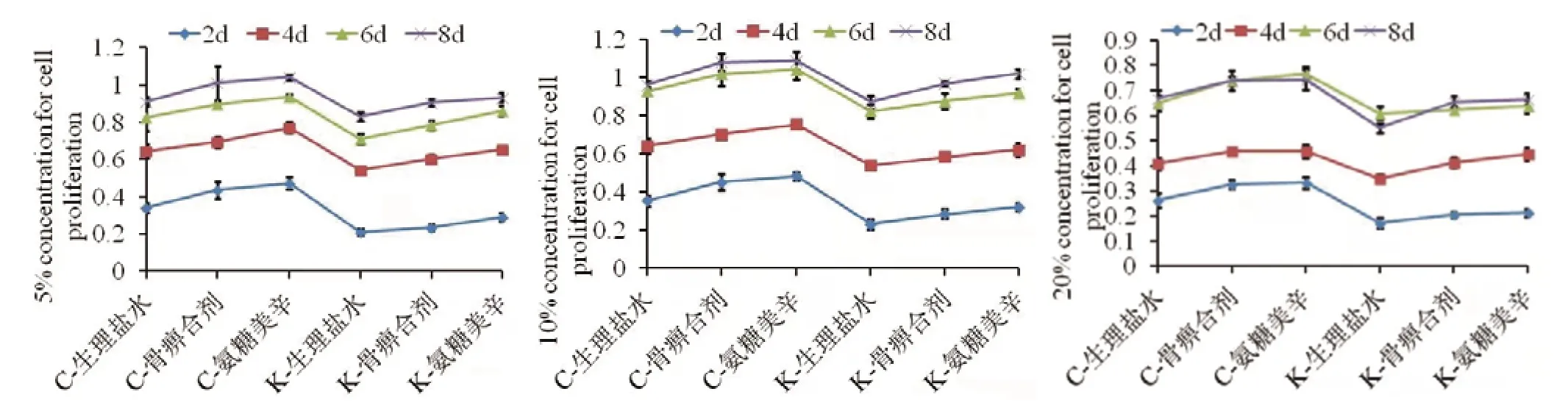
图3 不同浓度(骨痹合剂组、氨糖美辛组、生理盐水组)含药血清处理软骨细胞2、4、6、8 d 检测软骨细胞生长曲线
从结果中可以看出,骨痹合剂组及氨糖美辛组均可抑制软骨细胞凋亡,一定程度促进细胞增殖。而在不同浓度骨痹合剂组中,10%含药血清相对于5%和20%含药血清浓度更加促进细胞增殖,说明10%含药血清浓度相对为最佳浓度。并且随着细胞培养时间的延长,2 d 的时间点各组增殖变化最为明显。
3.3 骨痹合剂、氨糖美辛以及生理盐水干预细胞凋亡的观察 见表1,图4。
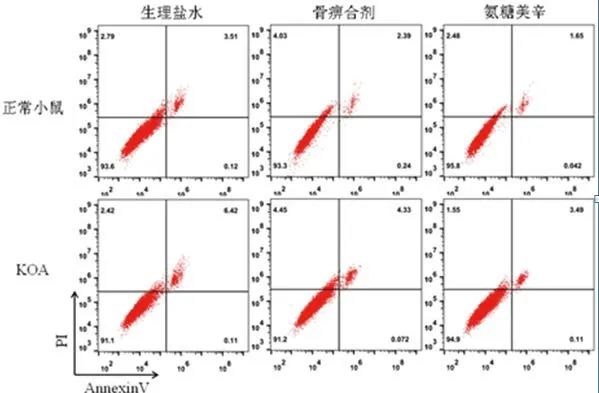
图4 凋亡结果十字散点图

表1 骨痹合剂、氨糖美辛以及生理盐水干预细胞凋亡的观察
从凋亡结果图中可以看到画十字的散点图,左上象限是死细胞,左下象限是正常活细胞,右下象限是早期凋亡细胞,右上象限是晚期凋亡细胞。实验中统计的右上象限的细胞的比例。从结果中可以看出相对于对照组正常,KOA 模型分离出的软骨细胞凋亡较高,在对KOA 组小鼠凋亡的软骨细胞进行药物血清干预培养后发现,骨痹合剂和氨糖美辛抑制细胞凋亡,对细胞起保护作用。
4 讨论
前期研究及本次实验观察发现,KOA 软骨细胞数量较正常软骨细胞增殖少,观察到与正常软骨相比,KOA 软骨中的凋亡软骨细胞更多。大量研究假设,KOA 或软骨衰老是软骨细胞凋亡的结果。但是,KOA 也可能导致高水平的软骨细胞凋亡,这些假设的差异表明软骨细胞凋亡与软骨损伤之间的复杂关系[12]。因此,抑制细胞凋亡和促进软骨细胞存活的药物开发研究至关重要。软骨细胞的凋亡受到多种因素的影响,Bcl-2 家族途径、抗氧化和抗炎途径、PI3KAkt-mTOR 途径、HIF1α 途径,Sox9 途径和miRNA途径等等[13-14]。所以,目前通过介导和调控细胞的凋亡途径来防治骨关节炎已成为目前的热门研究。抑制凋亡为有效和安全地保护软骨细胞抵抗KOA 提供了潜在的治疗靶点。
结合以上机制,本实验选取云南省中医医院使用多年院内制剂骨痹合剂作为治疗研究目标,采用云南省中医医院院内制剂骨痹合剂及对照组氨糖美辛不同药物浓度对软骨细胞干预观察,骨痹合剂由以下主要药物组成:当归、丹参、红花、桂枝、全蝎、蜈蚣、桑寄生、杜仲、独活等。全方以活血通络为主,又兼具祛风除湿、补益肝肾之效。本方所治病证,乃因风寒湿邪阻于经络,经络痹阻,筋骨失养所致。本研究中,在小鼠成功造模及前期实验完成的基础上,设计第二阶段实验。在实验中,骨痹合剂含药血清组能够明显降低软骨细胞凋亡模型中软骨细胞的凋亡率,可能与骨痹合剂组能够抑制软骨细胞凋亡,延缓关节软骨的退行性改变,促进关节软骨修复的作用有关。同时在本实验中观察后确定,10%骨痹合剂含药血清浓度为促进软骨细胞增殖的相对最佳浓度,培养2 d 后不同组别之间的细胞增殖变化最明显,为下一步研究中对信号通路调控细胞凋亡的检测研究,确定给药浓度及对干预时间点做出预判。
