单壁碳纳米管对紫花苜蓿根际土壤中PAHs降解及微生物群落的影响
2022-01-24王慧敏陈莉荣任文杰郑春丽黄怡雯滕应张铁军
王慧敏,陈莉荣,任文杰,郑春丽,黄怡雯,滕应,张铁军
(1.内蒙古科技大学能源与环境学院,内蒙古 包头 014010;2.中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),南京 210008)
多环芳烃(PAHs)是环境中普遍存在的一类具有“三致”效应的持久性有机污染物,对人体健康和生态系统具有极大威胁[1−2]。欧盟和美国环境保护署已把16 种PAHs 列为优先控制污染物,其中苯并[a]芘等7种PAHs 也被我国列入“中国环境优先污染物黑名单”[3−5]。近年来,随着工业化和城市化的快速发展,我国土壤中PAHs 日趋积累[4,6−9],据《全国土壤污染状况调查公报》显示,土壤中PAHs 的点位超标率已达1.4%,因此PAHs 污染土壤修复已成为我国亟待解决的重要环境问题。根际修复是PAHs 污染土壤绿色经济的修复策略[9−10],但目前修复周期仍然较长,因此寻找有效的强化措施、提高根际修复效率已成为拓展根际修复应用的重要途径。
碳纳米管是一种径向尺寸为纳米量级的一维量子材料,由于其独特的物理化学性质而在环保和农业等多个领域显示出巨大的应用潜力。碳纳米管可通过疏水和π−π 相互作用强烈吸附PAHs[11−12],从而可能会影响其在环境中的生物有效性和归趋[13−14]。CUI等[15]发现添加单壁碳纳米管(SWCNTs)可以显著抑制沉积物中菲的生物有效性,进而抑制菲的矿化。但目前关于SWCNTs 对土壤中有机污染物降解的影响尚未见报道。碳纳米管在一定浓度下还可以促进植物发芽生长,使根长和侧根数增加,同时还可以促进植物光合作用[16−17],增强植物的抗逆性[18]。YUAN 等[19]研究表明,多壁碳纳米管(MWCNTs)也可以提高植物茎的伸长。此外,碳纳米管对土壤微生物群落还具有一定的调控作用。WU 等[20]发现SWCNTs可以通过改变土壤细菌群落,进而影响碳氮循环。GE 等[21]的研究表明长期添加MWCNTs 显著降低了土壤细菌生物量,改变了土壤细菌群落结构。HAO 等[22]研究了MWCNTs 对种植水稻的土壤中细菌群落的影响,发现MWCNTs降低了变形菌门和硝化螺菌属(Nitrospira)的相对丰度,并显著改变了土壤细菌群落构成,进而影响土壤氮素循环。由此可见,碳纳米管的这些特性均可能会影响PAHs 在植物根际的降解过程,但相关报道还比较有限。
本研究选择南京市栖霞区某煤制气厂污染场地土壤(粉砂壤土)作为供试土壤,以已报道的PAHs 污染土壤典型修复植物紫花苜蓿和SWCNTs 为供试材料,通过盆栽试验研究了SWCNTs对紫花苜蓿根际土壤中PAHs 降解及微生物群落的影响,为探究SW⁃CNTs在污染土壤根际修复中的应用提供基础数据。
1 材料与方法
1.1 化学试剂
16种多环芳烃(PAHs)标准溶液购自Sigma−Aldrich公司,乙腈和正己烷(色谱纯)购自Tedia 公司(Ohio,美国),二氯甲烷和环己烷(分析纯)购自国药集团,无水硫酸钠(分析纯)购自西陇科学股份有限公司,硅胶(100~200目)购自青岛美高集团有限公司。
1.2 供试土壤与单壁碳纳米管
供试土壤采集南京市栖霞区某煤制气厂污染场地。采集的表层土壤(0~20 cm)样品,经过自然避光风干,均质化并过2 mm筛以去除石头、植物残体和其他碎屑。根据联合国粮食及农业组织(FAO)世界土壤分类系统,该土壤类型属于粉砂壤土。土壤基本理化性质测定参考鲁如坤[23]描述的方法,具体指标如下:土壤pH 8.51、有机质20.76 g·kg−1、全氮0.52 g·kg−1、全磷0.59 g·kg−1、全钾16.36 g·kg−1、碱解氮45.33 mg·kg−1、速效磷8.29 mg·kg−1、速效钾174.67 mg·kg−1、铵态氮2.50 mg·kg−1、硝态氮0.77 mg·kg−1、阳离子交换量18.48 cmol·kg−1。土壤中PAHs 总量为344.48 mg·kg−1,其中包括芴1.68 mg·kg−1、菲34.13 mg·kg−1、蒽1.88 mg·kg−1、荧蒽61.51 mg·kg−1、芘89.99 mg·kg−1、苯并[a]蒽29.82 mg·kg−123.44 mg·kg−1、苯并[b]荧蒽25.86 mg·kg−1、苯并[k]荧蒽13.64 mg·kg−1、苯并[a]芘33.32 mg·kg−1、二苯并[a,h]蒽2.12 mg·kg−1、苯并[g,h,i]苝27.09 mg·kg−1。
SWCNTs 购自深圳市国恒启航科技有限公司,分别采用扫描电子显微镜(SEM)(Quanta FEG 250,FEI,Hillsboro,美国)、透射电子显微镜(TEM)(FEI Tech⁃nai,F20,美国)和比表面积分析仪(BET)(V−Sorb 2800P,Gold APP Instruments Co.,北京,中国)对SW⁃CNTs 的形貌、结构和比表面积进行表征;通过拉曼(Raman)光谱仪(Renishaw 100,新加坡)评估SW⁃CNTs 的缺陷程度;通过傅里叶变换红外光谱(FTIR)(Nicolet 380,Thermo Fisher Scientific,Waltham,美国)和X 射线光电子能谱(XPS)(ESCALAB 250Xi spec⁃trometer,Thermo Scientific,美国)分析SWCNTs 的表面官能团、元素组成及含量。
1.3 紫花苜蓿盆栽试验
称600 g 风干土于花盆中,每千克土壤中施加尿素0.214 5 g、Ca(H2PO4)2·H2O 0.284 6 g和K2SO40.187 6 g。设置4 个不同SWCNTs 浓度的处理组:0(对照组)、0.1、0.5、5 g·kg−1,SWCNTs以固体粉末形式加入。紫花苜蓿种子购于江苏省农业科学院,种子先用0.5%的次氯酸钠溶液消毒10 min,再用95%的酒精溶液杀菌10 min,然后用无菌水连续冲洗5 次,最后放入盛有无菌水的烧杯中浸泡2 h,将浸泡后的种子均匀放于铺有湿润滤纸的无菌培养皿中,并于30 ℃的恒温培养箱中催芽24 h 后选取籽粒饱满的种子均匀播种于花盆中,10 d 后将每盆内幼苗间苗到40 株。所有植株置于光照培养室中培养,白天(16 h)温度为25~30 ℃,夜晚(8 h)温度为23~25 ℃,每日早晚补充水分,以维持土壤水分为田间持水量的60%,盆栽在光照室中随机排位,并间歇性轮换,保证生长条件一致。每个处理3 个重复,种植70 d 后收获。用去离子水将紫花苜蓿清洗干净后用滤纸吸干,测定其株高、根长、鲜质量。采用四分法取土壤样品,其中一部分新鲜土壤样品存放于−20 ℃冰箱中用来分析微生物群落多样性,其余土壤冷冻干燥,研磨混匀过60 目筛后保存于4 ℃冷库中,用于测定土壤中PAHs 含量及土壤的理化性质。土壤理化性质的测定参考鲁如坤[23]描述的方法,具体包括:土壤pH、总氮、总磷、总钾、有机质、碱解氮、速效钾、速效磷、铵态氮、硝态氮、可溶性有机碳(DOC)和阳离子交换量(CEC)等。
1.4 土壤中PAHs含量的测定
土壤中PAHs 含量的测定方法参考MAO 等[24]的文章并稍作修改。冻干的土样通过60 目筛以均质化,然后与无水硫酸钠按1∶1 混匀后置于索氏提取管中,量取70 mL 二氯甲烷于茄型瓶中,在54 ℃下连续提取24 h。用旋转蒸发仪将萃取液浓缩至干,再加入环己烷(2.0 mL)对茄形瓶中的物质进行溶解。采用硅胶柱净化溶液(0.5 mL),使用正己烷−二氯甲烷混合液(1∶1,V/V)洗涤,收集洗脱液于刻度试管中,用氮气先吹至1 mL,再用乙腈定容至2 mL,重复该操作3次后过0.22µm 有机相滤膜,转移至进样瓶。采用日本岛津高效液相色谱(HPLC)仪测定溶液中PAHs 浓度,具体设置条件参考REN等[25]的文章。采用外标法定量(R2>0.999),该方法测得土壤中PAHs 的加标回收率为80.4%~98.2%。
1.5 土壤微生物群落分析
采用FastDNA®Spin Kit for Soil(MP Bio,美国)试剂盒提取土壤DNA。称取0.5 g 土壤样品,按说明书的提 取步骤进行。用Nanodrop®ND−1000 UV−Vis Spectrophotometer(NanoDrop Technologies,Wilming⁃ton,DE)检测核酸质量和纯度。将DNA样品置于−80 ℃冰箱备用。
高通量测序在广州美格基因科技有限公司进行,对16S rRNA基因的V5~V7区进行测序。前端引物序列为AACMGGATTAGATACCCKG,后端引物序列为ACGTCATCCCCACCTTC[26]。利用Quantitative Insights Into Microbial Ecology(QIIME)平台对测序得到的Fastq数据进行处理[27]。利用Trimmomatic软件分别对双端的Reads 数据进行质量过滤[28]。同时,利用Mothur软件去除barcode和引物得到质控后的paired−end clean reads[29],使用Usearch软件得到归一化(次抽样)OTU 表,用于后续数据分析[30]。计算原核生物群落在OTU 水平的α 多样性指数(香农指数和Chao 指数)。基于Bray−Curtis,采用非度量多维尺度法(NMDS)对β 多样性进行分析。采用Student′st−test检测不同类群间丰度具有显著差异的物种,挑选相对丰度>0.1%的显著差异菌属绘制热图。
采用荧光定量PCR方法,对16S rRNA和PAHs降解基因PAH−RHDα GN 和PAH−RHDα GP 进行定量测定[1]。16S rRNA 和PAH−RHDα 引物序列(见表1)。荧光定量PCR反应体系为10µL SYBR Premix Ex Taq(TaKaRa),0.4 µL 的前后引物(10 µmol·L−1),1.0 µL DNA 模板,加入无菌水补足至20µL。荧光定量PCR时,以无菌水代替模板DNA作为阴性对照。
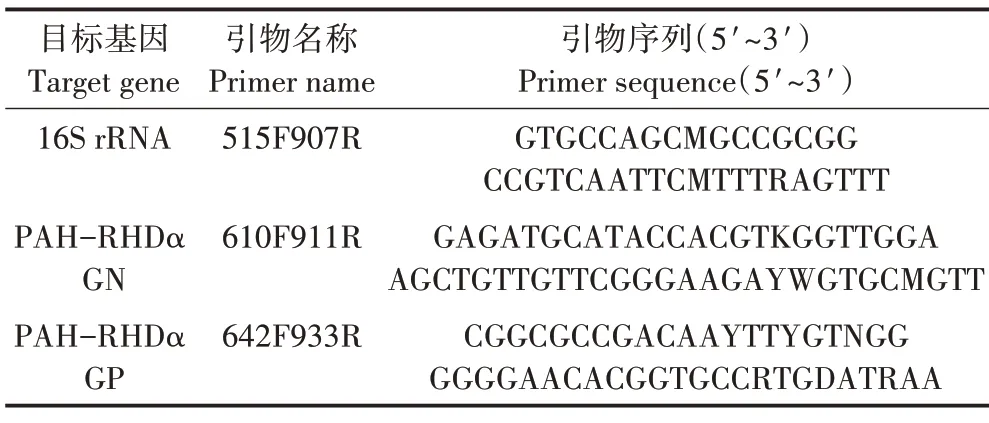
表1 荧光定量PCR使用的引物序列Table 1 Primer sequences used in real−time PCR
1.6 统计学分析
所有数据为3 个重复的平均值,误差棒表示标准差。采用SPSS 26.0 进行统计学分析,采用单因素方差分析分析不同处理之间的显著差异(P<0.05),并使用Origin 2019 软件绘图。基于Spearman 相关性分析方法分析土壤中5环、6环PAHs残留率与土壤中细菌群落相对丰度的相关性。
2 结果与讨论
2.1 SWCNTs的表征
通过BET 测定,得知SWCNTs 的比表面积为201.4 m2·g−1。图1 所示为SWCNTs 的SEM、TEM、FT⁃IR、Raman 和XPS 表征图。通过SEM 图可以直观看出,SWCNTs 是一种呈管状结构的材料,聚集且相互缠绕。由TEM 图可知,SWCNTs的基本结构是单根纳米碳管,管壁较薄,其内径4~10 nm,外径6~14 nm,其中部分纳米碳管相互聚集缠绕形成纳米碳管束。Ra⁃man 光谱是一种表征碳纳米材料表面晶体结构有序程度的重要手段。SWCNTs 材料表面会在1 360 cm−1和1 590 cm−1附近出现两个特征振动峰,分别为D 峰和G峰,D峰是非晶态碳原子的悬键振动,G峰是二维六边形晶格sp2杂化碳原子的E2g振动,D 峰和G 峰强度比值(ID/IG)表示碳纳米管石墨化程度,其值越低,表明石墨化程度越高[31]。如图1c所示,SWCNTs 的ID/IG为1.24。采用FTIR 对SWCNTs 的表面官能团进行定性分析(图1d),发现SWCNTs 在3 463 cm−1处有明显的吸收峰,这是O—H 键的伸缩振动,2 922 cm−1和2 853 cm−1处为饱和烃C—H 特征峰,1 697 cm−1处为羧酸或酮中键的对称伸缩振动峰,1 033 cm−1和1 385 cm−1处是羧基中C—O 的特征吸收峰及C—H面内弯曲振动,1 617 cm−1处出现的吸收峰则是SWCNTs 的键的特征峰,这些特征峰说明SWCNTs 中含有羧基[32−35]。采用XPS 对SWCNTs 的元素组成和基团进行分析(图1e),发现SWCNTs中主要含有C 元素(92.50%)和O 元素(6.65%),C 1s 的宽谱出现在286 eV 处,O 1s 的宽谱出现在533 eV 处。C 1s−XPS 峰中包含SWCNTs 石墨结构的C—C 峰、羟基和醚的C—O峰、醛醌酮的>峰和羧基峰,它们分 别出 现284.8、286.2、287.8 eV 和289.2 eV 处[32,36]。O 1s−XPS 峰可分解为3 类表面含O 物种,即、C—OH 和C—O—C,其对应结合能分别为531.0,532.8 eV和535.1 eV,这与FTIR得出的结果基本一致。
2.2 SWCNTs对紫花苜蓿根际降解PAHs的影响
如图2 所示,添加SWCNTs 在一定程度上抑制了土壤中PAHs 的去除,并且随着SWCNTs 添加量的增加,抑制程度逐渐增强。当SWCNTs 的添加量为0.5 g·kg−1和5 g·kg−1时,经过70 d的培养,土壤中PAHs的浓度从原始土壤的344.48 mg·kg−1降低到153.22 mg·kg−1和165.46 mg·kg−1,去除率分别为55.52% 和51.97%,相比于无添加的对照组(58.95%)显著降低了3.43 个和6.98 个百分点(P<0.05)。当SWCNTs 的添加量为0.1 g·kg−1时,土壤中PAHs 的残留量降低到146.24 mg·kg−1,虽仍高于对照(141.40 mg·kg−1)处理,但与对照处理无显著差异。
供试土壤中PAHs 主要为高分子量PAHs,4 环和5 环、6 环分别占总量的59.44%和29.62%。培养70 d后,添加SWCNTs对3环和4环PAHs的去除无显著影响,但显著抑制了5 环、6 环PAHs 的去除(图2b),尤其当SWCNTs 添加量为5 g·kg−1时,抑制作用最强。培养70 d 后,土壤中3 环和4 环PAHs 的残留率分别在35.24%和46.55%以下,对于5 环、6 环PAHs,当添加SWCNTs时,其残留率相比于仅种植紫花苜蓿的对照(37.47%)显著提高了8.68~18.73 个百分点(P<0.05)。此外,3 环PAHs 更易被降解,残留率更低(29.58%~35.24%)。SWCNTs 对土壤中高分子量PAHs 去除的抑制作用,一方面可能是因为相比于低分子量PAHs,高分子量PAHs 具有更强的疏水性,更容易被碳纳米材料吸附[37],从而降低土壤中高分子量PAHs的生物可利用性,抑制微生物对高分子量PAHs的获取[4],例如,SHRESTHA 等[13]发现添加碳纳米管可以显著降低土壤中PAHs 及其他有机污染物的生物可利用性。另一方面可能是因为添加SWCNTs 改变了土壤微生物群落组成,抑制了相关PAHs 降解微生物的相对丰度[20]。
2.3 SWCNTs对紫花苜蓿生长的影响
碳纳米材料因其在调控植物生长方面的有效作用而受到生物技术专家的广泛关注[18]。本研究通过测量植物的株高、根长并称取其地上部及根部鲜质量,发现添加SWCNTs 对紫花苜蓿的生长并未呈现出毒害效应,相反,在一定浓度下对紫花苜蓿的地上部或根部生长还具有一定的促进作用(图3)。当SWCNTs的添加量为0.1 g·kg−1时,紫花苜蓿的株高与对照相比提高了19.62%(P<0.05),但随着添加量继续增大,其对紫花苜蓿株高的影响不显著;当SW⁃CNTs 的添加量为5 g·kg−1时,显著促进了紫花苜蓿的根长、地上部鲜质量和根鲜质量(P<0.05),与对照相比分别增加了21.44%、49.13%和100.00%(图3)。也有研究报道添加一定浓度的碳纳米管可以显著促进紫花苜蓿根部伸长[38],认为紫花苜蓿可以将碳纳米管感知为胁迫因子,从而改变它们的基因表达并激活它们的生长,研究也表明SWCNTs 对土壤中PAHs 去除的抑制效应与其对植物生长的调控作用关系较小。
2.4 SWCNTs对土壤理化性质的影响
土壤中大量元素的供给,如氮和磷含量的提高可以增加异养微生物菌群的数量,从而促进对PAHs的生物降解[39−40]。本研究发现添加SWCNTs使部分理化指标发生显著变化,且不同浓度SWCNTs对土壤理化指标的影响不同。如图4 所示,相比于对照,当SWCNTs 的添加量为0.1 g·kg−1时,土壤中pH 和全氮含量显著降低,全钾、速效磷、速效钾、铵态氮和硝态氮的含量显著升高(P<0.05);当SWCNTs 的添加量为0.5 g·kg−1时,土壤中pH 显著降低(P<0.05),总钾、速效磷、速效钾、氨氮和DOC 含量显著升高(P<0.05);当SWCNTs 的添加量为5 g·kg−1时,土壤中总氮含量显著降低(P<0.05),总钾、有机质、速效磷、速效钾、氨氮和DOC含量显著升高(P<0.05)。
土壤中5环、6环PAHs的去除率降低可能是因为SWCNTs 导致土壤中全氮含量降低[41]。有研究表明碳、氮和磷的物质的量之比、氮素形态、pH 等因素都可能影响PAHs 的消减[42−43]。关于SWCNTs 导致的土壤理化性质的变化与PAHs 降解的关系还需进一步研究。
2.5 SWCNTs 对土壤细菌生物量、功能基因和细菌群落结构的影响
微生物降解被认为是土壤中PAHs 消减的主要途径[44]。本研究采用荧光定量PCR(qPCR)测定了培养70 d 后不同处理下总细菌(16S rRNA 基因)和PAHs 环羟基化双加氧酶(PAH−RHDα)GP 和GN 基因的表达量,结果如图5a~图5c 所示。添加SWCNTs时,16S rRNA、PAH−RHDα GP 和PAH−RHDα GN 的基因表达量相比于对照均无显著差异,表明添加SWCNTs 并未影响土壤中细菌生物量以及PAHs降解功能基因丰度,这与目前大多数研究报道有一定区别。已有研究表明,添加SWCNTs可以显著降低土壤酶活性和细菌生物量[45]。同样,CHUNG等[46]的研究也表明,添加一定浓度的碳纳米管可以降低土壤中的大部分酶活性和总体细菌生物量。这种差异可能是由于已报道研究中采用的SWCNTs与本研究供试SWCNTs的制备方法不同,从而导致其结构和表面组成不同[20,47]。
为了进一步探究SWCNTs 对土壤中细菌群落的影响,本研究通过高通量测序技术,在OTU 水平采用Chao 指数和Shannon 指数评估了SWCNTs 对细菌丰富度和多样性的影响。如图5d 和图5e 所示,SWCNTs 对土壤细菌群落的丰富度和多样性无显著影响,这可能是由于细菌群落对碳纳米材料具有一定的抗逆性,随着培养时间延长,细菌群落受SWCNTs的影响逐渐减弱,直至恢复。RODRIGUES 等[48]的研究表明,在培养3 d 时SWCNTs 对土壤细菌群落产生的显著影响在14 d 后消失。本课题组前期研究也发现,石墨烯在培养4 d时能显著促进土壤细菌生物量,但在21 d 后又恢复到对照水平[47]。基于Bray−Curtis距离的NMDS 排序对β 多样性进行分析(图5f),结果发现,每个处理的平行样本都能够较好地团聚在一起,且随着SWCNTs 添加量增加,各处理与对照的距离越来越远(stress=0.032),但在统计学上不存在显著差异(P>0.05)。土壤细菌群落结构的变化与土壤类型、碳纳米管类型及浓度有关。SHRESTHA 等[13]的研究发现,在砂质黏壤土中添加MWCNTs 对土壤微生物群落结构无显著影响,但在砂质壤土中添加高浓度的MWCNTs可以显著改变土壤微生物群落的结构。
2.6 SWCNTs对土壤微生物群落组成的影响
通过对土壤微生物群落更加细致的分析,发现添加SWCNTs 改变了土壤中一些门类和属类微生物的相对丰度,但主要的门类和属类组成并未发生改变。如图6a 所示,在门水平上,对照组中相对丰度较高的微生物类群主要包括变形菌门(Proteobacteria,59.72%)、放线菌门(Actinobacteria,15.00%)、髌骨细菌门(Patescibacteria,12.51%)、酸杆菌门(Acidobacte⁃ria,3.54%)和绿弯菌门(Chloroflexi,3.49%)。当添加SWCNTs 时,变形菌门的相对丰度随着SWCNTs 添加量的升高逐渐降低,各处理相比于对照降低了1.99%~13.53%,已有报道表明变形菌门广泛存在于PAHs污染土壤中,被认为是具有菲、芘以及苯并[a]芘降解潜力的主要微生物门类[49−51]。
进一步比较各处理中微生物群落在属水平上的变化,如图6b 和图7 所示。从图6b 可以看出,对照土壤中相对丰度较高的微生物属类主要包括Ramli⁃bacter(12.11%)、Lysobacter(6.62%)和Pseudarthrobac⁃ter(3.33%)等。当添加SWCNTs 时,不同添加量处理的土壤中Ramlibacter的相对丰度较对照相比均有所降低,降低了2.67%~3.08%,而Pseudarthrobacter的相对丰度较对照提高了1.43%~5.76%,此外,当添加0.1 g·kg−1和0.5 g·kg−1SWCNTs 时,Lysobacter的相对丰度分别提高了2.24%和1.83%,而当SWCNTs 添加量为5 g·kg−1时,该属类微生物的相对丰度降低了0.13%。Lysobacter在油田和PAHs 污染的土壤中经常被发现,且其相对丰度变化直接影响着PAHs 的降解[52−53]。多项研究已经证实Lysobacter可以促进碳转化和固氮过程,从而增强PAHs的生物修复作用[54−55]。
为了更加直观地比较各微生物属的变化,采用相对丰度>0.1%且具有显著差异(P<0.05)的菌属绘制热图,如图7 所示。当SWCNTs 的添加量为0.1 g·kg−1时,土壤中受SWCNTs 影响的显著差异菌属有7 个(富集6 个,抑制1 个);当SWCNTs 的添加量为0.5 g·kg−1和5 g·kg−1时,分别有4 个(富集3 个,抑制1 个)和11个(富集4个,抑制7个),表明随着SWCNTs添加量的增加,其对土壤细菌菌属种类及丰度的抑制作用增强。如Phenylobacterium、Reyranella和Brevundimonas的相对丰度在SWCNTs 添加量为0.1 g·kg−1和0.5 g·kg−1的处理无显著变化,而在添加量为5 g·kg−1的处理中被显著抑制(P<0.05),分别是对照处理相对丰度的63%、32%和36%,其中,Phenylobacterium和Reyranel⁃la的相对丰度与土壤中5环、6环PAHs残留率呈显著负相关(P<0.01)(表2)。已有研究也表明Phenylobac⁃terium相对丰度的变化与土壤中PAHs 的去除直接相关[25,56−58]。另外,本课题组前期研究采用稳定同位素核酸探针(DNA−SIP)技术也发现属于变形菌门的Ramlibacterd、Phenylobacterium和Lysobacter对苯并[a]芘具有降解功能[51]。此外,Pseudorhodoferax的相对丰度与对照相比也显著降低了62%(P<0.01)。Reyranella、Brevundimonas和Pseudorhodoferax也被多项研究认为是具有PAHs 降解能力的菌属[59−60]。本研究发现添加5 g·kg−1SWCNTs 显著降低了Phenylobac⁃terium、Reyranella、Brevundimonas和Pseudorhodoferax的相对丰度,表明较高含量的SWCNTs可以抑制污染土壤中PAHs 降解菌的数量,从而抑制PAHs 的去除。然而添加SWCNTs 对PAHs 降解基因PAH−RHDα GP和PAH−RHDα GN 的丰度均无显著影响,表明利用通用引物设计的潜在PAHs 降解菌的相对丰度没有发生显著变化,如Terrabacter和Bacillus,这与添加SWCNTs 对土壤微生物群落的分析结果一致,主要原因可能在于SWCNTs 改变的这几类具有降解潜力的微生物对PAHs 降解的途径或表达基因不一样。同时,添加一定浓度的SWCNTs 显著抑制了土壤中Bryobacter、Microvirga、Actinotalea和Sphingoaurantia⁃cus的相对丰度(图7),且Microvirga和Sphingoauranti⁃acus相对丰度的变化也与5环、6环PAHs 残留率呈显著负相关(表2,P<0.01和P<0.05),说明添加SWCNTs不仅抑制了与PAHs 降解相关菌属的相对丰度,还抑制了其他菌属的相对丰度。此外,碳纳米管因具有较大的比表面积,对PAHs 具有较高的吸附亲和力[11−13],因此当土壤中存在SWCNTs 时,一些高分子量的PAHs 可能竞争性地吸附到其表面,从而降低了其对PAHs 降解微生物的生物可利用性,进而微生物降解受到抑制,导致土壤中PAHs去除率降低[37,61]。

表2 Spearman相关性分析Table 2 Spearman correlation analysis
3 结论
(1)盆栽培养70 d 后,添加SWCNTs 处理显著抑制了土壤中5 环、6 环PAHs 的去除,其在土壤中的残留率相比于未添加SWCNTs 处理显著增加了8.68%~18.73%(P<0.05),且随着SWCNTs 添加量提高,抑制作用增强。添加SWCNTs 对紫花苜蓿生长并未产生毒害作用。
(2)添加SWCNTs 对土壤细菌生物量、细菌群落丰度和多样性无显著影响,但改变了土壤细菌群落组成。5 g·kg−1的SWCNTs 显著抑制了PAHs 潜在降解菌 属Phenylobacterium、Reyranella、Brevundimonas和Pseudorhodoferax的相对丰度。